富血小板血浆(PRP)凝胶联合TGF-β3对肌腱干细胞成软骨分化影响的实验研究
罗毅,汪敏加,苏全生,何本翔,邓友章,高伟强,姜河
(1.成都体育学院附属医院博士后工作站, 四川成都610041;2.成都体育学院运动与健康学院, 四川成都610041;3.成都中医药大学四川成都610075; 4.成都市第一人民医院骨科, 四川成都610041)
椎间盘退变是临床常见的疾病,可引起脊柱疼痛、腰疼、行走困难等多种临床症状,给患者带来巨大的痛苦,也给社会带来很大的经济负担[1]。椎间盘退变的病理过程伴随着椎间盘细胞、椎间盘细胞外基质的减少,而其细胞外基质成分主要是蛋白聚糖和Ⅱ型胶原蛋白,与软骨细胞相类似[2],因此可通过诱导骨髓间充质干细胞(BMSCs)分化成为软骨细胞来修复椎间盘退变[3]。因此,促进软骨生成、修复具有重要的临床意义。近年来,利用组织工程技术达到该目的逐渐成为研究的热点,富血小板血浆 (Platelet-rich plasma,PRP)来源于自体,激活后可形成三维多孔结构的凝胶,是组织工程技术中良好的支架材料[4]。PRP是血小板的浓缩物,富含有多种生长因子,具有极高的生物安全性,可促进细胞生长及组织修复,并可促进脂肪间充质干细胞向软骨细胞分化[5];肌腱干细胞可从肌腱中分离进行体外培养,具有自我更新能力及成骨、成软骨、成脂肪分化潜能,可作为组织工程技术中的种子细胞[6];TGF-β3是TGF-β超家族的成员,广泛表达于各种组织中,介导多种干细胞的分化过程,其可促进间充质干细胞成肌腱分化[7],还可促进软骨前体细胞分化为软骨细胞[8],但PRP凝胶及TGF-β3联合使用对肌腱干细胞成软骨分化的影响目前并不清楚,本文通过体外分离培养人跟腱来源肌腱干细胞,对PRP凝胶联合TGF-β3对肌腱干细胞成软骨分化的影响做初步探讨。
1 材料与方法
1.1 材料
1.1.1 试剂与材料
L-DMEM基础培养基:货号为11885084、胎牛血清FBS:货号为11011-8611、PBS缓冲液:货号为P1022、中性蛋白酶dispase:货号为D6430、Ⅰ型胶原酶:货号为C8140、胰蛋白酶-EDTA消化液:货号为T1300、100×青链霉素混合液:货号为P1400、凝血酶:货号为T8021、甲苯胺蓝染色液:货号为G2543,Solarbio公司;CD29-PE:货号为HUTS-21,BD Biosciences公司;CD90-PE:货号为130-097-932、CD34-FITC:货号为130-081-001、CD106-FITC:货号为130-104-124,上海振誉生物科技有限公司;BMP-2:货号为PHC7141、地塞米松:货号为D1383,Sigma公司;脯氨酸:货号为BP1824-ONY,北京百奥莱博科技有限公司; ITS Premix混合液:货号为092001344,西宝生物科技(上海)股份有限公司;维生素C:货号为D1184,上海宝曼生物科技有限公司;Sox9、CollagenⅡ、GAPDH引物,上海生工生物工程股份有限公司合成;RNAiso Plus:货号为9108、逆转录试剂盒:货号为RR037Q/A/B、荧光定量PCR试剂盒:货号为639519,Takara公司;GAPDH兔源一抗:货号为ab181602、Sox9兔源一抗:货号为ab185230、CollagenⅡ兔源一抗:货号为ab34712、羊抗兔二抗:货号为ab150077,Abcam公司;RIPA裂解液:货号为P0013K、BCA试剂盒:货号为P0011,碧云天生物技术研究所等
1.1.2 仪器
S-520扫描电镜:日立公司;Model 680酶标仪:美国Bio-Rad公司生产;CKX53倒置相差显微镜:日本Olympus 公司生产;1659001蛋白电泳仪、Trans-Blot SD半干转膜仪、CFX96 Touch Deep Well荧光定量PCR仪:美国Bio-Rad公司;3900型高通量DNA合成仪:美国应用生物系统公司;RM2235石蜡切片机:德国Leica公司;Centrifuge 5424R低温高速离心机:德国 Eppendorf 股份公司等。
1.2 方法
1.2.1 细胞培养及培养基的配制
hTSCs完全培养基:在L-DMEM基础培养基中加入10 %胎牛血清、100 U/mL的青霉素、链霉素混合液混匀。
hTSCs的体外分离、培养:参照文献[9],收集医院骨科急性跟腱断裂患者(经知情同意)行跟腱缝合修补术时修剪的跟腱组织,在超净工作台中,以加入100 U/mL的青霉素、链霉素混合液的PBS漂洗干净,,剪除表面部分结缔组织,分离得到跟腱组织,将其剪为1 mm3的碎块置于10 mL离心管中,加入10倍量浓度为1 %dispase酶、Ⅰ型胶原酶的混合液(比例为1∶1),在37 ℃水浴中消化2 h,采用血清终止消化,以1 000 r/min的转速离心5 min,得到细胞沉淀,加入hTSCs完全培养基混匀,以孔隙为70 μm的细胞筛网过滤形成单细胞悬液,然后以以1 000 r/min的转速离心5 min,离心管底部的细胞沉淀以完全培养基重悬混匀,计数后以5×105个/mL的密度后接种在25 cm2培养瓶中,在37 ℃、5 % CO2 恒温培养箱中培养,每3天更换一次完全培养基(弃去未贴壁细胞),培养约1周左右,胰酶消化后以完全培养基重悬混匀(记为原代细胞),采用有限稀释法接种于96孔培养板中,使每孔细胞为1~3个,在37 ℃、5 % CO2恒温培养箱中培养12 h后标记出单个细胞的孔,待单细胞克隆生长至孔底80 %时,胰酶消化后合并多个单克隆细胞扩大培养,取第1~3代细胞用于后续实验。
hTSCs成软骨分化培养基的配制[10]:在L-DMEM基础培养基中加入10 %胎牛血清、100 nmol/L地塞米松、100μg/mL丙酮酸盐、40 μg/mL脯氨酸、50 mg/mL ITS Premix混合液(含6.25 mg/mL胰岛素、6.25 mg/mL转铁蛋白、6.25 mg/mL亚硒酸、1.25 mg/m牛血清白蛋白、5.35 mg/mL亚油酸)、500 ng/mL BMP-2、50 mg/L维生素C混匀。
1.2.2 TSCs鉴定
CD29、CD90是hDPSCs的标志抗原,CD34、CD106分别是造血干/祖细胞、血管内皮细胞表面的标志抗原[11]。流式细胞术检测上述标志抗原:将“1.2.1”中的第2代细胞胰酶消化后以完全培养基重悬混匀,计数后取含有5×105个细胞的单细胞悬液以1 000 r/min的转速离心5 min,细胞沉淀中加入300 μL含有1 μg CD29-PE、CD90-PE、CD34-FITC、CD106-FITC抗体的Buffer,4 ℃下避光孵育45 min,PBS 洗2次,12 000 g离心5 min,重悬于300 μL预冷的PBS中,以PE或FITC标记的同型匹配的IgG作为阴性对照。采用流式细胞仪分选分析,以FlowJo软件分析结果,计算阳性表达细胞百分率。
1.2.3 PRP凝胶的制备及其细胞相容性的检测
“1.2.1”中的患者自体静脉采血10 ml全血,参照文献[12],平分置入含1 ml复方枸橼酸钠的2个10 mL抗凝管中摇匀,以200 g的离心力离心10 min,吸取全部上清液至交界面下2 mm转移至另一离心管内,待溶液平衡后再以以200 g的离心力离心10 min,吸去3/4的上清液弃去,剩余部分即为PRP。将PRP与激动剂(由1 mL 10 %氯化钙与1 000 U凝血酶混合而成)以9∶1的比例混合摇匀,静置约2 min,形成PRP凝胶,经固定、脱水、干燥、导电处理后行扫描电镜检测其立体结构。
“1.2.1”中的第2代细胞胰酶消化后以完全培养基重悬混匀,计数后取细胞浓度为1×106个/mL的单细胞悬液,将其与自体PRP以1∶6的比例混合均匀后,按比例加入激活剂形成凝胶,加入完全培养基在37 ℃、5 % CO2恒温培养箱中培养,每3天换一次培养液,1周后经上述方法处理后行扫描电镜扫描检测PRP凝胶-hTSCs复合物。按上述方法制备PRP凝胶-hTSCs复合物接种在于96孔培养板中,以未加PRP凝胶处理的细胞作为对照组(control),每组设4个孔,分别在0 d、1 d、3 d、7 d、14 d、21 d后加入CKK-8试剂,继续培养2 h,以全自动酶标仪测定450 nm波长下各孔吸光度(optical density,OD),计算各组细胞在相应时间的相对增殖率,以0 d时对照组相对增值率为100 %。公式为:相对增殖率(%)=药物处理组OD值/0d时对照组OD值×100 %。
1.2.4 细胞处理及分组
以L-DMEM基础培养基将TGF-β3配制为1 μg/mL的储备液备用。“1.2.1”中的第2代细胞胰酶消化后以完全培养基重悬混匀,计数后取细胞浓度为1×106个/mL的单细胞悬液接种在2个24孔培养板中,随机分为对照组(control)、TGF-β3组、PRP凝胶组、PRP凝胶+ TGF-β3组四组,以1.2.3中的方法制备PRP凝胶-hTSCs复合物后,根据分组加入TGF-β3处理细胞(使终浓度为10 ng/mL)[13],并同时更换所有细胞培养基为成软骨分化培养基,21 d后,一板细胞control组、TGF-β3组以4 %多聚甲醛固定,PRP凝胶组、PRP凝胶+ TGF-β3组取出并固定PRP凝胶-hTSCs复合物,石蜡包埋后切片,然后做甲苯胺蓝染色。另一板细胞用胰酶消化后,分别收集各组细胞进行后续实验。
1.2.5 成软骨分化染色实验
“1.2.4”中的control组、TGF-β3组细胞,蒸馏水漂洗后,加入甲苯胺蓝染色液侵染30min,蒸馏水漂洗后在显微镜下观察,PRP凝胶组、PRP凝胶+ TGF-β3组石蜡切片,经脱蜡、透明、梯度酒精(由高到低)浸泡、蒸馏水漂洗后,加入甲苯胺蓝染色液侵染30 min,蒸馏水漂洗、梯度酒精(由低到高)脱水、透明后封片,在显微镜下观察并拍照。
1.2.6 Sox9、CollagenⅡ表达的检测
“1.2.4”中收集的细胞,加入RNAiso Plus提取总RNA、操作步骤参照说明书,采用逆转录试剂盒及荧光定量PCR试剂盒逆转录为cDNA后进行荧光定量PCR反应,以GADPH为内参基因,操作步骤、反应体系的配制、反映条件的设定依照说明书进行,qRT-PCR引物序列见表1,以2-ΔΔCt的算法对各组两种基因mRNA相对表达量进行分析。

表1 qRT-PCR引物序列Tab.1 Primer Sequence of qRT-PCR
“1.2.4”中收集的各组细胞,加入含蛋白酶抑制剂的RIPA裂解液吹打均匀,在4 ℃下裂解2 h、以3 000 r/min的转速离心20 min,收集上清,以BCA试剂盒测定总蛋白浓度,操作步骤参照说明书,调整各组蛋白浓度使之相同,根据目的蛋白分子量配制适宜浓度的SDS-PAGE胶,在电泳仪中对各组20 μg蛋白样品进行电泳分离,转移目的蛋白至PVDF膜上,加入5 %脱脂牛奶,室温封闭1.5 h,加入相应一抗,4 ℃孵育过夜,TBST溶液漂洗,加入羊抗兔二抗,室温孵育2 h,TBST溶液漂洗,采用ECL显色,将条带置于凝胶成像仪中观察蛋白相对表达量。
1.3 统计分析
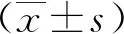
2 结果
2.1 hTSCs的鉴定结果
流式细胞检测结果显示,体外分离培养传代的hTSCs CD29、CD90标志抗原的表达分别达到99.08 %、99.88 %,而CD34、CD45、CD133标志抗原的表达分别仅为0.08 %、0.09 %,见图1,表明本研究分离培养传代的hTSCs是高纯度的肌腱干细胞。


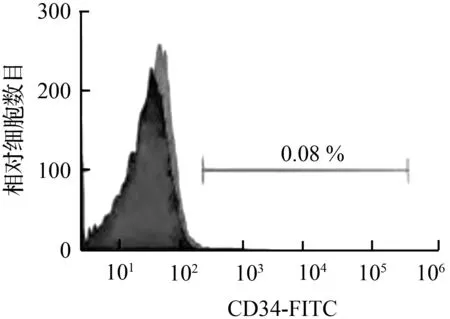
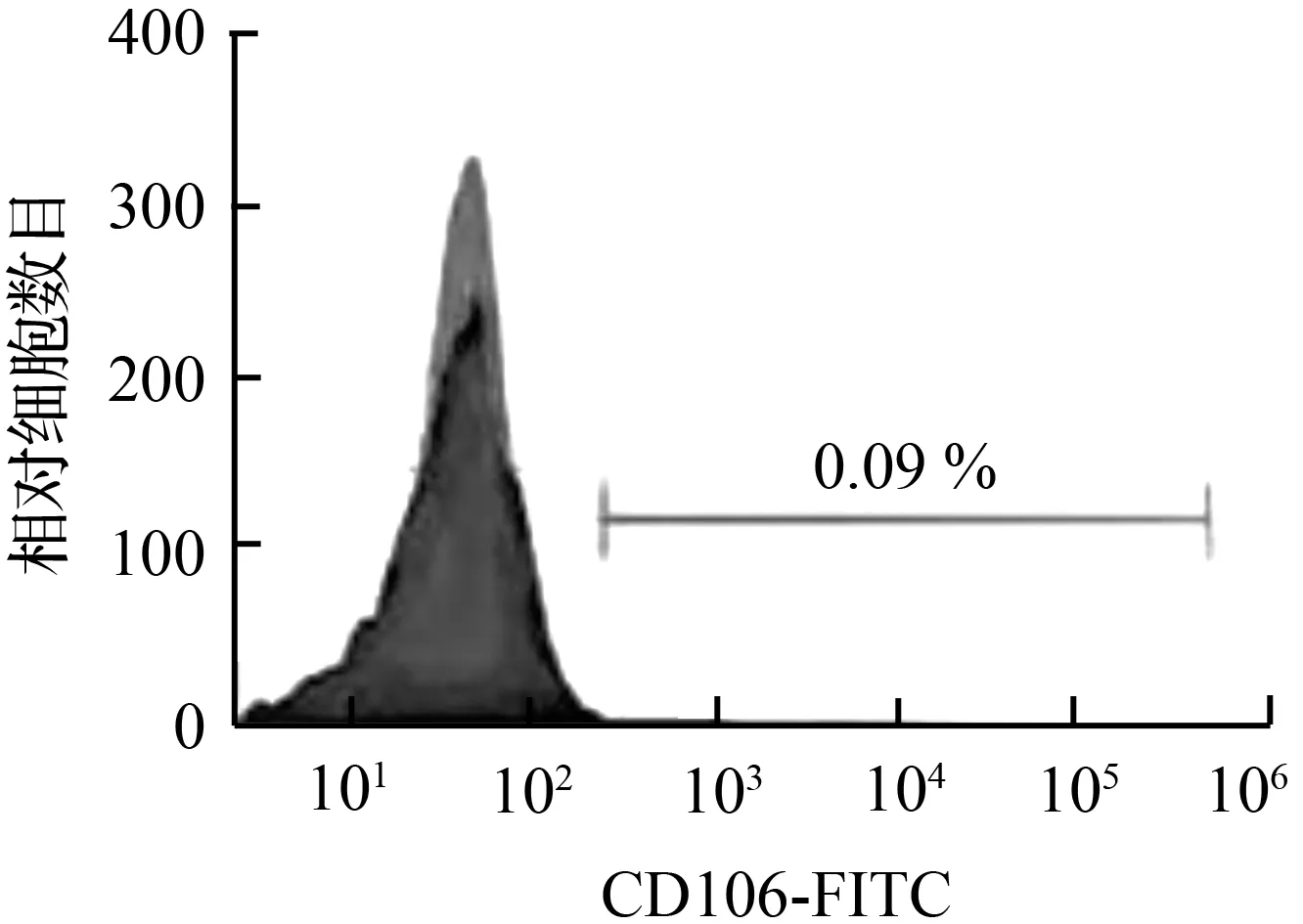
图1 hDPSCs的流式细胞鉴定结果Fig.1 Flow cytometric identification of hDPSCs
2.2 PRP凝胶的细胞相容性
对PRP凝胶进行扫描电镜观察,可见PRP凝胶形成了立体网状的三维结构,凝胶的框架由纤维素组成,该结构孔隙均匀,血小板在其中均匀分布,且附着良好。PRP凝胶-hTSCs细胞复合物也为立体网状三维结构,在其中,hTSCs细胞牢牢附着在纤维网状结构中,并且生长情况良好。Control组及PRP凝胶组细胞在7 d后增殖趋于稳定,与control相比,PRP凝胶处理的hTSCs相对增值率呈上升趋势,在7 d后差异具有统计学意义(P<0.05),见图2、3。

PRP凝胶三维结构

PRP凝胶TSCs复合物三维结构
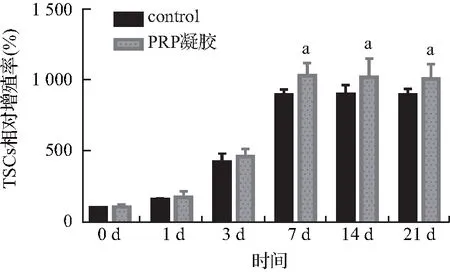
图3 PRP凝胶对hTSCs增殖的影响Fig.3 Effect of PRP gel on hTSCs proliferation
2.3 PRP凝胶联合TGF-β3对肌腱干细胞成软骨分化的影响
与control组相比,TGF-β3组、PRP凝胶组、PRP凝胶+ TGF-β3组细胞成软骨细胞比例增加(P<0.05);与TGF-β3组、PRP凝胶组分别相比,PRP凝胶+ TGF-β3组细胞成软骨细胞比例均增加(P<0.05),见图4、5。



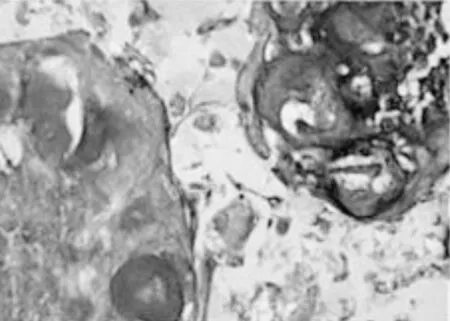
图4 各组肌腱干细胞成软骨分化结果(×200)Fig.4 Chondrogenic differentiation of tendon stem cells in each group(×200)

图5 各组肌腱干细胞成软骨分化细胞比例Fig.5 Proportion of chondrogenic differentiation cells of tendon stem cells in each group
注 A:control组;B:PRP凝胶组;C:TGF-β3组;D:PRP凝胶+ TGF-β3组。与control组相比,aP<0.05;与TGF-β3组、PRP凝胶组分别相比,bP<0.05。
2.4 各组hTSCs Sox9、CollagenⅡmRNA的表达
与control组相比,TGF-β3组、PRP凝胶组、PRP凝胶+ TGF-β3组细胞Sox9、CollagenⅡmRNA的相对表达量增加(P<0.05);与TGF-β3组、PRP凝胶组分别相比,PRP凝胶+ TGF-β3组细胞Sox9、CollagenⅡmRNA的相对表达量均增加(P<0.05),见图6。

图6 各组细胞Sox9、CollagenⅡmRNA的相对表达量Fig.6 Relative expression of Sox9 and Collagen II in cells of each group
注 A:control组;B:PRP凝胶组;C:TGF-β3组;D:PRP凝胶+ TGF-β3组。与control组相比,aP<0.05;与TGF-β3组、PRP凝胶组分别相比,bP<0.05。
2.5 各组hTSCs Sox9、CollagenⅡ蛋白的表达
与control组相比,TGF-β3组、PRP凝胶组、PRP凝胶+ TGF-β3组细胞Sox9、CollagenⅡ蛋白的相对表达量增加(P<0.05);与TGF-β3组、PRP凝胶组分别相比,PRP凝胶+ TGF-β3组细胞Sox9、CollagenⅡ蛋白的相对表达量均增加(P<0.05),见图7、8。

图7 各组细胞Sox9、CollagenⅡ蛋白的免疫印迹检测结果
Fig.7 Immunoblotting results of Sox9 and Collagen Ⅱ proteins in cells of each group
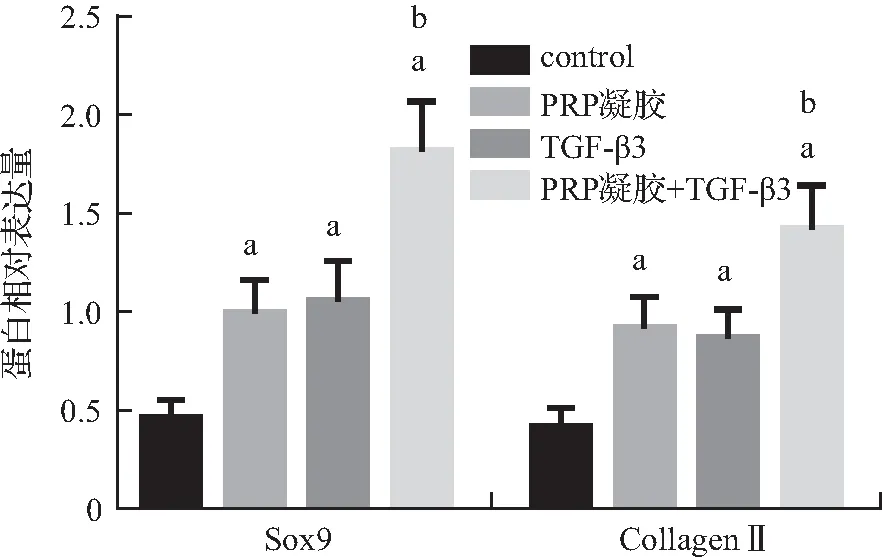
图8 各组细胞Sox9、CollagenⅡ蛋白的相对表达量
Fig.8 Relative expression of Sox9 and Collagen Ⅱ proteins in cells of each group
注 A:control组;B:PRP凝胶组;C:TGF-β3组;D:PRP凝胶+ TGF-β3组。与control组相比,aP<0.05;与TGF-β3组、PRP凝胶组分别相比,bP<0.05。
3 讨论
椎间盘退变的主要机制是细胞外基质的主要成分Ⅱ型胶原及蛋白聚糖含量减少,进而造成椎间盘高度逐渐降低,同时引起椎间盘负重关节面及其他结构也发生相应改变,因细胞外基质的主要成分与软骨细胞成分相类似[14],通过组织工程技术促使种子细胞向软骨分化提高椎间盘细胞外基质的含量,是预防和治疗椎间盘退变的一条重要策略。性能优良的支架材料及合适的种子细胞的选取是目前构建可注射组织工程骨的关键步骤,肌腱干细胞(TSCs)是2007年学者首次从肌腱中分离出的能自我更新的细胞,该细胞具有多向分化潜能,即可向成骨细胞、成软骨细胞、脂肪细胞分化,可作为组织工程技术中合适的种子细胞[15]。研究表明,TSCs在体外培养时相比种子细胞骨髓间充质干细胞(BMSCs)表现出更快地增殖速度以及更高的分化潜能,取代BMSCs作为股骨头坏死组织修复中的种子细胞,治疗股骨头坏死疗效更好[16]。PRP凝胶是自体血液两次离心后,激活得到的具有三维立体结果的胶体,无免疫源性,是组织工程技术中良好的支架材料,含有高浓度的血小板及大量的生长因子,有利于促进种子细胞增殖、分化[17]。研究表明,PRP作为支架材料,和BMSCs具有良好的生物相容性,并能在一定程度上促进BMSCs成软骨分化[18],TSCs分化时受到生物活性因子、细胞外基质的改变、生物支架材料的选择等多种因素的影响[19],因而预计PRP凝胶可能促TSCs成软骨分化。研究表明,TGF-β3可介导大鼠跟腱来源肌腱干细胞多方向分化,短时间、低浓度的TGF-β3刺激会抑制TSCs向非肌腱方向分化,而高浓度、长时间TGF-β3刺激会促进其向成骨、成软骨等方向分化[20],但PRP凝胶联合TGF-β3对肌腱干细胞成软骨分化的影响目前并不明确,本研究分离、培养了人肌腱中TSCs,采用流式细胞技术检测了细胞表面抗原,结果显示细胞高表达干细胞标记物CD29和CD90,与BMSCs表面标记物相似,而造血干/祖细胞表面标记物CD34、血管内皮细胞表面标记物CD106的表达呈阴性,表明本研究提取的TSCs非血液细胞来源,且未受其污染,揭示本研究从人肌腱中分离、培养出了高纯度的TSCs,为后续研究打下了良好的基础。后续研究结果显示,PRP凝胶具有良好的细胞相容性,并对hTSCs有一定的促增殖作用。与control组相比,TGF-β3组、PRP凝胶组、PRP凝胶+ TGF-β3组细胞成软骨细胞比例、Sox9、CollagenⅡ表达均增加;与TGF-β3组、PRP凝胶组分别相比,PRP凝胶+ TGF-β3组细胞成软骨细胞比例、Sox9、CollagenⅡ表达均增加。表明PRP凝胶和hTSCs具有良好的生物相容性,可促其增殖,和TGF-β3相同,可促其成软骨分化,两者联合其促成软骨分化作用进一步增强。揭示PRP凝胶和hTSCs可能是构建可注射组织工程骨合适的支架材料及种子细胞,TGF-β3可促进其成软骨分化。
综上所述,PRP凝胶、TGF-β3都对人肌腱干细胞的成软骨分化能力有促进作用,两者联合具有协调作用,这为临床上利用组织工程技术预防和治疗椎间盘退变,构建组织工程骨,修复关节软骨损伤、股骨头坏死等提供了新的参考,但PRP凝胶联合TGF-β3对hTSCs成骨、成脂分化的影响本研究未进行探讨,还需要进一步的深入研究。

