黑曲霉H9-30全细胞催化合成低聚异麦芽糖
黄楠,周波,叶童,陈桂光,梁智群,曾伟*
1(亚热带农业生物资源保护与利用国家重点实验室(广西大学),广西 南宁,530004) 2(广西大学 生命科学与技术学院,广西 南宁,530004)
低聚异麦芽糖(isomaltooligosaccharides,IMO)是一类由α-1,6糖苷键连接葡萄糖基形成的功能性低聚糖[1-2]。IMO可促进短链脂肪酸产生,降低肠道内pH值以减少致病菌,还能促进结肠中双歧杆菌和乳酸杆菌群的增殖,抑制肠道病原体的生长[3-4]。在食品中添加IMO能防止淀粉老化,延长食品的保质期[5]。作为益生元和膳食纤维的IMO具有热值低、促益菌、防龋齿、稳定性高等优点,现被广泛用于食品行业。
IMO起初作为一种淀粉酶解的副产物,发现于葡萄糖生产过程中。生产IMO的传统方法有2种:(1)由α-淀粉酶(EC 3.2.1.1)、β-淀粉酶(EC 3.2.1.2)和α-葡萄糖苷酶(EC 3.2.1.20)协同转化生成[6-7];(2)由α-葡糖苷酶与新普鲁兰酶(EC 3.2.1.135)协同转化生成[8]。使用游离酶生产低聚异麦芽糖成本高且生产过程繁琐。目前国内外相关领域的研究主要集中在高产α-葡萄糖苷酶新菌株的选育[9-10]、新型α-葡萄糖苷酶的分离纯化及其酶学性质研究[11-13]、固定化细胞和固定化酶[14-15]等方面。然而,IMO的工业化生产仍面临成本高,转化时间长,转化率低等问题[16]。因此,有必要寻找一种低耗、高效的方法生产IMO。
全细胞催化是一种利用完整生物体作为催化剂进行生物转化的方法,其因制备简单、生产成本低和催化效率高等优点,被广泛应用于各类产物的合成,如蔗果低聚糖[17]、茶多酚[18]、阿糖腺苷[19]等。OJHA等[20]利用微杆菌(Microbacteriumsp.)全细胞转化麦芽糖合成IMO,其IMO转化率达到58%,取得较好成果,但其菌体无法回收利用;徐燕杉[21]以黑曲霉(Aspergillusniger)α- 葡萄糖苷酶在毕赤酵母(Pichiapastoris)的表面展示,催化合成IMO,其初始IMO转化率为45%,但重复利用3次后转化率降低至30%。黑曲霉作为一种丝状真菌有产酶能力强,菌体便于回收等特点,是用于全细胞转化生产IMO的理想菌种。开展这一方向的研究工作,有利于进一步降低商品IMO的生产成本和增加IMO的工业生产效率。
实验室在前期工作中通过复合诱变选育得到1株产α-葡萄糖苷酶的黑曲霉菌株H9-30,其菌体转苷活力达24 000 U/g。本文以黑曲霉H9-30全细胞作为生物催化剂,以麦芽糖作为反应底物,探究转化合成IMO的最优条件,并重复利用黑曲霉细胞生产IMO,以期为其工业化应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
黑曲霉H9-30,酿酒酵母(Saccharomycescerevisiae) GXJ-1:保藏于广西大学生命科学与技术学院食品发酵工程实验室。
1.1.2 试剂
葡萄糖、麦芽糖、异麦芽糖、麦芽三糖、潘糖、异麦芽三糖标准品:美国Sigma-Aldrich公司。
1.1.3 培养基
斜面培养基(g/L):麸皮汁30,麦芽糖 30,琼脂20,pH 5.0。麸皮种子培养基:麸皮8 g,蒸馏水4 mL,自然pH。发酵培养基(g/L):玉米淀粉80,玉米浆干粉40,醋酸钙0.8,甲基-葡糖胺0.1,pH 4.8。酵母培养基(g/L):麦芽糖10,胰蛋白胨5,酵母粉5。培养基于115 ℃灭菌30 min。
1.2 仪器与设备
LC-10AT型高效液相色谱仪,日本岛津公司;SW-CJ-1F超净工作台,苏州安泰空气技术公司;METTLER TOLEDO PL303精密电子天平,德国METTLER公司;SKY-211B振荡培养箱、SKY-110WX恒温水浴摇床、SKJH-1109超净工作台,上海苏坤公司。
1.3 实验方法
1.3.1 黑曲霉细胞的培养与收集
取培养60 h长满成熟孢子的种子,用无菌的生理盐水将孢子洗下,以6层纱布将其过滤至含有玻璃珠的250 mL三角瓶中,得到孢子悬液。悬液在34 ℃, 220 r/min下振荡30 min将孢子打散。以血球计数板法计算孢子数量,并将孢子悬液浓度调至1×107个/mL。将浓度为1×107个/mL的孢子悬液以体积分数1%接种至含50 mL发酵培养基的500 mL三角瓶中,在34 ℃,220 r/min的振荡培养箱中培养42 h。将发酵液抽滤,以10倍体积的去离子水冲洗3次后收集细胞。
1.3.2 黑曲霉细胞的预处理
黑曲霉细胞菌体在2 g/L麦芽糖的NaH2PO4-Na2HPO4缓冲液(20 mmol/L,pH 6.0)中重悬,在52 ℃ 下保温30 min致死细胞。以10倍体积的去离子水冲洗致死后的黑曲霉细胞,重复冲洗3次后于40 ℃恒温干燥箱放至恒重。
1.3.3 IMO的转化参数
1.3.3.1 温度对全细胞转化合成IMO的影响
将黑曲霉细胞α-葡萄糖苷酶与底物于37、42、45、48、50、52、55、60、70 ℃分别保温30 min后混匀,整个体系于pH 6.0的Britton-Robison缓冲液(20 mmol/L) 中反应。以300 g/L的麦芽糖为底物检测不同温度下α-葡萄糖苷酶的转苷活力,考察黑曲霉细胞α-葡萄糖苷酶的最适转苷温度。将黑曲霉细胞于45、48、50、52 ℃保温24 h,考察黑曲霉细胞α-葡萄糖苷酶的热稳定性。
1.3.3.2 反应初始pH值对全细胞转化合成IMO的影响
将黑曲霉细胞α-葡萄糖苷酶与底物溶于pH值为3.0、4.0、4.2、4.5、5.0、5.5、6.0、7.0、8.0、9.0的Britton-Robison缓冲液,测定在不同pH值下α-葡萄糖苷酶转苷活力,考察最适初始转苷pH值。将α-葡萄糖苷酶与底物溶于pH值为4.0、4.2、4.5的Britton-Robison缓冲液,在最适反应温度下保温24 h,混合体系于37 ℃测定酶的保留活力。
1.3.3.3 底物浓度对全细胞转化合成IMO的影响
将黑曲霉细胞添加至含麦芽糖100、200、300、400、500、600、800 g/L的Britton-Robison缓冲液中,在最适温度和pH值下转化生成IMO,考察底物浓度对全细胞转化合成IMO的影响。
1.3.3.4 黑曲霉细胞添加量对IMO合成的影响
将黑曲霉细胞以5、10、15、20 g/L添加至含有100 mL最适转化浓度麦芽糖浆的250 mL三角瓶中,以最适温度和pH值下转化底物。跟踪转苷反应,考察黑曲霉细胞添加量对IMO合成的影响。
1.3.4 IMO的全细胞转化及纯化
将黑曲霉细胞添加至麦芽糖浆中,在最适转苷温度与pH值下反应,得到IMO与可发酵性糖(葡萄糖、麦芽糖等)的混合液。以酿酒酵母消耗混合液中的可发酵性糖[22],得到纯化的IMO。
1.3.5 α-葡萄糖苷酶转苷活力的测定
1.3.5.1 α-葡萄糖苷酶转苷活力的定义
在37 ℃、pH 4.2,300 g/L麦芽糖条件下,每小时转化麦芽糖生成1 μg有效三糖(eIMO,包括异麦芽糖、潘糖和异麦芽三糖)所对应的酶量定义为1个酶活力单位(U)。
1.3.5.2 菌丝体α-葡萄糖苷酶转苷活力的测定方法
取黑曲霉细胞0.03 g于10 mL EP管中,加入5 mL以pH 4.2,20 mmol/L的醋酸-醋酸钠缓冲液配制的300 g/L麦芽糖溶液,混匀,37 ℃水浴1 h。沸水浴10 min 终止转苷反应。使用配有Ecosil NH2柱(5 μm,4.6 mm×250 mm)和Waters Sugar-Pak 1柱(10 μm,6.5 mm×300 mm)的色谱系统,以HPLC分析eIMO,以确定转苷活力。色谱条件参照GB/T 20881—2007,《低聚异麦芽糖》强制性国家标准中的检测方法。
2 结果与分析
2.1 温度对黑曲霉细胞转苷反应的影响
反应温度影响细胞中α-葡萄糖苷酶的活力和稳定性。由图1-A可知,黑曲霉细胞中的α-葡萄糖苷酶在52 ℃转苷活力达到最大,且在45~55 ℃的转苷活力为最高活力的80%以上。由图1-B可见,反应体系的温度对α-葡萄糖苷酶的稳定性影响较大。在48 ℃的α-葡萄糖苷酶稳定性明显高于50 ℃。这是由于α-葡萄糖苷酶随着温度的升高,酶逐渐失活造成[16]。虽然细胞中α-葡萄糖苷酶在52 ℃表现出最大转苷活力,但其稳定性远低于48 ℃。反应温度越低,α-葡萄糖苷酶的稳定性越高,但过低的转化温度会导致转化时间延长。在实际应用中,若反应温度低于48 ℃,反应过程中的杂菌污染情况严重,因此本研究选择反应温度为48 ℃。
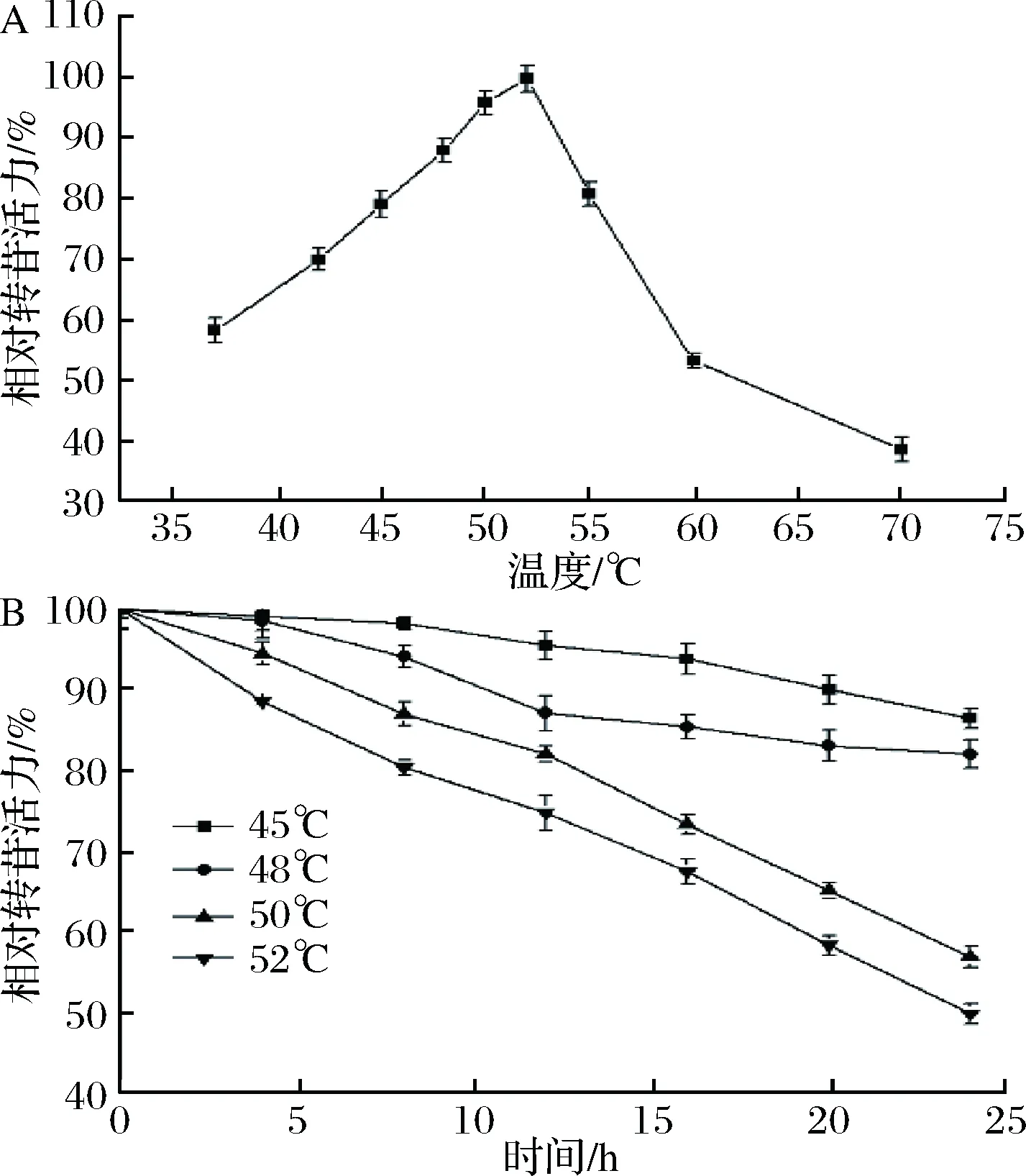
A-温度对黑曲霉细胞α-葡萄糖苷酶转苷活力的影响;B-温度对黑曲霉细胞α-葡萄糖苷酶稳定性的影响图1 温度对黑曲霉细胞α-葡萄糖苷酶转苷反应的影响Fig.1 Effect of temperature on α-glucosidase transglycosylation of A. niger cells
2.2 初始pH值对黑曲霉细胞转苷反应的影响
由图2-A可知,在弱酸性环境中α-葡萄糖苷酶的转苷活力较强,这与固定化后的转移葡萄糖苷酶性质相似[23]。黑曲霉细胞α-葡萄糖苷酶的最适转苷初始pH值为4.2,细胞中α-葡萄糖苷酶的转苷活力在pH值4.0~5.0保持较高值(大于80%)。然而,当反应体系pH值为4.0时,α-葡萄糖苷酶的相对转苷活力随着保温时间的增加急剧下降(图2-B)。这是由于酶在超过耐酸阈值后逐渐变性失活所致。为保证较高的转化效率和反应中酶的稳定性,本研究选择初始pH值为4.2。

A-初始pH值对黑曲霉细胞α-葡萄糖苷酶转苷活力的影响;B-初始pH值对黑曲霉细胞α-葡萄糖苷酶稳定性的影响图2 初始pH值对黑曲霉细胞α-葡萄糖苷酶转苷反应的影响Fig.2 Effect of initial pH value on α-glucosidase transglycosylation of A. niger cells
2.3 麦芽糖浓度对黑曲霉细胞转苷反应的影响
底物浓度通过改变酶的区域选择性影响转苷反应[24]。α-葡萄糖苷酶在底物浓度远高于酶浓度时,酶作用于底物非还原端的1,4-糖苷键,并将切下的活性糖基供体转移至糖基受体形成新的1,6-糖苷键,从而表现出转糖苷活性[25]。实验在48 ℃和pH值为4.2的条件下,探究了麦芽糖质量浓度(200~1 000 g/L)对菌丝体转苷反应的影响。由图3-A可知,反应体系中麦芽糖质量浓度对菌丝体中α-葡萄糖苷酶的转苷活力影响显著。在实验浓度范围内,α-葡萄糖苷酶转苷活力随底物浓度增加呈指数增长(y=4.221exp(x/25.981)+8.211,R2=0.996),这意味着单位时间底物的转化速率大大增加。OJHA等[20]曾报道α-葡萄糖苷酶在高底物浓度下表现出强烈的转苷作用,VETERE等[24]曾通过调节底物浓度改变酶的区域选择性影响转苷反应,但α-葡萄糖苷酶转苷活力随底物浓度上升呈指数型升高尚属首次报道。
然而,较高的转苷活力并未使底物转化率显著提升。向麦芽糖浓度为300、600、800 g/L的反应体系中添加等量的黑曲霉细胞,反应终点的eIMO含量分别为154.3 g/L(图3-B)、312.2 g/L(图3-C)、316.8 g/L(图3-D)。反应初期(0~10 h),eIMO的产生速率随麦芽糖质量浓度升高而加快。但这种转苷速率提升的现象随反应时间的延长逐渐消失。麦芽糖质量浓度为800 g/L 时,eIMO在84 h达到最大值,远高于300 g/L麦芽糖下达到最大eIMO所需时间(20 h)。

A-麦芽糖浓度对黑曲霉细胞α-葡萄糖苷酶转苷活力的影响;B-麦芽糖浓度对eIMO合成的影响图3 麦芽糖浓度对黑曲霉细胞α-葡萄糖苷酶转苷反应的影响Fig.3 Effect of the concentration of maltose on transglycosylation of A. niger α-glucosidase
这是由于在反应过程中,反应体系的组分改变引起pH值降低,α-葡萄糖苷酶逐渐失活所致。在麦芽糖质量浓度大于600 g/L时形成的高渗透压下,反应体系的微生物污染率低,有利于工业化生产。而过高的麦芽糖质量浓度使低浓度缓冲体系无法在反应过程中维持酸碱平衡,较高的缓冲液质量浓度对产品品质不利。由此,本研究选择麦芽糖质量浓度为600 g/L进行反应。
2.4 黑曲霉细胞添加量对转苷反应的影响
由图4可知,eIMO合成速率随黑曲霉细胞添加量的增加而上升。

图4 黑曲霉细胞添加量对转苷反应的影响Fig.4 Effect of A. niger cell content on transglycosylation in the reaction system
eIMO产率在细胞添加量为5~15 g/L时保持稳定,占总糖质量分数的(50.5±0.8)%。在细胞添加量为20 g/L时,eIMO的合成峰值质量浓度为268.9 g/L,低于低质量浓度黑曲霉细胞添加量的合成水平。反应在8 h后,eIMO质量浓度明显下降。这可能是由于体系中α-葡萄糖苷酶含量过多导致反应向水解方向倾斜[25]。为了保证IMO的合成速率与转化率,维持反应体系中IMO稳定,本研究选择黑曲霉细胞添加量15 g/L进行反应。
2.5 利用黑曲霉全细胞转化麦芽糖生产IMO
当α-葡萄糖苷酶表现出转糖苷活性且反应体系中存在短链寡糖(葡萄糖聚合度为2~6)时,活化的糖基供体有几率与寡糖连接形成异麦芽糖结构,由此产生IMO[1, 26]。实验在48 ℃下,pH值为4.2的含600 g/L麦芽糖的醋酸-醋酸钠缓冲液(20 mmol/L)中,每批次12 h转化麦芽糖生产IMO。由图5可知,eIMO含量随反应批次的增加而下降,这可能是由于α-葡萄糖苷酶在反应体系中逐渐变性失活所致[26]。
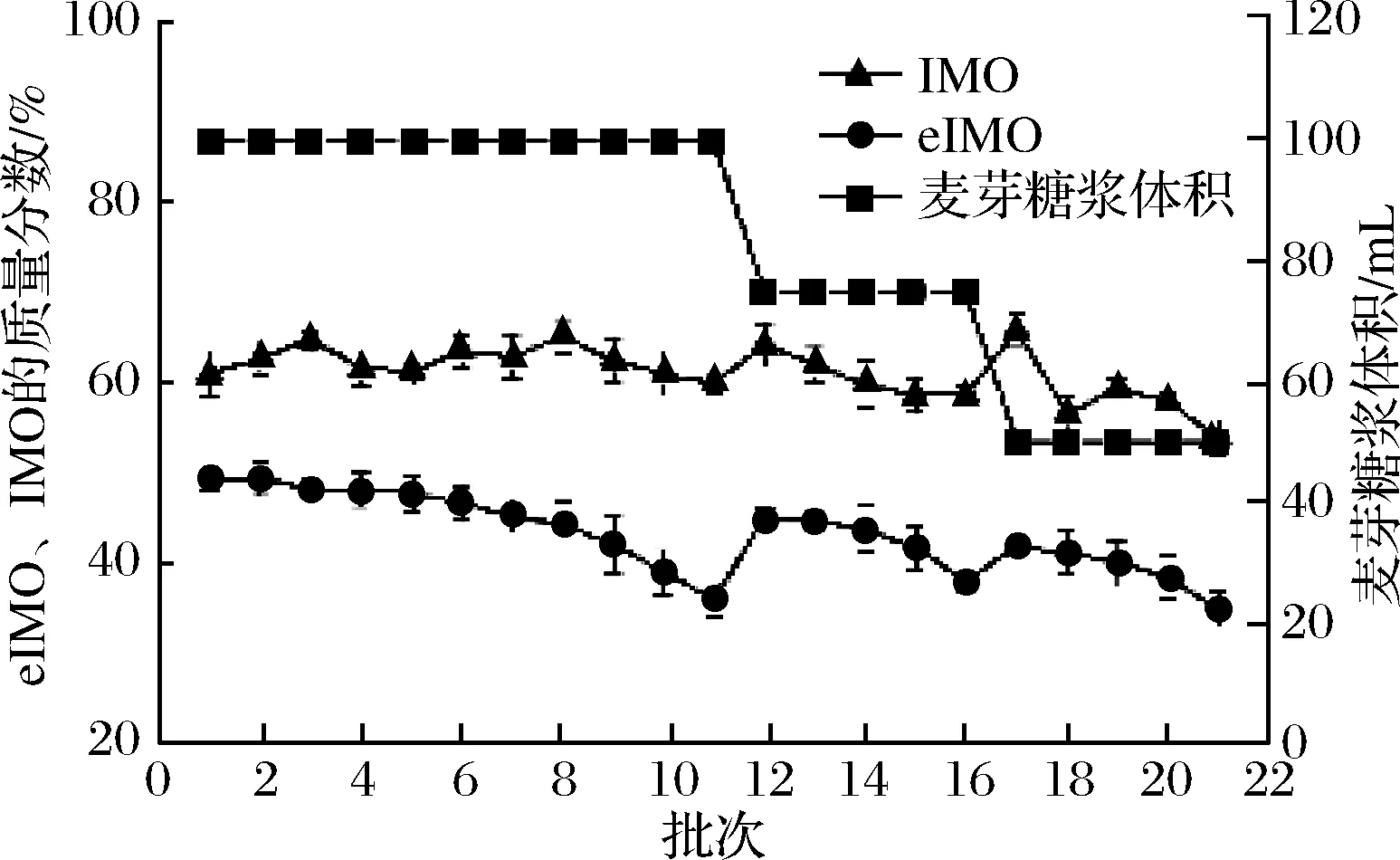
图5 黑曲霉全细胞转化麦芽糖生产IMOFig.5 Synthesis of IMO by whole-cell catalysis of A. niger
转化反应在21批时,将所添加糖浆减少为初始的一半,eIMO质量分数仍无法大于35%(以IMO-50标准),由此确定此条件下,黑曲霉菌丝体生产IMO-50的半衰期为20批次(10 d)。菌丝体生产IMO的操作稳定性强,实验中IMO的组分稳定,第1批与第20批相比,总IMO含量仅下降1.3%,葡萄糖含量低于38%,符合IMO-50的工业生产标准。从表1可见,以黑曲霉H9-30细胞α-葡萄糖苷酶转化麦芽糖产物主要为潘糖和异麦芽糖。第20批的转化产物的酵母耗糖结果显示,纯化后的IMO达到总糖含量的93.8%,eIMO的质量分数为总糖的67.8%,高于IMO-90生产标准,为全细胞催化合成IMO提供了新的参考。

表1 第20批黑曲霉细胞转化及酵母纯化的IMO组成成分Table 1 Composition of IMO from the 20th batch of whole-cell transformation and yeast purification
3 结论
本文对黑曲霉H9-30细胞α-葡萄糖苷酶转化麦芽糖生产IMO进行研究。通过对反应温度、初始pH值、底物质量浓度、细胞添加量对α-葡萄糖苷酶转苷反应影响的探究,确定了反应最佳条件为:反应温度48 ℃,初始pH值4.2,麦芽糖质量浓度为600 g/L,黑曲霉细胞添加量为15 g/L。此条件下,eIMO占总糖质量分数的50.5%,总IMO含量达到63.3%,葡萄糖含量小于38%,符合工业生产IMO标准。黑曲霉细胞α-葡萄糖苷酶转化IMO具有较好的操作稳定性,生产IMO-50的半衰期为20批次(10 d),第20批所产IMO经酵母耗糖纯化后仍高于IMO-90生产标准,有望应用于工业化生产IMO。

