金桂快速繁殖炼苗技术的研究
叶天一 周 鑫 黄 艳 王晓红
(国家林业局哈尔滨林业机械研究所,哈尔滨 150086)
桂花(Osmanthusfragrans)是木犀科(Oleaceae)木犀属(Osmanthus)植物,常绿阔叶灌木或者小乔木,属于我国十大传统名花,同时也是世界上最早被用作园艺观赏植物的其中之一[1~3]。目前我国的桂花品种可分为4个品种群,共157个品[4~5]。桂花常用的繁殖方法有嫁接、扦插、压条、种子繁殖,其中以嫁接为主[6~11]。现阶段微繁即组织培养作为桂花的一种繁殖方式,是一种新兴的繁殖技术,具有繁殖系数大[12]、能够保持品种的优良性状等特点,可弥补以往常规繁殖育苗的不足[13],同时又能满足市场对苗木大批量的需求[14]。实验是以植物组织培养技术为基础开展的扩繁研究工作,植物离体快繁技术是依赖于植物组织培养技术而兴起的[15~17]。它是利用植物的营养繁殖方法,植物组织培养的材料为外植体(explant),器官、组织、胚胎、细胞以及原生质体均可作为组织培养的材料[18~20]。将植物的组织块或是器官消毒后放入无菌的培养环境中,在人工的培养条件下繁殖,快速的获取较多的目的植株,达到快速扩繁的目的。
迄今为止,桂花组织培养的室内快速繁殖技术已经基本上发展成熟,但是针对其炼苗鲜见系统的文献报道,且工序复杂不系统,成苗率低,实用性不强。本研发内容的开展,期望通过对金桂品种微繁的炼苗关键技术试验及其结果分析,探索其提高成活、成苗率的炼苗技术,为目标品种的壮苗快繁提供炼苗的技术支撑。
1 材料与方法
1.1 材料
以广西地区金桂(Osmanthusfragransvar.thunbergii)作为微繁培育苗木的试材,组培室内培养温度为25±3℃,光照14 h·d-1,光照强度为2 000~2 500 lx。
1.2 方法
1.2.1 不同培养基对试管苗生根的影响
试验以金桂组织培养苗继代增殖后生长2.5 cm以上的无根苗为试材,将其转入生根培养基。试验包括基本培养基(A)、NAA(B)和6-BA(C)3个因素,每因素3个水平(表1)。根据设定的因素水平表,故选用L9(34)正交试验设计进行实施。
表1 实验因素水平表
Table 1 The levels and factors of the experiment

水平Level因素FactorA:基本培养基A:Minimal mediumB:NAA(mg·L-1)C:6-BA(mg·L-1)1MS002B520.0531/2MS40.10
设立两个对照组:CK1:1/2MS基本培养基;CK2:B5基本培养基。
每个处理组合需桂花无根瓶苗5瓶,每瓶3株,每个处理设置3个重复,本试验共需要165瓶无根苗。
1.2.2 不同预处理对炼苗的影响
以长至6 cm左右的金桂微繁生根苗为材料,试验试剂为蒸馏水、3%蔗糖水即30 g蔗糖与1 L蒸馏水相溶、10倍稀释的MS大量母液。
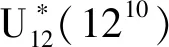
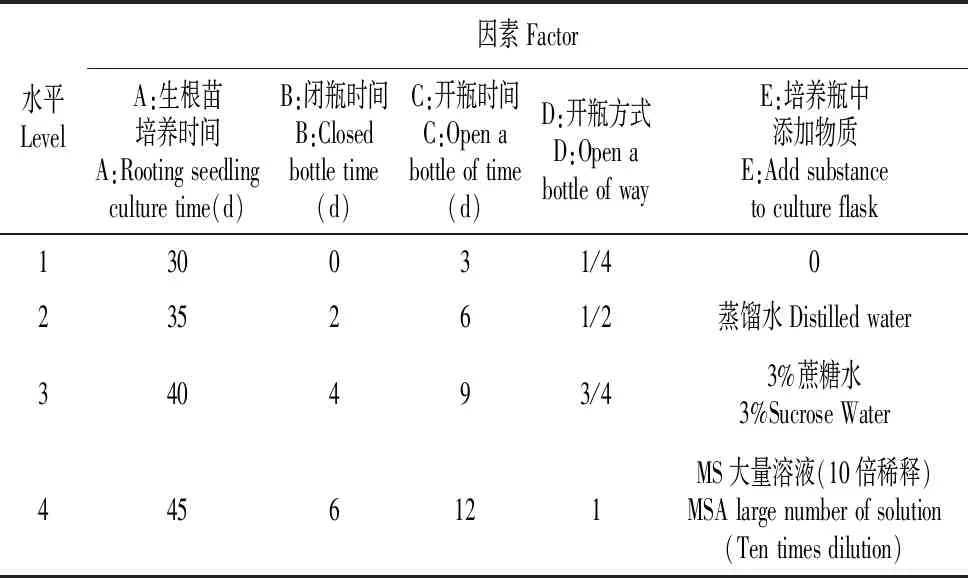
表2 试验因素水平表
本试验一个处理共设置3个重复,每个处理5瓶,每瓶3株,共需180瓶。
1.2.3 不同移栽基质对炼苗的影响
经过室内炼苗的金桂微繁苗,腐殖土为购买的淮安市土壤肥料研究所生产的有机基质,苗圃土为商丘市农林科学院桂花培育基地园土,珍珠岩为袋装购买。
试验包括苗圃土(A)、珍珠岩(B)和腐殖土(C)3个因素,每因素3个水平(表3),各因素水平之间为容积比。根据设定的因素水平表,试验选用L9(34)正交试验设计进行实施。
表3 试验因素水平表
Table 3 The levels and factors of the experiment
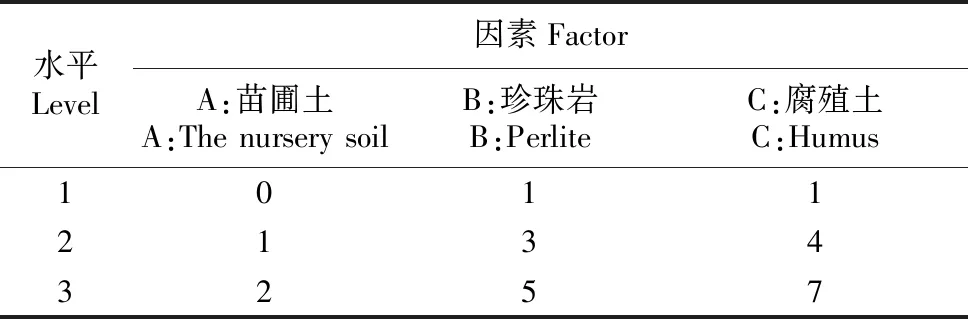
水平Level因素FactorA:苗圃土A:The nursery soilB:珍珠岩B:PerliteC:腐殖土C:Humus101121343257
设立一个对照组CK:只用苗圃土作为基质。
每个处理组合需微繁苗15株,每个处理设置3个重复,本实验共需要450株经过室内炼苗的桂花。
2 结果和分析
2.1 不同培养基对试管苗生根的影响
通过对不同处理组合的金桂微繁苗快繁生根性状的调查分析,各指标的平均值如表4所示。
从表4中可以看出,编号2(A1B2C2)得到了最大生根率,且显著高于其他组合,说明珍珠岩∶腐殖土为3∶4的时候有利于金桂的生根,而在两组对照实验处理(CK1和CK2)来看,仅使用苗圃土的生根率最低,可以说在金桂生根过程中,使用苗圃土会降低金桂的生根率。
在直观分析的基础上,采用因素水平变化趋势图,解释根系各生长指标随因素的水平变化规律(图1)。
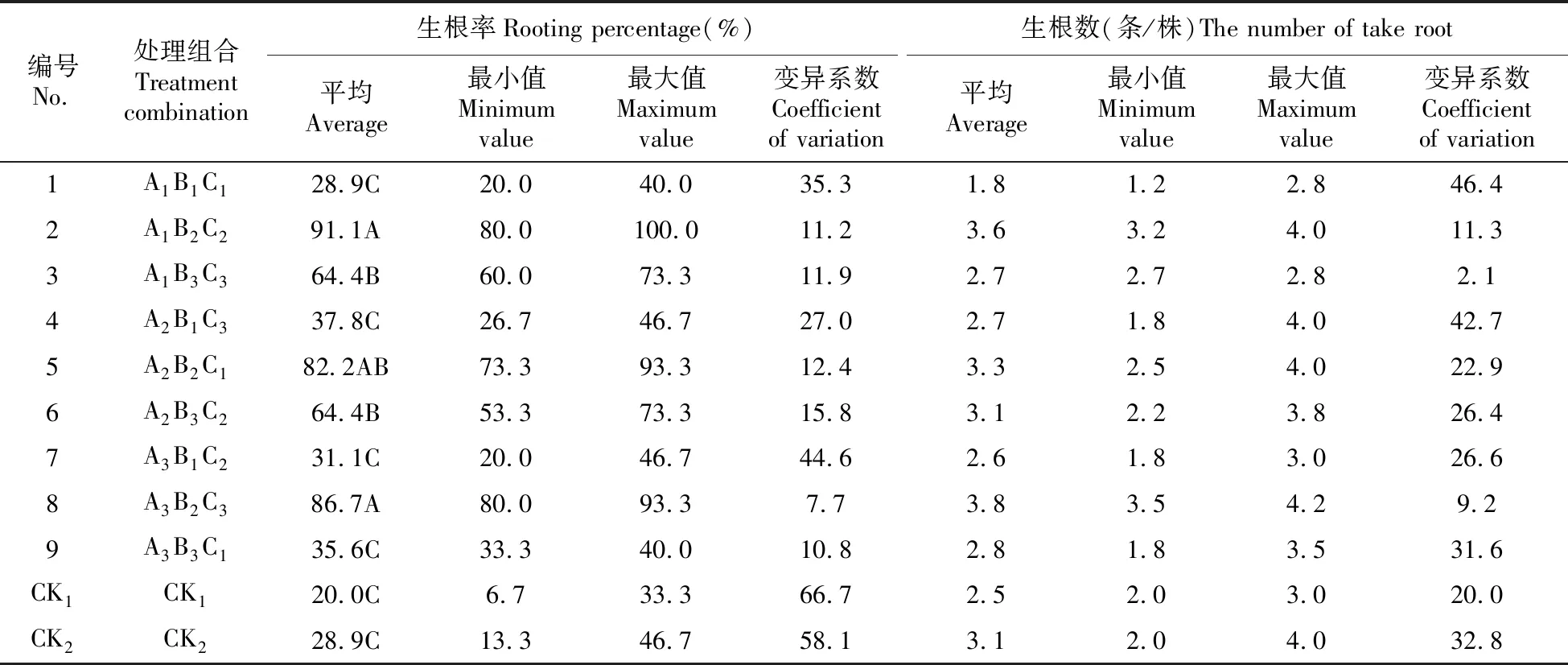
表4 不同处理组合的生根指标统计表
注:不同大、小写字母分别表示差异极显著(P<0.01)和显著(P<0.05),下同。
Note:Different big and small letters mean extremely significant difference(P<0.01) and significant difference(P<0.05) respectively, the same as below.
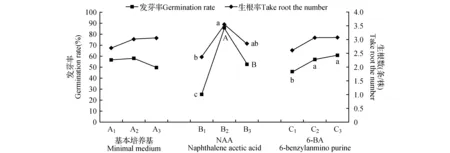
图1 根系各指标随因素的变化趋势图Fig.1 The chart of rooting parameter variation with the change of factorial levels
由图1可看出,基本培养基类型对发芽率影响差异不显著,NAA对发芽率影响达极显著水平,6-BA对发芽率影响达显著水平。基本培养基对根系各指标的影响中,MS基本培养基对发芽率的影响效果最好,B5基本培养基对生根数的效果效果最好,由于当基本培养基由A2(B5)变为A3(1/2MS)时,对生根数的影响并不大,综合可知B5对该根系各指标的影响效果较好;NAA对根系各指标的影响以2.0 mg·L-1最好,其生根率和生根数量分别达到85.93%和3.59条/株,均优于NAA其他两个浓度;6-BA对根系各指标中,生根率随其浓度的增加而增加,可达到60.74%,生根数随其浓度的增加到一定数目不再改变,最高达到3.09条/株。从根系各指标随因素水平变化趋势图可以看出,试验的最佳组合为A2B2C3,即在B5基本培养基中添加2 mg·L-1NAA和0.10 mg·L-16-BA是促进金桂微繁苗生根及根系生长的较佳组合,与直观分析的结果一致。
2.2 不同预处理对炼苗的影响
2.2.1 处理组合的成活率和苗木损失率指标统计
对不同处理组合的金桂微繁苗炼苗室内成活率、移栽成活率以及苗木损失率进行调查统计,各指标的平均值如表5所示。
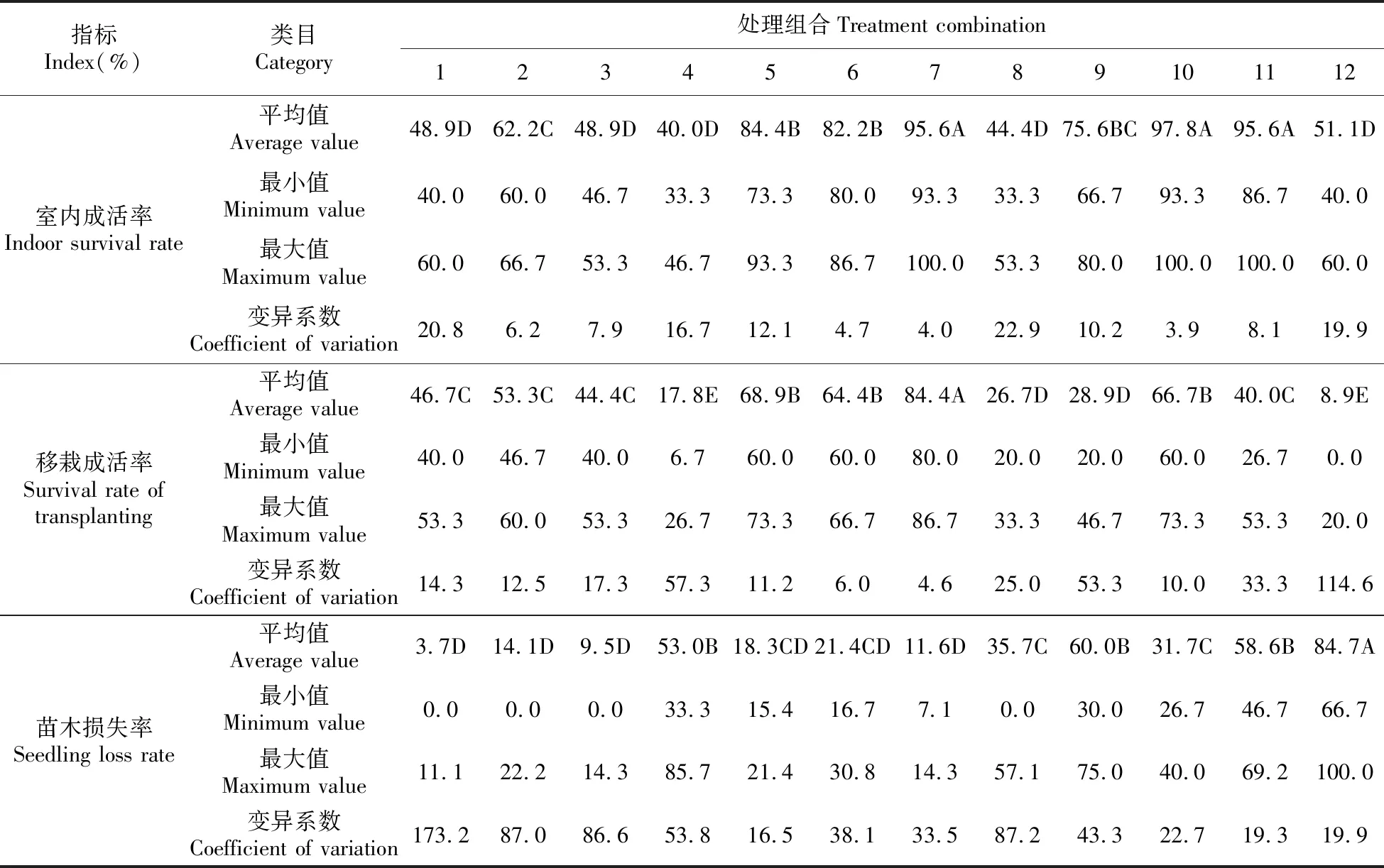
表5 不同处理组合统计结果
(1)多重比较结果显示,处理组合7、10和11的室内成活率比较接近,分别为95.6%、97.8%和95.6%,可以说明,在生根培养较长时间、加入蒸馏水有利于金桂的移栽成活率。与其他处理组合的差异极显著,并为室内成活率最高的A组;处理组合5和6的室内成活分别为84.4%、82.2%和66.7%,与其他处理组合的差异显著,组成B组;处理组合3、6的室内成活率分别为60.0%和62.2%,组成B组;处理组合9室内成活率为75.6%,独立为过渡组BC组;处理组合2室内成活率为62.2%,与其他组差异极显著为C组;处理组合处理组合1、3、4、8以及12的室内成活率分别为48.9%、48.9%、40.0%、44.4%、51.1%,与C组的差异极显著,组成室内成活率最低的D组。
(2)对不同处理组合间的移栽成活率方差分析,结果P=7.36E-10<0.01差异极显著。多重比较结果表明,处理组合7移栽成活率最高,为84.4%,与其他处理组合的差异极显著,独立为A组;处理组合5、6和10的移栽成活率分别为68.9%、64.4%,两者无极显著差异但与其他处理组合的室内成活率差异显著而为次大的B组;处理组合1、2、3、11的移栽成活率分别为46.7%、53.3%、44.4%和40.0%,组成C组;处理组合8和9的移栽成活率分别为26.7%、28.9%,独立为D组;处理组合4和12的移栽成活率分别为17.8%、8.9%,与D组的差异极显著,组成移栽成活率最低的D组。
2.3 不同移栽基质对炼苗的影响
金桂微繁苗炼苗移栽30 d后,通过对不同处理组合的成活率以及苗木增长率进行统计,各指标的平均值如表6所示。
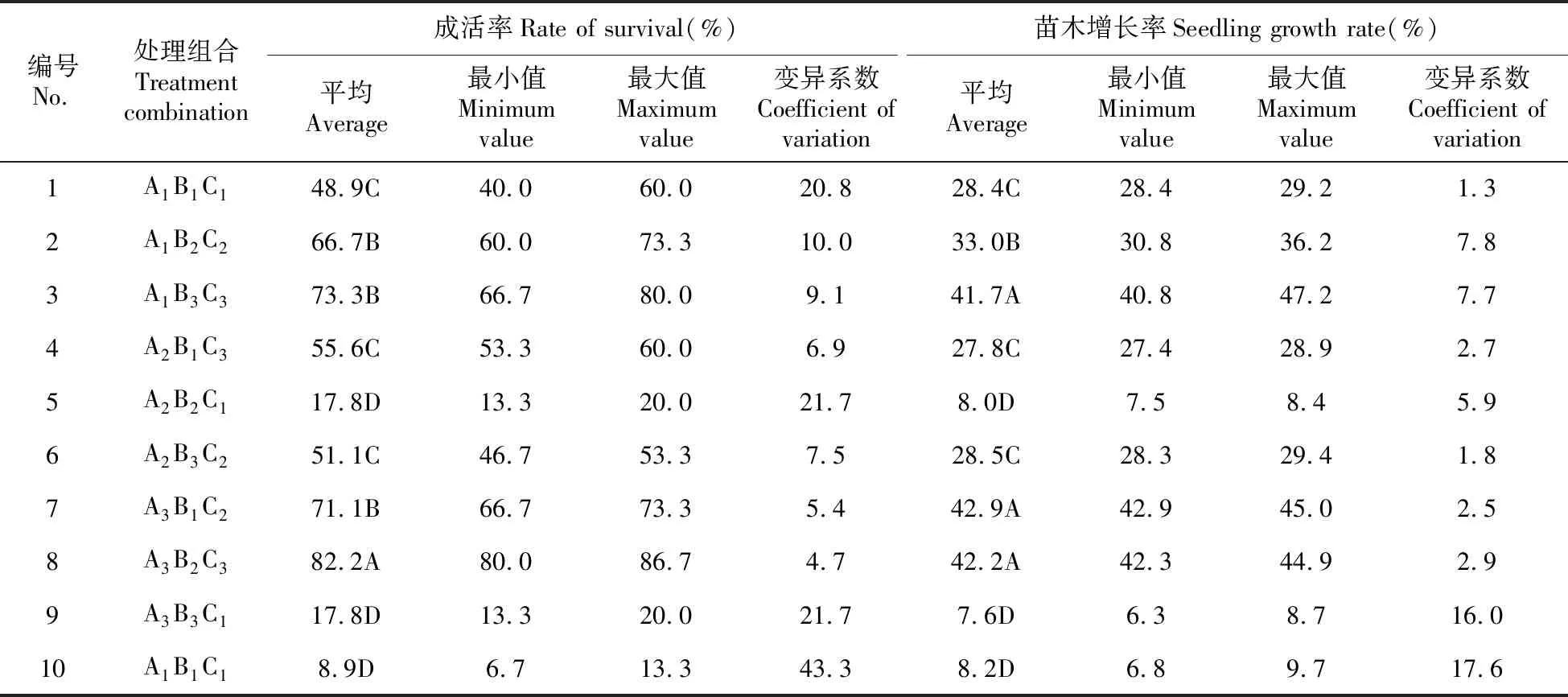
表6 不同处理组合生长指标统计结果
(1)多重比较结果,试验的成活率表现出以下特征:处理组合1的成活率最高,达到82.2%,与其他处理组合的差异极显著,独立为成活率最高的A组;处理组合2、3和7成活率分别为66.7%、73.3%和71.1%,与其他处理组合的成活率差异显著而为成活率次大的B组;处理组合3、6的生根率较接近,分别为48.9%、55.6%和51.1%,组成成活率次低的C组;处理组合5、9以及10三者的生根率极显著地低于其他处理组合的,组成成活率最低的D组。
(2)不同处理组合间的苗木增长率方差分析结果与成活率类似,其差异达到极显著水平,即P=2.69E-18<0.01。多重比较结果表明,处理组合3、7和8(41.7、42.9、42.2%)的苗木增长率极显著地大于其他处理组合,组成苗木增长率最大的A组;处理组合2的苗木增长率为33.0%,与其他处理组合的苗木增长率差异极显著而为苗木增长率次大的B组;处理组合1、4和6的苗木增长率无显著差异(28.4、27.8、28.5%),组成苗木增长率次小的C组;处理组合5、9和10的苗木增长率较少,分别为8.0%、7.6%和8.2%,组成苗木增长率最少的D组(表1~6)。
通过以上分析,初步揭示了不同基质处理组合对金桂微繁苗炼苗成活率和苗木生长状况的影响较大。
3 结论
影响金桂微繁苗生根率的最优理论组合为A2B2C3,但是,该试验组合在本次试验中未实施,平均生根数的最优理论组合为A3B2C2(C3)。实际试验中以处理组合A3B2C3(1/2MS培养基,2 mg·L-1NAA,0.10 mg·L-16-BA)的处理,对金桂微繁苗的各个生根指标最好,其生根率、平均生根数分别为:91.11%、3.83条/株。由于基本培养基(A因素)对生根率和生根数的影响不显著,且故综合分析结果,最优组合为A3B2C3,即以B5基本培养基+2 mg·L-1NAA+0.10 mg·L-16-BA作为生根培养基,是提高金桂微繁苗生根率和生根数的最佳处理组合。
影响金桂微繁苗生根率的最优理论组合为A2B4C3D2E3,但是,该试验组合在本次试验中未实施,结合实际试验中以处理组合A3B4C2D3E2的移栽成活率达到最高为84.4%,并且其室内成活率为95.6%,与室内最高成活率接近,苗木损失率也为最低组仅11.6%,因此可考虑最为炼苗预处理的技术措施,即生根苗培养40 d,闭瓶6 d,开瓶6 d,3/4开瓶方式,加入3%蔗糖水。
试验的最优理论处理组合为A1B1C3(苗圃土∶珍珠岩∶腐殖土=0∶1∶7),在实际试验中该处理组合未实施,需在进一步的实验研究中进行验证。在实际试验中,与最优处理组合相近的试验组合是A3B2C3,其成活率和苗木增长率分别为82.2%、42.2%,虽其苗木增长率低于处理组合A3B1C2,但是两者的苗木增长率接近差异不显著,而且在实际生产中,苗圃土比较方便收集以及成本低,因此,可考虑在实际生产中以A3B2C3(苗圃土∶珍珠岩∶腐殖土=2∶3∶7)作为金桂微繁苗炼苗基质的配比组合。
4 讨论
以往的研究者依据培养的不同物种、组织和目的,设计了许多不同类型的基本培养基[21]。在桂花的组织培养中,其初代培养和增殖培养,选用的基本培养基略有不同,但是其基本培养基常用的有MS和B5两类[22]。在二十世纪九十年代,秦新民在对秋桂嫩茎诱导丛生芽的组织培养实验中,就选用了MS作为基本培养基,获得了实验的成功;在1998年,Kazutaka和Nishikaw两位科学家对在桂花茎尖进行诱导时以MS+6-BA 1.5 mg·L-1+2,4-D 0.1 mg·L-1为初代培养基,得到了愈伤组织[16];在对桂花新稍茎段初代及其继代培养、胚幼苗生长的研究中发现,LMc培养基优于MS培养基[13]。但是袁王俊等人通过对桂花茎尖以及胚的组织培养实验研究得出,MS和DCR培养基没有B5效果好[16,19]。
植物生长调节剂又被称为外源激素,它与植物体内分泌的激素具有相似的生理和生物学效应。经过以往大量研究发现,激素在各类植物的组织培养中是不可或缺的,并且根据不同的植物、不同的目的等,其在应用中的种类、浓度以及配比是不同的。现在应用的激素主要有:生长素类,如2,4-D、萘乙酸(NAA)、吲哚乙酸(IAA)等;细胞分裂素类,能够促使细胞快速分裂,以及侧芽的生长和不定芽的分化等,如在组织培养中我们最常用的6-苄基腺嘌呤(6-BA),另外还有激动素(KT)等;赤霉素类、水杨酸等等。
在桂花组织培养中,常用6-BA诱导产生不定芽、NAA诱导生根、2,4-D诱导愈伤组织产生等作为外源激素添加到相应的培养基中[16]。2013年,王丽霞等以桂花叶盘、茎段为外植体,基质用基本培养基MS,然后添加不同浓度的6-BA和NAA,并调节其配比,结果发现两者直接分化不定芽的最佳培养基不同,前者为MS+1 mg·L-16-BA+0.3 mg·L-1NAA,后者则为MS+2 mg·L-16-BA+0.1 mg·L-1NAA[23]。
在植物组织培养基中添加蔗糖,主要作用是为植物外植体的初期生长提供碳源和能源。添加蔗糖而不是葡萄糖,主要是前者可以形成稳定的渗透压,便于植物细胞的吸收,同时也可以减少微生物的污染,因为葡萄糖是微生物最适合的碳源。关于在桂花培养基中蔗糖的浓度常选用3%,主要是因为若蔗糖的浓度过高或低都会造成培养基的渗透压改变,从而不利于外植体的生长。

