miR-1187靶向调控Arhgef9在七氟醚致海马神经元凋亡中的作用
孙华琴 梁哲浩 徐孝平 胡弘毅 陶涛
miRNA是由19~22个核苷酸组成的非编码微小内源性RNA,广泛存在于真核细胞中,主要参与正常情况下生长发育基因调控,它能通过不完全互补、抑制翻译、完全互补等方式特异性作用于靶mRNA,从而调控基因表达[1-2]。miRNA由真核生物细胞核内的DNA编码,作用于 3′非翻译区(3′untranslated region,3′UTR),最终通过抑制mRNA转录或目标mRNA降解的方式,使靶基因表达下调;或开放某些mRNA的转录,使在多个水平对内源性基因表达进行调节[3-4]。miRNA涉及许多生物学过程的基因表达,如细胞增殖、凋亡及代谢等生物学过程,目前人类基因组中近一半基因受到2 558个成熟miRNA的调控[5]。吸入麻醉药七氟醚是临床常用的一种麻醉药,可能通过兴奋γ-氨基丁酸受体产生麻醉作用,诱导大鼠海马神经元凋亡,引起认知功能障碍[6]。海马作为中枢神经系统的重要部分,其主要生理功能是调节学习、记忆及认知功能;因此,认知功能障碍的主要机制是海马神经元的凋亡增加[7-8]。研究证实,miRNA可参与调节海马神经元损伤的过程,但具体机制尚未明确,对miRNA的靶基因调控研究也停留在预测阶段[9]。因此,笔者尝试通过miRNA及表达谱芯片的研究方法来探讨七氟醚致海马神经元损伤模型中miRNA与mRNA的共表达互作网络,筛选出差异表达的miRNA,并找出其作用的靶基因。
1 材料和方法
1.1 海马神经元原代培养模型的制备 SPF级雌性ICR小鼠4只,孕15d,由上海西普尔-必凯实验动物有限公司提供[SCXK(沪)2013-0016] ,饲养于浙江中医药大学动物实验研究中心屏障动物实验设施[SYXK(浙)2013-0184] ,室温(23±2)℃,相对湿度 60%~70%。在其产下的新生小鼠中,按照随机数字表法选取健康7日龄雄性ICR小鼠6只,分成两组,即七氟醚麻醉组3只、对照组3只。七氟醚麻醉组小鼠从9:00~15:00连续6h置于自制有机玻璃麻醉箱(体积40cm×35cm×30cm)中实施麻醉,箱内置入钠石灰纱包。经欧美达(NURACO)挥发罐给予七氟醚(日本丸石制药株式会社)吸入,氧流量4.5L/min,使用NURACO麻醉气体浓度监测仪测定麻醉箱中七氟醚浓度,使其稳定在2.4%。对照组小鼠在另一箱内在相同时间段连续6h持续输入不含七氟醚的空气。麻醉结束后,回归鼠笼,由母鼠喂养小鼠至第14天。
1.2 差异表达miRNA筛选、调控靶基因预测和通路功能富集分析 小鼠断头取海马组织,提取总RNA。样品总 RNA 利用 Nano Drop ND-2000(Thermo Scientific)定量并经 Agilent Bioanalyzer 2100(Agilent Technologies)检测RNA完整性。首先总RNA去磷酸化、变性,再用Cyanine-3-CTP(Cy3)标记,标记好的RNA纯化后和芯片杂交,洗脱后利用Agilent Scanner G2505C(Agilent Technologies)扫描得到原始图像。使用Feature Extraction软件(version 10.7.1.1,Agilent Technologies)处理原始图像,提取原始数据。使用Genesrping软件(version 12.5,Agilent Technologies)进行quantile标准化和后续处理。利用t检验的P值和倍数变化值进行差异表达miRNA 筛选。利用数据库(Target Scan,miRNA org,pita)共同对差异miRNA靶基因进行预测,然后对靶基因进行GO和Pathway富集分析,以判定差异表达的miRNA主要影响的生物学功能或通路。
1.3 海马原代细胞培养 用75%乙醇消毒,钝性分离脑组织中的海马,将其剪碎并用0.25%胰蛋白酶和0.04g/L DNA酶作用3min,吸管吹打组织块以分散细胞。将细胞悬液经75μm尼龙网过滤加入含10%FBS、5%马血清达尔伯克改良伊格尔培养基(DMEM)完全培养液,置于培养箱内培养(37℃、5%CO2+95%O2混合气体,饱和湿度)。第3天加入5μmol/L阿糖胞苷,24h后换成完全培养液。
1.4 miR-1187 mRNA表达的检测 采用RT-PCR法。Trizol法提取海马神经元总RNA,并逆转录成cDNA,进行RT-PCR(试剂盒购于日本TAKARA公司)。通过计算循环阈值CT值来确定miR-1187 mRNA相对表达量。ΔΔCT=(CT 值实验组基因-CT 值实验组管家基因)-(CT 值对照组目的基因-CT 值对照组管家基因),目的基因 mRNA 相对表达量=2-ΔΔCT。
1.5 miR-1187转染后海马神经元存活率的检测 采用细胞计数试剂盒(CCK-8)法。将miR-1187高表达质粒(miR-1187 mimics)转染成功后的海马神经元制备成细胞悬液,接种到 96孔板中(100μl/孔),在 37℃、5%CO2条件下培养48h。更换培养基,加入10μl CCK-8(日本同仁公司),置于37℃、5%CO2条件下培养2h。使用酶标仪在450nm波长处测定OD值,计算细胞存活率。
1.6 荧光素酶活性检测 用生物信息学技术检索miR-1187靶基因数据库Target Scan,经分析发现在Rho鸟苷交换因子-9(Arhgef9)基因 mRNA的3′UTR 有miR-1187的结合位点,提示Arhgef9是miR-1187潜在的靶基因。将Arhgef9-3′UTR片段克隆到荧光素酶报告载体中,构建成luci Arhgef9-3′UTR质粒,将此质粒与miR-1187 mimics共转至细胞中[分为4组:共转染阴性对照序列和野生型Arhgef9 3′UTR(A组)、共转染miR-1187 mimics和野生型 Arhgef9 3′UTR(B 组)、共转染阴性对照序列和突变型Arhgef9 3′UTR(C组)、共转染 miR-1187 mimics和突变型Arhgef9 3′UTR(D 组)] 。收集转染48h后海马神经元,按照双荧光素酶报告基因检测试剂盒说明书,使用荧光发光检测仪测定细胞中萤火虫荧光素信号及海肾荧光素信号,计算荧光素酶活性。
1.7 统计学处理 应用SPSS 22.0统计软件。计量资料用表示,组间比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 差异表达的miRNA调控靶基因预测 本研究预测得到差异表达的miRNA 9个,其对应靶基因1 252个,靶基因去重后1 095个。9个miRNA分别为miR-101b-3p、miR-1187、miR-188-5p、miR-219a-5p、miR-338-3p、miR-425-5p、miR-467a-3p、miR-705、miR-92a-3p。笔者剔除了连接度为1的相关靶基因,使网络更加清晰分明,同时排除其他靶基因的影响,只显示关键miRNA及其对应关键靶基因,节点信息见图1(插页)。
2.2 靶基因通路功能富集分析 靶基因主要富集在FoxO信号通路、mTOR信号通路、wnt信号通路等。通路功能富集分析结果,见图2(插页)。
2.3 海马神经元miR-1187 mRNA表达 海马神经元培养48h后,七氟醚诱导损伤模型组miR-1187 mRNA相对表达量为0.66±0.12,较质粒阴性对照组0.92±0.12和miR-1187 mimics组1.65±0.14均明显降低,差异均有统计学意义(均P<0.05),见图3。
2.4 miR-1187 mimics转染后海马神经元存活率miR-1187 mimics转染后,海马神经元存活率为(1.21±0.13)%,较对照组(0.89±0.11)%、质粒阴性对照组(0.87±0.12)%均明显上升(均P<0.05),差异均有统计学意义(均P<0.05),见图 4。
2.5 荧光素酶实验检测miR-1187与Arhgef9的结合 用生物信息学技术检索miRNA靶基因数据库Target Scan,经分析发现在Arhgef9基因mRNA的3′UTR有miR-1187的结合位点,提示Arhgef9是miR-1187潜在的靶基因,miR-1187上调可能会调控Arhgef9。miR-1187-mimics与野生型Arhgef9 3′UTR共转染组细胞中荧光素酶活性为0.38±0.05,较其他3组荧光素酶活性1.05±0.20、1.10±0.19 和 0.99±0.11 均明显降低,差异均有统计学意义(均P<0.05);其他3组荧光素酶活性两两比较,差异均无统计学意义(均P>0.05)。这说明miR-1187与Arhgef9存在靶向关系,提示miR-1187能通过与Arhgef9基因mRNA的3′UTR互补配对来发挥作用,见图5。

图3 海马神经元miR-1187 mRNA表达(与其他两组比较,*P<0.05)
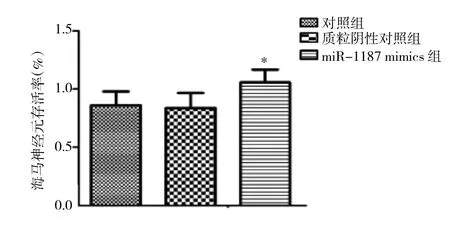
图4 miR-1187 mimics转染后海马神经元存活率(与其他两组比较,*P<0.05)

图5 荧光素酶实验验证miR-1187与Arhgef9 3'UTR的结合(与其他3组比较,*P<0.05)
3 讨论
miRNA是涉及许多生物学过程基因表达的已知有效调节剂,参与细胞增殖、分化、凋亡以及生物的发育、神经分化、脂肪代谢等生物学过程,通过与miRNA转录物的3′UTR结合来调控基因转录后表达,广泛地负调控靶基因的表达[10-11]。miRNA可能在基因表达调控领域具有重要作用。miRNA具有丰富多样的序列、结构、丰度和表达方式,可影响个体发育的基因表达、细胞周期调控等重要过程。以单链形式存在的miRNA可通过与下游靶端UTR不完全互补配对结合,调节并影响内源基因的表达,从而影响蛋白质的合成,调节生物的发育过程[12-14]。因为在物种之间具有系统进化上的高度保守性、时序性和组织特异性,因此本研究拟通过微阵列芯片技术检测处理后小鼠海马区脑组织与正常小鼠海马区脑组织中的表达谱,找出差异表达的miRNA,并分析其与海马神经元损伤的相关性。
鉴于基因芯片的种种优势,笔者通过构建七氟醚诱导小鼠海马神经元损伤模型,同时利用基因芯片分析法对比小鼠海马区脑组织和正常小鼠海马区脑组织中的表达谱,结果预测得到差异表达的miRNA 9个,分别为miR-101b-3p、miR-1187、miR-188-5p、miR-219a-5p、miR-338-3p、miR-425-5p、miR-467a-3p、miR-705、miR-92a-3p,并从中选出上调最明显的miR-1187进一步验证与分析。本研究结果发现,在七氟醚诱导海马神经元损伤模型中,miR-1187 mRNA相对表达量明显降低,miR-1187 mimics转染后,海马神经元存活率明显上升;这说明miR-1187可明显调控海马神经元活性,产生抗海马神经元凋亡的作用。同时研究结果显示,在Arhgef9基因mRNA的3′UTR有miR-1187的结合位点,提示Arhgef9是miR-1187潜在的靶基因,miR-1187上调可能调控Arhgef9,说明miR-1187与Arhgef9存在靶向关系,提示miR-1187能通过与Arhgef9基因mRNA的3′UTR互补配对来发挥作用,从而参与细胞凋亡的调控。
综上所述,miR-1187是海马神经元抗细胞凋亡的抑制因子;高表达miR-1187通过靶向调节Arhgef9 mRNA的表达来抑制海马神经元凋亡的发生。

