R-Spondin2、Syndecan-1 在小鼠肝星状细胞活化中的作用研究
殷新光 徐龙生 吴一鸣 薛文英 徐英
肝星状细胞(hepatic stellate cells,HSC)是肝脏合成细胞外基质的主要细胞,其活化可诱导细胞外基质合成与降解的失衡,导致肝纤维化的发生[1]。在慢性肝损伤中HSC要经历增殖与表型的转变,由原来富含维生素A类物质的静止的表型“转分化”为活化的肌纤维母细胞样表型,即HSC发生活化[2]。在此过程中,多种信号通路参与,如 Wnt/p-catenin、Jagged/Notch 信号通路[3]。R-脊椎蛋白 2(roof plate-specific spondin-2,R-Spondin2)、多配体蛋白聚糖1(Syndecan-1)均是Wnt/p-catenin信号通路重要的调节分子[4-5]。基于此,本研究采用体外实验研究的方法,探讨R-pondin2、Syndecan-1在HSC活化中的作用及可能的作用机制,现报道如下。
1 材料和方法
1.1 主要材料、试剂和仪器 24只8~10周龄健康雄性昆明种小鼠(江苏齐氏实验动物中心),体重38~40g。兔多克隆α-平滑肌肌动蛋白(α-SMA)抗体(美国R&D公司);小鼠R-Spondin2抗体、小鼠Syndecan-1抗体、小鼠重组R-Spondin2蛋白、小鼠重组Syndecan-1蛋白(美国Sigma公司);第二抗体(武汉博士德生物科技有限公司);DMEM、Trizol和 FBS(美国 Invitrogen公司);RIPA裂解液、逆转录试剂盒、链霉蛋白酶E、Ⅳ型胶原酶、SYBR试剂、BSA、DAPI(武汉博士德生物科技有限公司);离心机(湖南湘仪离心机仪器有限公司)、紫外分光光度计(上海仪电分析仪器厂)、电泳仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 实验小鼠分组与HSC分离制备 将小鼠按随机数字表法分为6组,每组4只,均在实验室标准条件下饲养,自由摄取食物和水,适应性喂养1周。采用颈椎脱臼法处死小鼠,解剖出小鼠肝脏,用链霉蛋白酶E和Ⅳ型胶原酶灌流小鼠肝脏,Nycodenz密度梯度离心分离并培养原代小鼠HSC。细胞计数法测细胞得率,锥虫蓝拒染法测细胞存活率(确保存活率>90%)。H1组:HSC分离培养 1d;H2组:HSC 分离培养 3d;H3组:HSC 分离培养7d;R+S-组:HSC分离培养24h后,给予20 ng/ml R-Spondin 2刺激24h;R-S+组:HSC分离培养24h后,给予 20 ng/ml Syndecan-1刺激 24h;R-S-组:HSC分离培养48h,未予任何刺激。分离的HSC以1×105个/cm2接种于含体积分数10%FBS的DMEM培养基中,在37℃、5%CO2条件下培养[6]。收集各组HSC进行后续实验。
1.2.2 外源性R-Spondin2、Syndecan-1刺激 R+S-组、RS+组、R-S-组小鼠分离的 HSC HSC 以 1×105个/ml接种于96孔培养板,待细胞贴壁后,换无血清培养基培养24 h。对R+S-组HSC给予20 ng/ml重组R-Spondin2蛋白刺激24 h;对R-S+组HSC给予20 ng/ml重组Syndecan-1蛋白刺激24 h;R-S-组HSC仅分离培养48h。收集R+S-组、R-S+组、R-S-培养的HSC进行后续实验。
1.2.3 各组小鼠 HSC R-Spondin2、Syndecan-1、α-SMA蛋白表达水平检测 采用Western blot法。RIPA裂解液提取各组HSC总蛋白,用紫外分光光度计测定蛋白质浓度。聚丙烯酰胺凝胶电泳分离、转膜、5%脱脂奶粉封闭后,分别加入 R-Spondin2 抗体(1∶1 500)、Syndecan-1抗体(1∶1 000)和 α-SMA 抗体(1∶500),4℃孵育过夜。洗膜后加入第二抗体(1∶2 000),室温孵育2h后采用电化学发光试剂检测。以GAPDH为内参照,凝胶扫描成像系统(美国Bio-Rad公司)对各条带的灰度值进行分析,检测目的蛋白的相对表达水平。
1.2.4 H1、H2、H3组小鼠 HSC R-Spondin2、Syndecan-1、α-SMA mRNA表达水平检测 采用RT-PCR法。PCR引物由上海齐合生物工程技术有限公司合成,见表1。Trizol法提取HSC总RNA,-80°C保存。紫外分光光度计测定260 nm和280 nm波长处的吸光度值,计算提取的总RNA浓度。用逆转录试剂盒逆转录合成cDNA,-20℃保存。PCR 体系:SYBR 试剂 10μl,浓度 10μmol/L的上、下游引物各 0.5μl,样品 cDNA 2μl,双蒸水 7μl。PCR 条件:95℃ 4min;95℃ 30s,60℃ 45s,72℃ 1 min,共35个循环;72°C延伸5 min。用SDS软件进行数据分析,用比较Ct值(循环阈值)的方法分析结果,目的mRNA的相对表达水平由GAPDH进行标准化。
1.2.5 H1、H2、H3组小鼠HSC活化状态观察 采用免疫荧光染色法。待H1组、H2组、H3组细胞生长至80%融合时,弃去培养基,用温育的PBS冲洗细胞2次,每次10min,然后用4%多聚甲醛在室温条件下固定细胞15min;PBS冲洗细胞2次,每次10min,然后在4℃条件下,用0.1%Triton X-100透膜15min;PBS再次冲洗,然后在室温条件下用4%BSA封闭细胞30min;按1∶150的比例稀释α-SMA、Desmin一抗,然后将其放在4℃冰箱中孵育过夜;PBS冲洗细胞3次,每次10min,按1∶100的比例稀释二抗,37℃条件下放置1h;用PBS冲洗3次,每次10min,最后DAPI染细胞核并用显微镜拍照观察HSC活化状态。
1.3 观察指标 (1)观察H1、H3组小鼠HSC活化状态;(2)比较 H1、H2、H3组小鼠 HSC α-SMA 蛋白与 mRNA表达水平;(3)比较 H1、H2、H3组小鼠 HSC R-Spondin2和Syndecan-1蛋白与mRNA表达水平;(4)比较R+S-组、R-S+组、R-S-组小鼠 HSC R-Spondin2、Syndecan-1、α-SMA蛋白表达水平。
1.4 统计学处理 应用SPSS 15.0统计软件;计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验,两组比较采用两独立样本t检验;P<0.05为差异有统计学意义。

表1 PCR引物
2 结果
2.1 H1、H3组小鼠HSC活化状态观察结果 见图1(插页)。
由图1可见,免疫荧光染色结果显示H1组小鼠HSC α-SMA蛋白表达微弱,处于未活化状态;H3组小鼠HSC,即HSC分离培养7d,α-SMA蛋白高度表达,具有肌细胞特征,有向肌成纤维细胞转化趋势,这说明HSC在体外培养时发生了从静息到活化状态的转变。
2.2 H1、H2、H3组小鼠 HSC α-SMA 蛋白与 mRNA 表达水平比较 见表2。

表2 H1、H2、H3组小鼠HSCα-SMA蛋白与mRNA表达水平比较
由表 2 可见,H1、H2、H3组小鼠 HSC α-SMA 蛋白与mRNA表达水平比较差异均有统计学意义(均P<0.05),且组间两两比较差异亦均有统计学意义(均P<0.05),H3组小鼠HSC α-SMA蛋白与mRNA表达水平>H2组>H1组。即随着HSC的活化,α-SMA蛋白与mRNA的表达水平上调且呈时间依赖性地上升。
2.3 H1、H2、H3组小鼠 HSC R-Spondin2 和 Syndecan-1蛋白与mRNA表达水平比较 见表3。
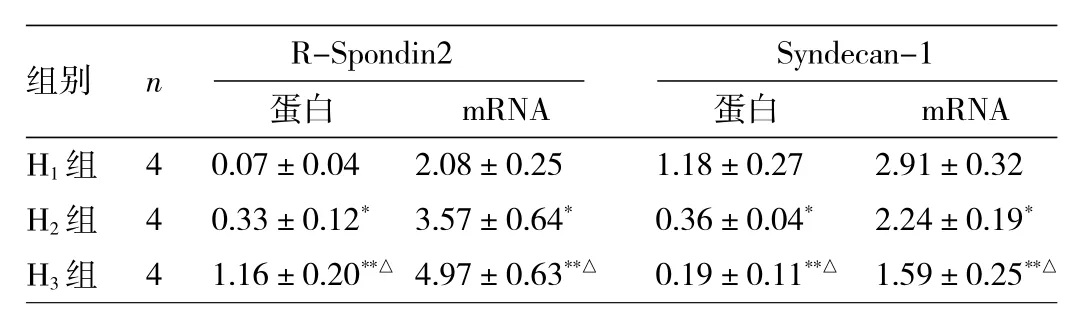
表 3 H1、H2、H3组 HSC R-Spondin2 和 Syndecan-1 蛋白与 mRNA表达水平比较
由表 3 可见,H1、H2、H3组小鼠 HSC R-Spondin2 和Syndecan-1蛋白与mRNA表达水平比较差异均有统计学意义(均P<0.05),且组间两两比较差异亦均有统计学意义(均P<0.05),H3组小鼠HSC R-Spondin2蛋白与mRNA表达水平>H2组>H1组,而H3组小鼠Syndecan-1蛋白与mRNA表达水平<H2组<H1组。即随着HSC的活化,R-Spondin2的表达上调并呈时间依赖性地上升,Syndecan-1表达下调且呈时间依赖性地下降。
2.4 R+S-组、R-S+组、R-S-组小鼠 HSC R-Spondin2、Syndecan-1、α-SMA蛋白表达水平比较 见表4。

表 4 R+S-组、R-S+组、R-S-组小鼠 HSC R-Spondin2、Syndecan-1、α-SMA蛋白表达水平比较
由表4可见,R-S+组小鼠HSC R-Spondin2蛋白表达水平低于 R-S-组小鼠 HSC(P<0.05)。R+S-组、R-S-组小鼠HSC Syndecan-1蛋白表达水平比较差异无统计学意义(P>0.05)。R+S-组、R-S+组、R-S-组小鼠 HSC α-SMA蛋白表达水平比较差异有统计学意义(P<0.05),组间两两比较差异亦均有统计学意义(均P<0.05),R+S-组小鼠 HSC α-SMA 蛋白表达水平>R-S-组>R-S+组。即Syndecan-1负向调控R-Spondin2的表达,介导HSC的活化。
3 讨论
肝纤维化是由不同病因引起的慢性肝病发生、发展的必经过程,对肝纤维化的预防和早期干预是稳定病情、防止肝纤维化向肝硬化、肝癌发展的有效措施[7]。因此,深入研究肝纤维化的发生、发展机制,对慢性肝病的防治具有重要意义。HSC是肝脏合成细胞外基质的主要细胞,其活化即发生肌成纤维细胞的表型转换是肝纤维化发生的中心环节[8]。本研究以分离培养的小鼠HSC为研究对象,运用Western blot、RT-PCR、免疫荧光等检测方法探讨HSC活化过程中的相关机制,对阐明或阻断HSC的活化,防治肝纤维化的发生具有重要意义。
HSC的活化受众多细胞因子的调控,现有研究发现Wnt信号通路影响HSC的活化,阻断Wnt信号通路可抑制HSC的增殖、诱导其凋亡[3]。R-Spondin蛋白家族是Wnt信号通路的重要调控因子,包括4种成员:RSpondin1、2、3、4。其序列相似度为 40%~60%,且具有相似的结构模式[9]。R-Spondin家族蛋白在消化道的组织分化、器官形成及疾病发生过程中发挥重要作用,RSpondin1对小肠表皮细胞生长有重要影响,而且RSpondin1能诱导小肠干细胞,对放化疗有保护作用[10-11]。R-Spondin2-LGR5信号对结肠癌有抑制作用[12]。另有研究发现,由R-Spondin2介导的信号通路能够调控致命肠道腹泻的易感性[13]。上述研究表明在消化道发育和疾病发生过程中,R-Spondin对调控细胞的增殖、分化、迁移能力起着重要的作用。
本研究结果显示,随着体外培养HSC时间的延长,α-SMA的表达水平呈时间依赖性地上升,且免疫荧光染色显示HSC分离培养到第7天,α-SMA蛋白高度表达,具有肌细胞特征,向肌成纤维细胞转化趋势,HSC发生了从静息到活化的状态转变。在此过程中,RSpondin2的表达水平也随时间延长而明显上调。这提示R-Spondin2可能参与调控HSC的活化。
Sydecan-1属细胞表面跨膜蛋白多糖,是膜表面黏附受体,属于细胞间质、质膜的重要组成成分[14]。Sydecan-1以共价受体方式调节细胞与微环境之间的相互作用,参与组织器官发育、血管形成、组织再生等生理过程,它的表达受高度调节,具有细胞类型和发育阶段特异性[15]。细胞利用整合素和Sydecan-1双受体介导细胞-细胞外基质的黏附,促进细胞增殖,维持细胞分化类型,抑制肿瘤细胞生长[16]。本实验研究结果发现,随着体外培养HSC时间的延长,Sydecan-1蛋白与mRNA的表达呈时间依赖性地下降,Sydecan-1也可能参与调控HSC的活化。本研究结果还显示,在HSC的活化过程中,R-Spondin2表达上调,而Syndecan-1表达下调。两者是否存在于同一调控网络内,与HSC的活化是何种关系,尚未见文献报道。本研究对分离的小鼠HSC分别给予R-Spondin2、Syndecan-1重组蛋白刺激,结果显示,RSpondin2蛋白刺激24h,α-SMA蛋白表达上调,而Syndecan-1表达差异无统计学意义;给予重组Syndecan-1蛋白刺激24 h,R-Spondin2、α-SMA蛋白表达均发生下降。因而笔者推测,R-Spondin2和Syndecan-1共同参与HSC的活化,并且Syndecan-1负向调控R-Spondin2的表达,从而促使HSC发生活化。
综上所述,本研究结果显示体外分离培养小鼠HSC,可使其发生活化,在此过程中,Syndecan-1表达下调,负向调控R-Spondin2表达上调,从而诱导α-SMA表达增加促使HSC活化。这提示结合R-Spondin2、Syndecan-1两者相互研究,或将为阐明或阻断HSC的活化,防治肝纤维化的发生提供实验依据。

