沉积Pt对Ag2CO3纳米晶的物理化学性质和光催化性能影响
陈范云 张萌迪 马小帅 李家德 余长林*,,2
(1江西理工大学冶金与化学工程学院,赣州 341000)
(2广东石油化工学院环境科学与工程学院,茂名 525000)
0 引 言
半导体光催化技术在环境治理方面已引起广泛的重视[1-7]。银基半导体由于具有合适的禁带宽度和明显的可见光响应能力,具有利用自然太阳光的发展前景,所以在光催化领域倍受青睐[8-10]。Ag2CO3是银基半导体光催化剂的典型代表。但是,纯Ag2CO3的光化学稳定性较差,主要原因是Ag2CO3在光照下易发生光腐蚀,即光激发Ag2CO3导带中的电子(e-),而e-具有很强的还原性,使Ag2CO3晶体中的Ag+还原成银单质,失去半导体的性质。另外Ag2CO3的制备成本较高,弱的稳定性造成其循环使用困难,这样进一步增加了其使用成本。
贵金属的费米能级都比半导体的费米能级要低,光激发的电子可以从半导体的导带迁移到沉积在其表面的贵金属中,而空穴依然在半导体的价带,这个过程将极大地降低电子空穴对复合的几率,使得载流子能有效分离,有利于促进光催化反应的进行[11]。同时,光生电子的快速转移,可以在一定程度上避免Ag+被还原成银单质,从而提升Ag2CO3的稳定性。目前已报道的贵金属沉积Ag2CO3主要有:Ag/Ag2CO3[12],虽然沉积Ag能够提高Ag2CO3的稳定性,但是随着光照时间的增加,部分Ag2CO3会被电子还原成Ag单质,表面过量的Ag单质会阻碍可见光的照射。然而利用沉积Pt纳米粒子来提高Ag2CO3光催化性能的报道较少[13]。
本文通过NaBH4还原法将一定量的贵金属Pt纳米粒子沉积在Ag2CO3上,制备了系列Pt/Ag2CO3复合光催化剂,以可见光光催化降解甲基橙为探针反应,研究了沉积不同含量的Pt对Ag2CO3的表面性能、光吸收、光生载流子迁移等物理化学性质及其光催化活性和稳定性的影响,发现微量Pt的存在可以较大幅度地提升Ag2CO3光催化性能。
1 实验部分
1.1 催化剂的制备
采用沉淀方法制备Ag2CO3纳米晶。将一定化学计量比的Na2CO3和AgNO3分别溶解在10 mL去离子水中,在60℃水浴加热搅拌的条件下,将Na2CO3溶液逐滴地加入AgNO3溶液中,直至产生浅黄色沉淀,继续搅拌1 h,然后通过抽滤分离得到浅黄色固体物质,并用蒸馏水、无水乙醇各清洗3遍,置于60℃烘箱中烘干6 h,即得Ag2CO3纳米晶。
采用NaBH4还原方法制备Pt/Ag2CO3复合光催化剂。称取0.49 g Ag2CO3纳米晶超声分散于10 mL去离子水中,再将一定量的H2PtCl6溶液加入到分散液中,磁力搅拌5 min后,再继续加入微量的NaBH4乙醇溶液,然后剧烈搅拌20 min,随后将其抽滤,分别用乙醇和去离子水多次洗涤,置于恒温干燥箱中60℃烘干6 h得到Pt/Ag2CO3样品。Pt/Ag2CO3样品中Pt最终质量分数采用电感耦合等离子体光谱法(ICPS-1000,Shimadzu)进行测定。获得的样 品 分 别 表 示 为 Ag2CO3、0.1%Pt-Ag2CO3、0.5%Pt-Ag2CO3、1%Pt-Ag2CO3和 2%Pt-Ag2CO3。
1.2 催化剂的表征
利用Bruker D8 Advance型X射线粉末衍射(XRD)仪分析样品的物相(Cu Kα,λ=0.154 06 nm,工作电压 40 kV,电流 40 mA,扫描范围 10°~80°)。 样品的N2物理吸附在美国麦克公司的ASAP2020型物理吸附仪器测定(脱气温度90℃,脱气时间1 h),用BET法计算比表面积。分别采用日本日立(HITACH)公司的S-4800型扫描电子显微镜(SEM)和荷兰Philips CM-120型透射电镜(TEM)测定光催化剂样品形貌和微观结构。Pt的化学价态利用Quantum 2000型X射线光电子能谱 (XPS)(荷兰飞利浦)分析获得。在岛津2550型UV-Vis光谱仪上测定样品的紫外-可见漫反射吸收光谱,以标准BaSO4为参比,扫描范围为200~700 nm。应用日本日立F-4500型的荧光光谱仪测定样品的光致发光光谱,扫描范围为200~700 nm。采用Nicolet公司Magna IR 750型(USA)傅里叶变换红外光谱仪(FT-IR)进行红外测试,样品以KBr为底物做成压片。利用三电极电化学工作站(CHI-660E,China)测试光电流,使用0.1 mol·L-1Na2SO4饱和溶液作为电解质溶液,300 W氙灯作为光源,Ag/AgCl电极和Pt电极分别用作参比电极和辅助电极。
1.3 光催化性能测试
把含20 mg甲基橙的80 mL的染料水溶液与40 mg的催化剂混合超声分散后,置于350 W氙灯(用滤光片过滤掉波长小于420 nm的光)下进行可见光催化降解,以测定样品的光催化活性。为使染料达到物理吸附平衡,在光照前,先将混合液放置在黑暗环境下搅拌60 min。为保证反应过程的恒温条件,采用在反应器的玻璃器皿中通入循环冷凝水的方式维持温度(22℃)不变。反应过程中,每隔相同时间段对反应混合物进行取样、离心。利用染料分子的最佳吸收波长(460 nm)的吸收值来分析染料浓度的变化。利用公式:D=1-(C/C0),来计算染料的降解率,其中,C0为染料达到吸附平衡后的光催化反应的初始浓度,C为t时刻染料的浓度。
2 结果与讨论
2.1 XRD与BET比表面积分析
应用XRD分析光催化剂的结晶度。图1为纯Ag2CO3和Pt-Ag2CO3样品的XRD图。由图1可知,Ag2CO3样品在 2θ=18.5°、20.5°、32.7°、33.7°和 39.7°出现十分尖锐的特征衍射峰,分别对应于单斜晶系的 Ag2CO3(PDF No.026-0339)的 (020)、 (110)、 (101)、(202)和(130)晶面,这些特征衍射峰的强度较强,表明Ag2CO3具有良好的结晶性能。由图1还可看出,负载了Pt之后,Ag2CO3的特征峰没有发生明显的变化。同时由于沉积Pt的量太少,图中并没有观察到Pt的特征衍射峰。

图1 Ag2CO3与Pt-Ag2CO3样品的XRD图Fig.1 XRD patterns of Ag2CO3 and Pt-Ag2CO3 samples
根 据 Scherrer 公 式 :D=Kλ/(βcosθ)(系 数 K 为0.89;λ为入射特征X射线波长;β为半峰宽;θ为Bragg衍射角),选取样品中最强的特征衍射峰(202)晶面进行平均晶粒尺寸的计算。计算获得各样品的平均粒径列于表1。由表1可知,Ag2CO3的平均晶粒尺寸为~100 nm。表1同时给出利用N2物理吸附测得的BET比表面积。由表1可见,Ag2CO3的比表面积可以忽略,但是沉积Pt后,样品的比表面积略有增大,主要是由于沉积的Pt粒子在Ag2CO3表面的高度分散。

表1 Ag2CO3与Pt-Ag2CO3的平均粒径与比表面积Table 1 Average grain size and surface area of Ag2CO3 and Pt-Ag2CO3 samples
2.2 SEM和TEM分析
图2为纯Ag2CO3和0.5%Pt/Ag2CO3的低放大和高放大倍数的扫描电镜照片。从图2(a)和2(c)的低放大倍数的SEM照片可见,Ag2CO3整体形貌呈长方体状颗粒;图2(b)和图2(d)的高放大倍数的扫描电镜照片表明,Ag2CO3长方体状颗粒表面比较粗糙,表面有大量形貌不规则的小颗粒。
图3为0.5%Pt-Ag2CO3样品的TEM照片。在图3(a)中可见0.5%Pt-Ag2CO3由长方体状颗粒组成。图3(b)为0.5%Pt-Ag2CO3的高分辨透射电镜,在该图中可以找到晶格间距为0.23 nm的晶面,这个晶面对应于金属态Pt的(111)晶面,证实了Pt纳米粒子的存在。
2.3 UV-Vis DRS和FT-IR分析
通过紫外-可见漫反射吸收光谱 (UV-Vis DRS)考察沉积Pt纳米粒子对Ag2CO3的光吸收性能的影响。由图4可见,纯Ag2CO3在可见光区呈现较强的吸收,其吸收边在480 nm左右。复合一定量的Pt纳米粒子以后,样品在可见光区吸收能力进一步增强,吸收边进一步红移,且随着Pt含量的增加,红移效果更加明显,Pt纳米粒子沉积导致复合样品的可见光吸收能力显著增强的原因可能是由于Pt纳米粒子的表面等离子共振吸收所引起[14-15]。

图2 Ag2CO3与0.5%Pt-Ag2CO3样品的低放大和高放大倍数的SEM照片Fig.2 Low and high magnified SEM images of Ag2CO3 and 0.5%Pt-Ag2CO3 samples

图3 0.5%Pt-Ag2CO3样品的低分辨和高分辨透射电镜照片Fig.3 Low and high resolution TEM images of 0.5%Pt-Ag2CO3 sample

图4 Ag2CO3与Pt-Ag2CO3样品的UV-Vis DRS图谱Fig.4 UV-Vis DRS spectra of Ag2CO3 and Pt-Ag2CO3 samples
图5 为Ag2CO3与Pt-Ag2CO3样品的FT-IR谱图。所有样品在3 300 cm-1附近均有一个很宽的吸收峰,为Ag2CO3表面羟基(-OH)的伸缩振动峰;在1 445 cm-1附近处一个弱的吸收峰,归为Ag2CO3表面物理吸附水分子(H-O-H)的弯曲振动峰。在1 375、879、791 cm-1附近出现的吸收峰为 CO32-的特征吸收峰。由该图可知,沉积0.1%Pt和0.5%Pt的样品的表面羟基特征伸缩振动峰更强更宽,说明光催化剂的表面存在更多的羟基,但是随着Pt的继续增加,其特征伸缩振动峰则渐渐变弱。
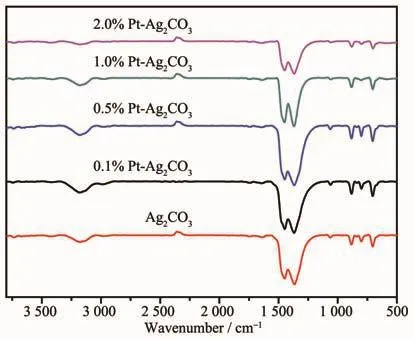
图5 Ag2CO3与Pt-Ag2CO3样品的FT-IR图谱Fig.5 FT-IR spectra of Ag2CO3 and Pt-Ag2CO3 samples
2.4 XPS分析
图 6(a)~(d)分别为 0.5%Pt-Ag2CO3样品中 C1s、O1s、Pt4f和Ag3d的高分辨XPS图,图6(a)中的C1s可归属于Ag2CO3中的C。在O1s的高分辨XPS谱可以清楚地看到一组肩峰,说明复合物中存在着2种化学状态的O,在结合能为531.2和532.1 eV处的2个峰分别归于Ag2CO3中的晶格氧和Ag2CO3表面的羟基氧。图6(c)的Pt4f高分辨谱图表明,结合能为71.5和74.7 eV处的2个峰分别归于Pt中的Pt4f7/2和Pt4f5/2。证实Pt-Ag2CO3中的铂为0价的金属Pt[16]。图6(d)为Ag3d的高分辨XPS谱图,结合能位于373.8和367.8 eV的2个尖峰对应于Ag3d3/2和Ag3d5/2,表明Ag的化学价态为+1。

图6 0.5%Pt-Ag2CO3的高分辨XPS图谱Fig.6 High resolution XPS spectra of 0.5%Pt-Ag2CO3
2.5 PL和PC分析
光致发光谱(PL)常被应用于分析半导体中光生电子与空穴对复合情况。光生电子与空穴对分离效率越高,则由于光生电子与空穴复合的光致发光则越弱。图7为所制备样品的PL谱图。从该图中可见,在450 nm左右,Ag2CO3和Pt-Ag2CO3有较强的发射峰。沉积Pt后,Pt-Ag2CO3的PL峰的强度具有不同程度的减弱,其中1.0%Pt-Ag2CO3的PL峰最弱。Pt-Ag2CO3光催化剂的PL谱图强度的减弱,表明样品中的光生电子与空穴复合减弱了。因此,将有更多的光生电子与空穴参与生成更多的羟基自由基(·OH)和超氧自由基(·O2-)等光催化活性自由基,从而提高光催化反应的活性。
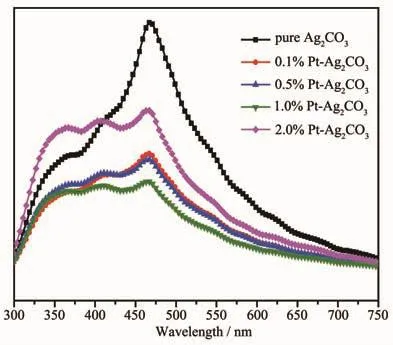
图7 Ag2CO3与Pt-Ag2CO3样品的PL谱图Fig.7 PL spectra of Ag2CO3 and Pt-Ag2CO3
光生电子和空穴的分离情况还可以用光照下产生的光电流(PC)强弱进行分析,光电流响应强度越强,意味着半导体催化剂的光生电子转移效率越高[17]。图8为Ag2CO3与Pt-Ag2CO3在光照下的光响应图,可以发现沉积Pt后的Ag2CO3的光电流响应强度明显增强,表明Pt可以承担电子俘获中心的作用,Ag2CO3在光激发后产生的电子有效转移到Pt上,极大地提高了光生电子转移的效率,使得光生电子空穴的复合量有所降低,这个结果与PL中的结果基本相似。
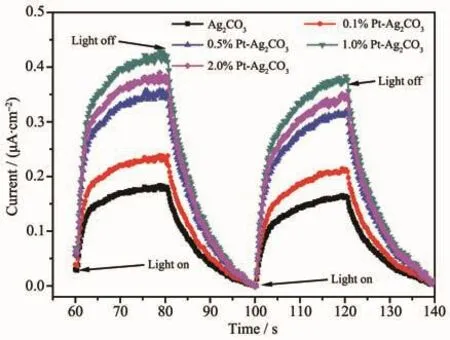
图8 Ag2CO3与Pt-Ag2CO3样品的光电流曲线Fig.8 Photocurrent curves of Ag2CO3 and Pt-Ag2CO3 samples
2.6 光催化性能测试
图9 (a)为50 min内,不同样品在可见光照射下降解染料甲基橙的进程图。从图9(a)可以发现,Pt的沉积使Ag2CO3光催化剂的活性有极大程度的提高,甲基橙降解率由30%提升到90%以上。其中甲基橙在0.1%Pt-Ag2CO3和0.5%Pt-Ag2CO3的降解率达到~95%。Ag2CO3作为光催化剂的另一较大缺点是光照下容易发生光腐蚀,稳定性很差。因此,我们利用光催化剂在相同条件下的循环实验考察Pt对Ag2CO3的稳定性的影响,结果见图9(b)。图9(b)中甲基橙的降解率表明,Ag2CO3在第2次反应中活性大幅降低,在第3次反应基本失去光催化活性;0.5%Pt-Ag2CO3则在循环反应中的稳定性大幅度提升,在第5次循环反应后甲基橙的降解率能够维持在56%,说明少量Pt的存在确实能较大程度地提升Ag2CO3的稳定性。
结合前面的各种表征结果,我们对Pt提升Ag2CO3光催化性能的原因讨论如下:比表面积(BET)测试表明,Pt纳米粒子的存在使催化剂的比表面积仅略有增加,对光催化性能影响较小;红外(FT-IR)测试结果表明复合Pt后,催化剂具有更丰富的表面羟基,表面羟基的数量增加则有利于光生空穴(h+)与羟基的反应,生成更多的羟基自由基(·OH),羟基自由基是有机染料降解的主要活性基团。荧光光谱(PL)和光电流测试(PC)的分析结果表明,Pt提升Ag2CO3光催化性能另一重要原因是,沉积在Ag2CO3表面的Pt粒子可以承担电子俘获中心的作用,使Ag2CO3中光激发产生的电子有效转移到Pt上,极大加速光生电子-空穴对的分离速率,产生更多的活性自由基,提升光催化活性,同时减少Ag2CO3中的Ag+被光生电子(e-)还原的几率,提升Ag2CO3抗光腐蚀性和稳定性。

图9 沉积Pt对Ag2CO3光催化性能的影响:(a)甲基橙在光照下浓度变化图;(b)Ag2CO3与0.5%Pt-Ag2CO3的稳定性比较Fig.9 Effects of deposited Pt on the photocatalytic performance of Ag2CO3:(a)Variation of methyl orange concentration under light irradiation;(b)Stability comparison of Ag2CO3 and 0.5%Pt-Ag2CO3 in recycling test
为了进一步证实在Pt-Ag2CO3体系参与染料降解的自由基,我们利用电子自旋共振(ESR)技术分析光照下Pt-Ag2CO3产生的自由基的情况。选用5,5-二甲基-1-吡咯啉N-氧化物(DMPO)作为自由基的捕获试剂,测试结果见图10。图10表明,在光照之前没有观察到ESR信号,表明没有·OH和·O2-自由基产生。光照后,出现DMPO-·O2-的微弱ESR信号,表明有少量·O2-自由基生成。此外,光照后观察到了非常明显的DMPO-·OH信号。因此,在Pt-Ag2CO3体系中,光催化降解反应的主要自由基是·OH,而·O2-自由基也参与了反应。

图 10 0.5%Pt-Ag2CO3中的 DMPO-·OH 和 DMPO-·O2-ESR信号Fig.10 ESR signals of DMPO-·OH and DMPO-·O2-of 0.5%Pt-Ag2CO3
3 结 论
通过NaBH4还原法制备了Pt-Ag2CO3复合光催化剂。研究结果表明沉积少量的Pt可以增强Ag2CO3对可见光的吸收,同时提升Ag2CO3的比表面积和表面羟基的数量。另外,沉积在Ag2CO3表面的Pt粒子可以承担电子俘获中心的作用,使Ag2CO3中光激发产生的电子有效转移到Pt上,极大加速光生电子-空穴对的分离速率,产生更多的活性自由基,提升光催化活性和稳定性。因此,贵金属沉积将是一条提升Ag2CO3光催化活性和稳定性的有效途径。

