紫果西番莲愈伤组织诱导分化及不定芽增殖研究
王亚楠 张湛仪 赵李姗 余俊玲 汪梦婷 蔡年辉 唐军荣 许玉兰
( 1. 西南林业大学国家林业局西南地区生物多样性保育重点实验室,云南 昆明 650233;2. 西南林业大学西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650233;3. 西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650233;4. 奈曼旗林业局奈曼旗沙日浩来林业工作站,内蒙古 通辽 028300)
西番莲(Passiflora caerulea)是西番莲科(Passifloraceae)西番莲属(Passiflora)的一种热带草质或半木质藤本植物,又名鸡蛋果、百香果、计时果[1]。西番莲属植物有400多种,原产南美洲的巴西至阿根廷一带[2]。我国主要分布在台湾、广东、福建、广西、浙江、四川等省区。果实供食用的西番莲主要有6种:紫果西番莲(P. edulis)、黄果西番莲(P. edulisf.flavicarpa.)、樟叶西番莲(P. laurifolia)、大果西番莲(P. quadrangularis)、甜果西番莲(P.1igularis)和香蕉西番莲(P. mollissima),目前商业栽培种主要是紫果西番莲和黄果西番莲[3]。
西番莲果实为浆果,味道鲜美,富含各种营养成分,在国际饮料市场占有重要地位,素有“饮料之王”的美誉,且根、茎、叶、花还可入药[3]。近年来国际市场对西番莲果汁的需求每年以15%~20%的速度增长,大有供不应求之势。除果汁外,果汁粉、蜜饯、口香糖等产品也深受欢迎[4]。而我国西番莲种质资源相对缺乏,生产中存在较多问题,如品种单一,产量低,品质、抗病性差,影响了西番莲种植业和加工业的发展[5]。紫果西番莲果汁味道芬芳,其独特的芳香味是由60多种挥发性化合物组成,有脂类、醇类、醛类、酮类、萜烯类和其他杂类化合物[6]。但在紫果西番莲的果实中,果汁(浆)占果质量的45%~53%,种子占果质量的5%~20%[6]。果实中大量的种子,会影响食用的口感,也会增加果实的加工成本。因此,在今后西番莲的品种选育中,果实中少籽或无籽也是品种选育的一个重要目标。
基于植物组织培养开展的倍性育种,是人工获得三倍体的最有效途径,但该项工作的首要关键,就是要有一个稳定高效的植株再生体系。目前关于西番莲的组培研究中,牛俊乐等[7]、李红艳等[8]均利用西番莲的幼嫩带腋芽茎段诱导出了芽;丰锋等[9]利用西番莲的子房、柱头、幼胚诱导出愈伤组织,但是通过种子离体培养得到子叶来建立西番莲离体快繁体系的仅有史沉鱼等[10],且愈伤组织诱导率及芽增殖率均较低,植株再生体系的再生率不高。Sanchez等[11]对西番莲属植物的叶绿体DNA进行限制性内切酶片段长度多态性分析(RFLP),结果显示,西番莲种间存在广泛的遗传变异,但是基于离体快繁技术培育筛选优良品种,并通过酶分解得到原生质体,继续培养得到再生植株,为西番莲远缘杂交,克服有性杂交不亲和性提供手段,从而使引进优良西番莲的抗性基因成为可能[2]。基于此,为了建立高效的紫果西番莲的植株再生体系,以紫果西番莲种子离体培养的子叶为实验材料,研究西番莲的植株再生体系,为西番莲优良家系的快速繁殖、倍性育种、基因工程以及遗传转化方面的研究提供参考。
1 材料与方法
1.1 无菌材料获得
将紫果西番莲的种子经80%浓硫酸浸泡3.5 h使其碳化部分种皮,然后在无菌操作台分别用75%的乙醇消毒30 s和0.1%的升汞进行消毒8 min,消毒结束后,无菌水冲洗3~4次,最后去除剩余种皮,将完整的种子接种在培养基上,30 d后取其展开的子叶作为后续实验材料。
1.2 愈伤组织诱导
将叶片切成1.5 cm×1.5 cm左右的大小方块,在垂直叶脉处轻轻划出伤口,然后接种到愈伤组织诱导培养基上。选择MS为基本培养基,分别附加琼脂3.8 g/L,蔗糖30 g/L,pH为5.9±0.1,添加不同浓度的细胞分裂素TDZ(噻苯隆)(0.5、2.0 mg/L),生长素2,4-D(2,4-二氯苯氧乙酸)(0.5、1.0、1.5、2.0 mg/L),经 121 ℃ 高温灭菌20 min,共8个处理,每个处理3次重复,每个重复5瓶,每瓶接入2个材料。
1.3 不定芽诱导
将诱导出的愈伤组织,转移至不定芽分化培养基中。以MS为基本培养基,分别附加琼脂3.8 g/L,蔗糖30 g/L,pH为5.9±0.1,经121 ℃高温灭菌20 min,添加不同浓度的细胞分裂素TDZ(1.0、1.5、2.0 mg/L),生长素2,4-D为0.5 mg/L,共4个处理,每个处理3次重复,每个重复5瓶,每瓶接入2个材料。
1.4 不定芽增殖
以MS为基本培养基,分别附加琼脂4.0 g/L,蔗糖 30 g/L,pH为5.9±0.1,经 121 ℃ 高温灭菌20 min,添加不同浓度的细胞分裂素6-BA(6-苄氨基嘌呤)(1.0、2.0、3.0 mg/L),生长素IAA(吲哚-3-乙酸)(0.1、0.3、0.5 mg/L)。采用L9(34)正交设计实验(表1、表2),共9个处理,每个处理3次重复,每个重复5瓶,每瓶接入2个材料。
1.5 培养条件
培养室的温度(25±2) ℃,光照时间为12 h/d,光照强度1 000~1 500 lx。
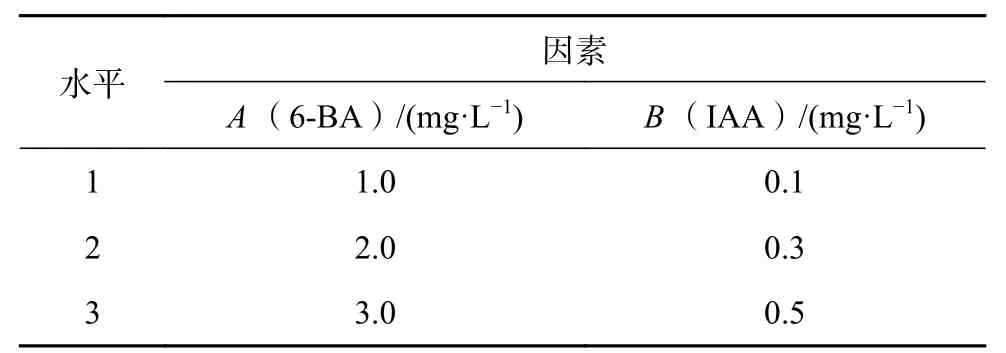
表 1 实验因素水平Table 1 Factors and levels of the experiment
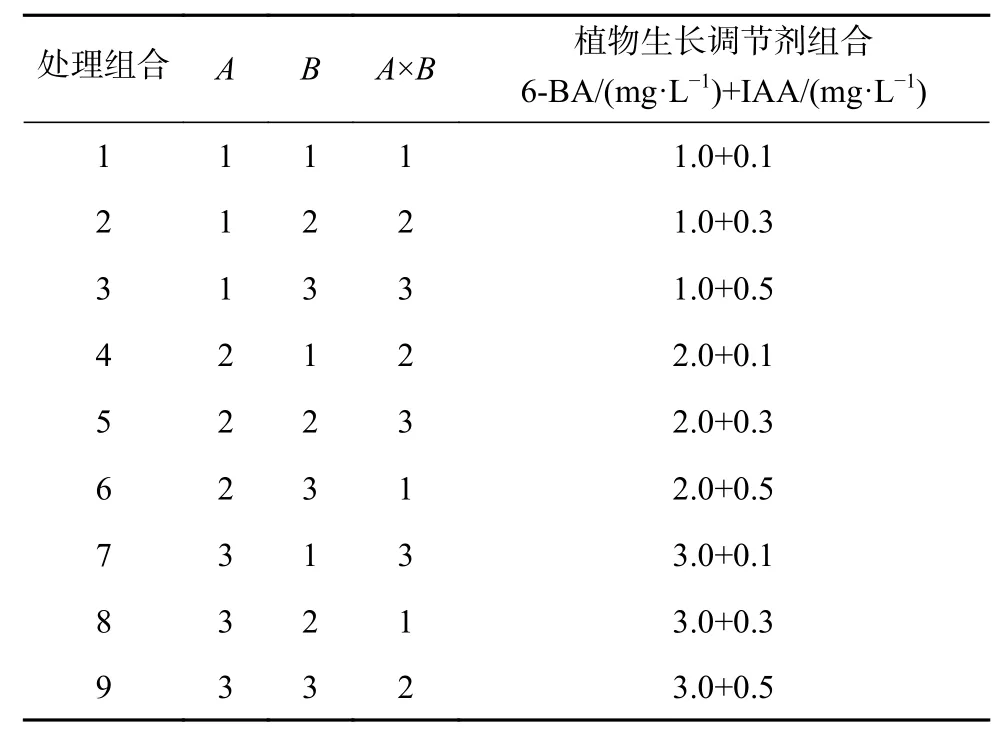
表 2 6-BA和IAA正交实验设计Table 2 Orthogonal test design of 6-BA and IAA
1.6 数据分析
用Excel表格对数据进行整理,SPSS 18.0进行数据统计、方差分析、多重比较(Duncan’s法)以及极差分析。
2 结果与分析
2.1 生长素与分裂素不同配比对愈伤组织诱导的影响
在不同2,4-D与TDZ质量浓度配比的各个培养基上,西番莲愈伤组织诱导呈显著差异。叶片接进培养基7 d后伤口处开始膨大,10 d开始有淡绿色愈伤组织点出现,30 d后统计结果(表3)。由结果可以看出,处理2的诱导率与处理1、5、6、8之间存在显著差异,愈伤组织诱导率最高的是处理2,为73.33%,愈伤组织为黄绿色,较紧实,量比较多,并有不定芽的分化,诱导率最低的为处理5,未见有愈伤组织,且在30 d统计的时候,叶片出现褐化死亡。在TDZ浓度为0.5 mg/L时,随着2,4-D浓度的增高,愈伤组织诱导率也增加,在2,4-D为1.0 mg/L时达到最大值,随后出现下降趋势。当TDZ浓度提高到2.0 mg/L时,诱导率也是先上升后下降。由结果还可以看出,当TDZ浓度从0.5 mg/L提高到2.0 mg/L时,诱导率整体出现下降的趋势,说明高浓度TDZ可能会抑制愈伤组织的形成,并且形成的愈伤组织均为黄色偏白色,继续培养分化能力很弱。综合比较,诱导西番莲子叶愈伤组织的最适培养基为:MS+2,4-D 1.0 mg/L+TDZ 0.5 mg/L。
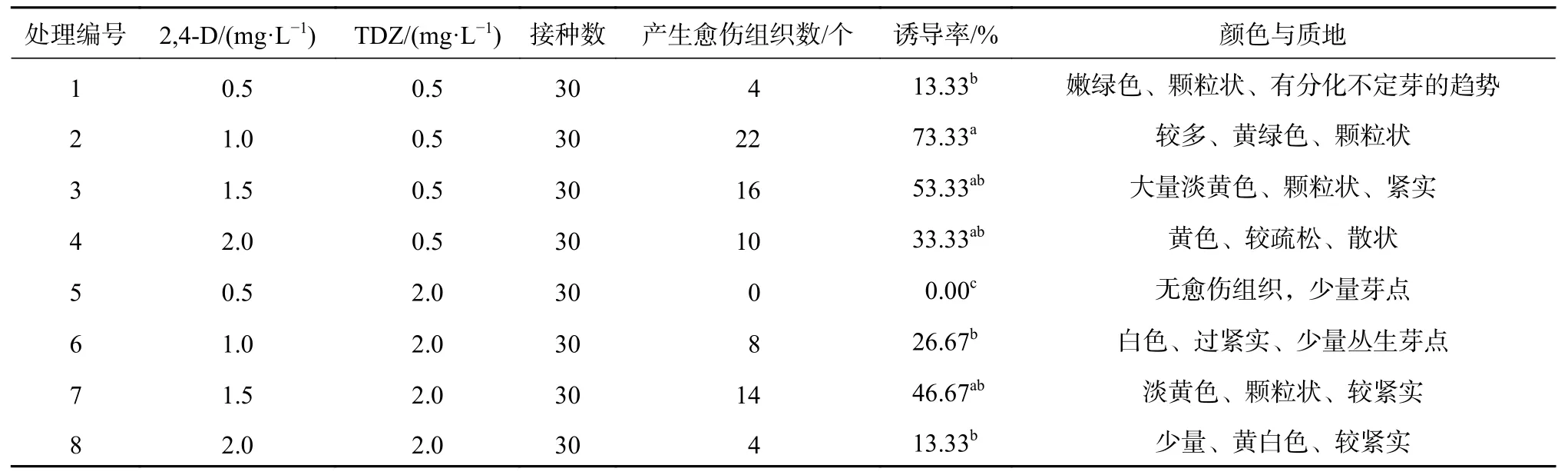
表 3 不同植物生长调节剂组合对愈伤组织诱导的影响Table 3 Effects of different hormone combinations on callus induction
2.2 生长素与分裂素不同配比对愈伤组织分化芽的影响
在诱导愈伤组织的过程中,发现当2,4-D的浓度在0.5 mg/L时分化出不定芽,所以在诱导愈伤组织分化芽时将2,4-D浓度设置在0.5 mg/L,将TDZ的浓度分别设置在0.5、1.0、1.5、2.0 mg/L。愈伤组织接进培养基15 d左右开始有不定芽分化出来,40 d统计结果如表4。由表4可知,4个处理之间的分化率差异不显著。当TDZ浓度为2.0 mg/L时,不定芽诱导率最高,为46.67%,且诱导出的丛生芽数量较多,芽较粗壮,适合做诱导继代材料,诱导率最低的TDZ为1.5 mg/L,为6.67%,不定芽数量较少,但是分化出的不定芽较高,说明提高TDZ的浓度,可能对芽的分化以及生长是比较有利的。综合来看,诱导愈伤组织分化不定芽的最适培养基为:MS+2,4-D 0.5 mg/L+TDZ 2.0 mg/L。

图 1 西番莲诱导分化Fig. 1 Induced differentiation of P. caerulea
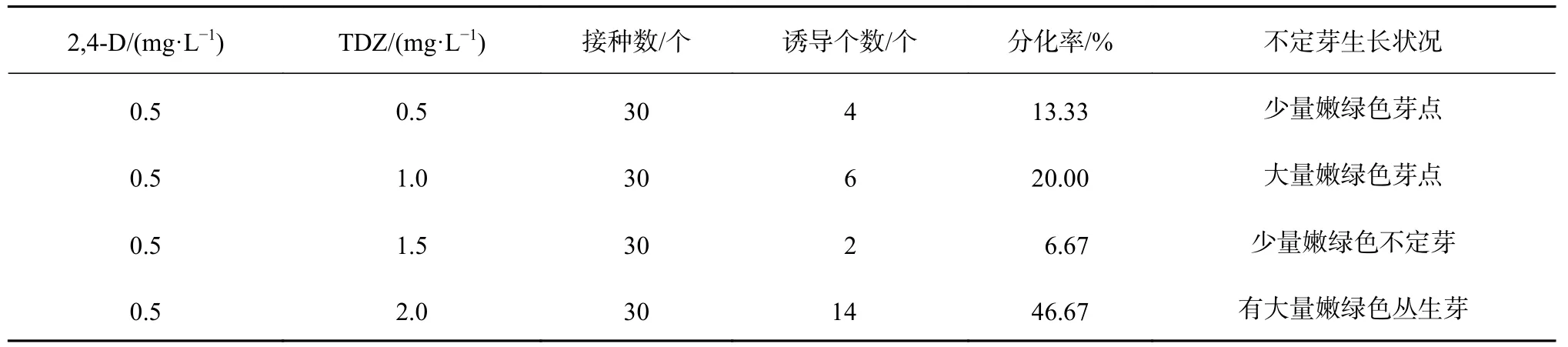
表 4 不同植物生长调节剂组合对愈伤组织分化芽的影响Table 4 Effects of the different hormone combinations on callus differentiation buds
2.3 生长素与分裂素不同配比对不定芽增殖的影响
不同的细胞分裂素可以促进西番莲不定芽增殖,前期实验表明以6-BA的增殖效果最好。将生长到基本一致的不定芽切下,接到不同浓度的6-BA与IAA组合的培养基上,各处理可对诱导出的不定芽进行增殖,初期不定芽伤口处膨大长出少量黄绿色愈伤,培养10 d左右在芽的基部开始有少量不定芽点长出,增殖倍数从1.43~2.97(表5),平均的启动时间集中在10~15 d,45 d后统计芽的增殖数量。结果表明,不同处理对不定芽增殖率影响达到了显著水平,用Duncan法对每个处理进行多重比较,处理2的增殖率显著高于除了处理5、7的其他处理。处理2的增殖倍数最高,为2.97,此时6-BA的浓度为1.0 mg/L,IAA的浓度为0.3 mg/L,苗的长势较好,比较健壮,叶片展开面积较大,且为嫩绿色。增殖倍数最低的是处理8,为1.43,此时6-BA的浓度为3.0 mg/L,IAA的浓度为0.3 mg/L。由结果还可以看出,当IAA浓度为0.3 mg/L时,随着6-BA的浓度增大,增殖倍数呈下降趋势,当6-BA达到3.0 mg/L时,愈伤组织分化不定芽的时间最迟,增殖的不定芽植株较矮,在统计28 d左右逐渐出现基部叶片脱落死亡的现象,而且整个不定芽的叶片均偏黄绿色,不利于继代使用,说明6-BA浓度过高可能会抑制芽的增殖。
进一步进行极差分析(表6),由表6可知,影响不定芽增殖的主导因子是生长素IAA,理论优水平组合为处理2(A1B2),与实际结果相同,培养45 d后的统计结果显示,以MS+6-BA 1.0 mg/L+IAA 0.3 mg/L为最佳增殖培养基,增殖倍数为2.97。随着6-BA的浓度增大,增殖倍数却在减小,对因素水平进行方差分析,PA≈0.422>0.05,表明6-BA浓度的变化对增殖倍数的影响差异不显著。而随着IAA浓度的增大,增殖倍数先增大后降低,PB≈0.065>0.05,表明IAA浓度的变化对增殖倍数的影响差异不显著。考虑6-BA与IAA交互作用时,随着2种植物生长调节剂浓度的增大,增殖倍数先增大后降低,但是PA×B=0.084>0.05,表明2种植物生长调节剂的浓度变化对增殖倍数的影响差异不显著。
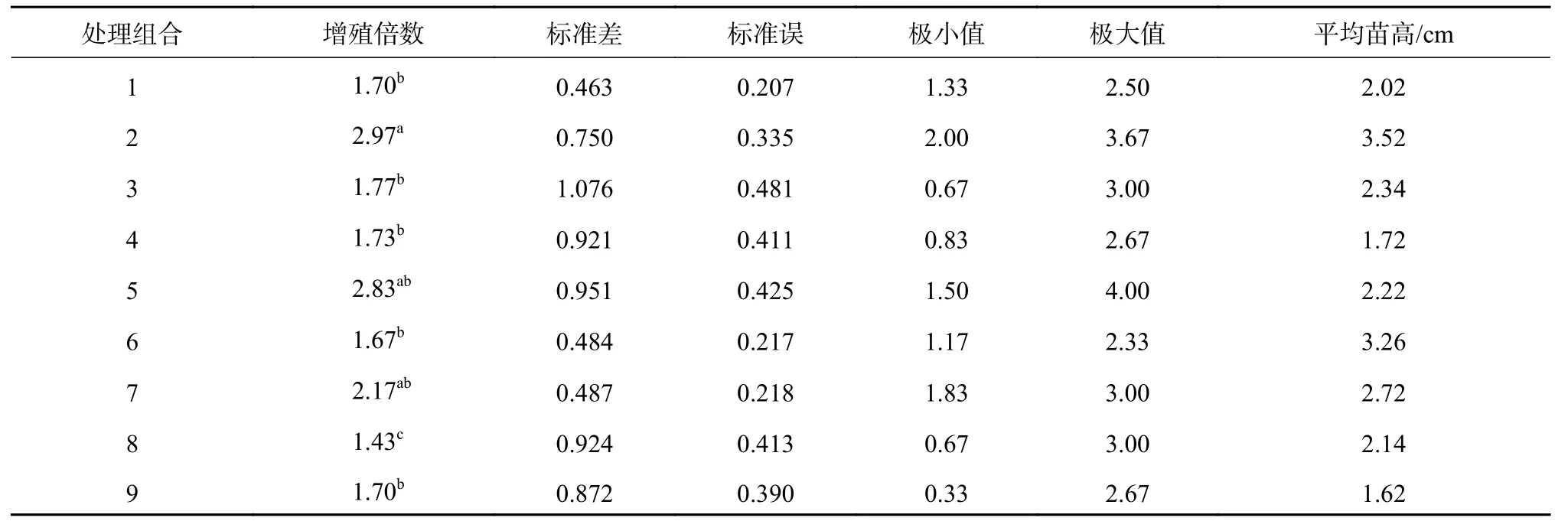
表 5 不同处理组合芽的增殖效果统计学描述Table 5 Descriptive statistics of the proliferation effect of the different combinations of buds
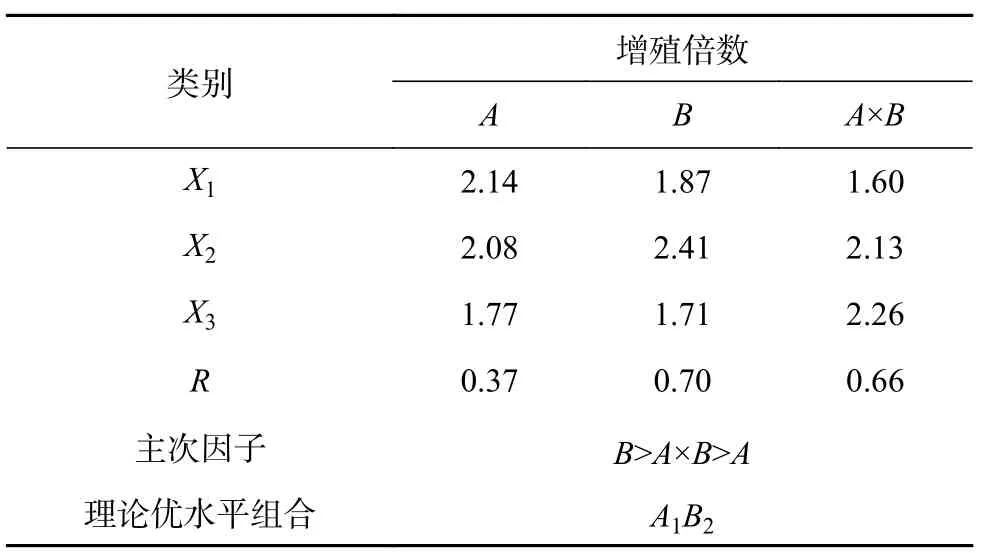
表 6 因素水平的极差分析Table 6 Range analysis of factors and levels
3 结论与讨论
在秋水仙素处理愈伤组织进行加倍的过程中,愈伤组织的分化效率会直接影响倍性育种的进程。而在建立稳定高效的植株再生体系中,外植体选择是至关重要的。本研究以子叶为愈伤组织诱导的初始材料,子叶薄壁组织含量高,是植株再生过程中较为理想的材料。与来自室外母株的成熟茎段上的叶片相比,生理状态处于幼嫩时期,愈伤组织诱导率较高,且诱导时间较短,再生能力较强[12]。西番莲种子的外种皮十分坚硬、且种子小,直接挑取子叶十分困难。而经浓硫酸浸泡种皮炭化一部分去种皮再萌发,取无菌苗的子叶作为外植体,可以极大避免污染的发生[10]。
植物生长调节剂能够有效促进愈伤组织的形成、侧芽的萌发和不定芽的产生。TDZ作为一种高效的分裂素,能够在较短的时间内有效的刺激植株再生[13]。2,4-D是一种人工合成的植物生长素,在低浓度时刺激植物生长,并促进愈伤组织的形成,但在高浓度时,则会抑制生长甚至毒杀植物[14]。愈伤组织诱导结果表明,高浓度的2,4-D和TDZ虽然能刺激植株的愈伤组织生长,但是生长出来的愈伤组织很难继续分化,不利于芽的诱导以及愈伤组织增殖培养。愈伤组织的诱导受外植体的类型影响较大,而选用合适的外植体,能大大提高愈伤组织的诱导率。史沉鱼等[10]利用种子萌发的无菌材料根部诱导愈伤组织最优处理MS+2,4-D 2.0 mg/L+IBA 0.2 mg/L,诱导率最高仅为32%。包英华等[15]对豇豆(Vigna unguiculata)丰产2号进行愈伤组织诱导时,发现愈伤诱导率下胚轴>顶芽>上胚轴>真叶。而在之后陈高等[16]研究豇豆的子叶和下胚轴的愈伤组织诱导实验中,证明愈伤组织诱导率子叶>下胚轴。但是愈伤组织的分化,较愈伤组织的诱导,其难度更高。在研究结果可以看出,经愈伤组织再分化,不定芽的诱导率明显要低于愈伤组织的诱导率。李红艳等[17]在研究西番莲离体培养实验时对由不同部位诱导出来的愈伤组织进行芽的分化,茎段愈伤组织的不定芽诱导率最高为12.5%,叶柄诱导的愈伤组织,不定芽诱导率为1.39%,而由叶片诱导出的愈伤组织则未能分化。而此次实验中通过对子叶诱导愈伤组织进行芽的分化,分化率最高为46.67%,最适培养基为:MS+2,4-D 0.5 mg/L+TDZ 2.0 mg/L,明显高于前人所做实验的结果。
繁殖体的增殖,植物生长调节剂是一个非常关键的要素。不定芽增殖过程中,随着6-BA浓度的升高,不定芽增殖倍数整体呈下降趋势,虽然处理7在6-BA为3.0 mg/L时,增殖倍数达到2.17,但经多次继代后,会形成较多的畸形芽,导致有效芽的数量呈现下降趋势;而低浓度的6-BA诱导出的苗会保持较高活力,且畸形苗少。这表明较高浓度的分裂素,虽然可以促进不定芽再生,但不利于继代增殖。张琴等[4]曾利用子叶诱导出的不定芽进行增殖,增殖系数最高为3.0,最佳培养基为MS+6-BA 2.0 mg/L+NAA 0.2 mg/L。陈发兴[18]利用西番莲的茎段诱导出的不定芽进行增殖,增殖系数最高为3.3,最佳培养基为MS+6-BA 1.0 mg/L+NAA 0.1 mg/L。本次实验的增殖倍数最高为2.97,最佳培养基为MS+6-BA 1.0 mg/L+IAA 0.3 mg/L,结果低于二人所得实验结果,说明不同外植体材料对分化出的不定芽增殖有非常重要的影响[19]。不同种类及配比的生长素与分裂素对不定芽的分化也起到了至关重要的作用[20-22],分裂素与生长素的配比大时分化率较高,但是过高则会抑制芽的形成,而且对继代增殖也有不利的影响,这与本次研究结果是相似。
本实验以紫果西番莲无菌苗的子叶为外植体开展了植株再生体系的研究,其中愈伤组织诱导率为73.33%,愈伤组织不定芽的诱导率为46.67%,不定芽的继代增殖倍数为2.97。建立的紫果西番莲植株再生体系,可满足后期的多倍体育种需求,也可为工厂化育苗、遗传转化提供技术参考。

