红花玉蕊对淡水全淹胁迫的生长及生理响应
梁 芳 黄寿镕 於艳萍 黄秋伟 张 继 檀小辉
( 1. 玉林师范学院,广西 玉林 537000;2. 广州普邦园林股份有限公司,广东 广州 510600;3. 广西壮族自治区亚热带作物研究所,广西 南宁 530001)
红花玉蕊(Barringtonia acutangula)为玉蕊科(Lecythidaceae)玉蕊属(Barringtonia)植物,常绿小乔木,原产东南亚海滨地带,我国已成功引种[1]。该植物常生长于潮湿的地方,具有一定的耐旱和抗涝能力,有淡水红树植物的美称[2],同时具有较高的园林应用价值,可用于城市公园、居住区绿地、道路绿地等景观绿化美化,尤其适于营造湿地景观。
我国洪涝灾害严重,涝害会导致很多植物成活率下降,生产力普遍降低[3]。淹水胁迫严重影响着植物的分布以及正常的生长发育[4]。近年来,国内外学者对植物淹水胁迫响应上的研究也取得一定成果,如利容千等[5]发现在水淹胁迫下,植物体内的抗氧化酶类能减轻水淹造成的危害,增加植物抗逆性。Ellison等[6]发现大红树(Rhizophora mangle)如遭受长时间淹没,植株缺氧致植株生长受抑制,且不同的红树植物、半红树植物生长速率在同一逆境下会有所不同。Chen等[7]发现秋茄(Kandelia candel)生长在潮汐带,受海水潮汐交替作用可促进其生长发育。刁俊明等[8]研究发现桐花树(Aegiceras corniculatum)在淡水全淹90 d内生长良好,在淹水为0~2/4水位360 d内均保持很好的生长状态。综上诸多研究表明,耐水淹的植物应对淹水胁迫已经形成内在的响应机制,且响应机制因植物因环境而异[9-10],因此对植物耐水淹确切机制的研究非常重要。
目前,国内外对红花玉蕊逆境中生理生化方面的研究极少,应对淹水胁迫逆境的研究更少。国内外关于红花玉蕊的研究多为植株根、茎、叶、果实等部位天然产物提取及活性成分分析上,Mukhlesur等[11]和Mills等[12]的研究发现红花玉蕊也有较高的药用价值。吴竹妍等[13]研究发现半红树植物玉蕊(Barringtonia racemosa)具有弱耐盐性,但由于种种原因,现已经被列入濒危物种[14],而随着红花玉蕊在国内的成功引种,对水淹胁迫的相关研究便变得越来越迫切,随着研究的不断深入,红花玉蕊的应用将越来越广,将更有力地促使我国红树林维持滨海湿地生态平衡功能延伸到内陆湿地生态系统中,对维护生态多样性发挥重要作用。因此,本试验研究潮汐系统下红花玉蕊对淹水胁迫的响应,揭示红花玉蕊对淹水胁迫的生理响应机制,获得红花玉蕊适生的淹水时长范围,以期为城市内河绿化美化、恢复红树林,湿地植被恢复适生树种选择提供参考。
1 材料与方法
1.1 试验材料
于2017年9月初将健壮且长势一致的4月苗龄红花玉蕊实生苗移栽到规格为13 cm×12 cm的营养袋中,营养袋中所用土壤为V(果园土)∶V(椰糠)=1∶1。幼苗放在广西壮族自治区亚热带作物研究所温室(108°70′38″E, 22°53′S3″N)内精心管护6个月,植株无病虫害、发育良好、生长较为一致,且幼苗高度已达(17±5) cm,叶片数(9±5)片后,可进行不同淹水时长胁迫处理。试验期间以晴天为主,光热资源充沛。
1.2 试验方法
试验由储水槽、植物培养槽,定时器、水泵、过滤系统、补光系统及遮阴系统等组成模拟潮汐自动控制装置,即用定时器来自动控制各处理槽里水泵的抽水时间,以达到所设置的试验时间梯度。试验于2018年3月7日—2018年4月4日,每天上午7:00在温室大棚内进行。设淹水时长为0(CK)、2、4、6、8、10、12 h/d,共7个处理,每个处理3次重复,每个重复4株红花玉蕊苗。模拟半日潮,12 h为1个淹水周期,每个半日潮幼苗被淹没时间为0、1、2、3、4、5、6 h。每7 d测1次生长指标,处理28 d后采样,取红花玉蕊幼苗中上部成熟叶进行各项生理指标测定。
1.2.1 形态指标调查
1)在淹水处理前后,用卷尺(精确到0.1 cm)测定植物株高,每株测定3次,取平均值。按公式(1)~(2)计算株高增长量(H1)和株高平均增长率(H2)。

式中:n为处理周数,且n≥1。
2)每株用游标卡尺(精确到0.02 mm)在东、西、南、北方向各测定2次地径,取平均值,按(3)~(4)公式计算地径增长量D1和地径平均增长率(D2)。

式中:n为处理周数,且n≥1。
3)植株叶片数直观且容易测定,直接读取,记录数据。按公式(5)~(6)计算叶片数变化量(L1)和叶片平均增长率(L2)。

式中:n为处理周期,且n≥1。
1.2.2 生理指标测定
超氧化物歧化酶(SOD)活性测定采用氮蓝四唑法;过氧化物酶(POD)活性测定采用愈创木酚法;丙二醛(MDA)含量的测定采用硫代巴比妥酸氧化法;游离脯氨酸含量测定采用茚三酮比色法。吸光值测定均采用T6紫外可见分光光度计(北京普析通用仪器有限公司,中国)测定,各指标测定方法参照文献[15],但为最大限度保证在提取SOD和POD过程中这2种酶的活性,本研究所用研钵均在试验前1晚置于-20 ℃冰箱预冷,第2天随用随取,所有样品研磨全程研钵均置于冰上。
1.3 数据分析
所有试验数据采用Excel 2007整理后再用Graphpad Prism 7.0软件制图,数据统计分析使用SPSS 19.0软件,平均值间的比较采用单因素方差分析,多重比较采用Duncan检验法,显著性检验水平均设置为0.05。
2 结果与分析
2.1 不同淹水时长对红花玉蕊幼苗株高的影响
由图1可知,淡水全淹胁迫下,不同淹水时长处理红花玉蕊幼苗株高有所升高,处理期间幼苗株高总平均增量为1.5~2.0 cm,株高增量最小值出现在淹水8 h/d,各处理与CK相比差异不显著,表明不同淹水时长对株高总增量影响不大。由表1可知,不同淹水时长对红花玉蕊幼苗株高增长速率的影响差异不显著,不同淹水天数对幼苗株高增长速率影响差异极显著(P<0.01)。Duncan多重比较分析结果如表2所示,随着处理天数的增加,株高生长最大增长速率出现在0~7 d,较第2周、第4周呈显著差异(P<0.05),说明红花玉蕊应对短时间全淹胁迫先采取“逃避策略”,株高先快速生长,但随着淹水天数的增加株高增长速率有所抑制。

不同小写字母表示差异显著(P<0.05)。图 1 不同淹水时长对幼苗株高的影响Fig. 1 Effects of different flooding time on plant height

表 1 不同时长及天数对株高增长速率影响的方差分析Table 1 Variance analysis of the effects of different time and days on the growth rate of plant height
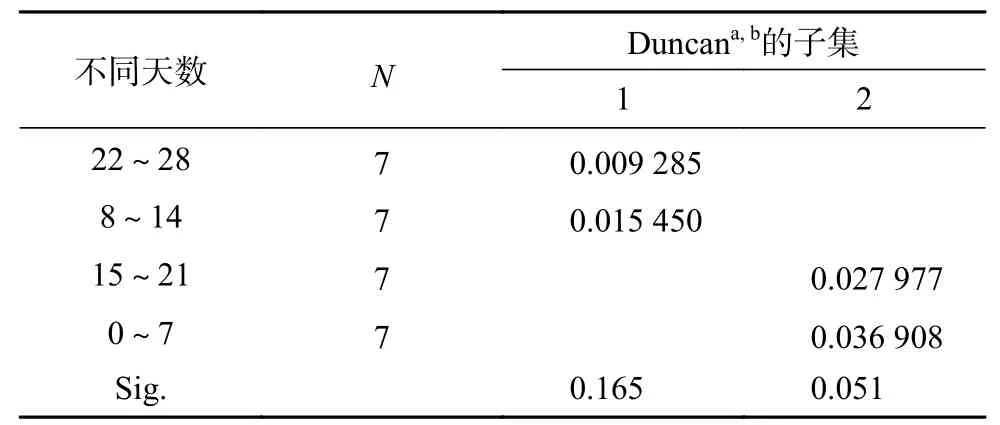
表 2 不同天数对株高增长速率均数的多重比较Table 2 Multiple comparative analysis of the average growth rate of plant height in different days
2.2 不同淹水时长对幼苗叶片数的影响
由图2可知,随着淹水时长的增大,红花玉蕊幼苗叶片总变化量较CK无显著差异,淹水8、12 h/d均出现负增长,且在淹水8 h/d时叶片数出现最低值,较淹水2 h/d的叶片数呈显著差异(P<0.05)。可见淹水8 h/d可能是幼苗叶片适生淹水胁迫的临界时间,淹水10 h/d反而出现正增长可能是与红花玉蕊应对淹水胁迫内在的生理响应系统相关。由表3可知,淡水全淹胁迫不同时间对红花玉蕊幼苗叶片增长速率影响差异不显著,淹水不同天数对叶片增长速率影响差异极显著(P<0.01),由表4可知,叶片生长最大速率出现在8~14 d,较其他处理周数均呈显著差异(P<0.05)。说明淹水天数对幼苗叶片增长速率影响较大,部分叶片变黄脱落是植物采取“静默策略”加以应对。
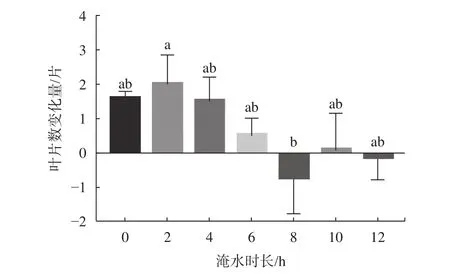
不同小写字母表示差异显著(P<0.05)。图 2 不同淹水时长对幼苗叶片数的影响Fig. 2 Effects of different flooding time on leaf number

表 3 不同时长及天数对叶片增长速率影响的方差分析Table 3 Variance analysis of the effects of different time and days on the growth rate of leaf number
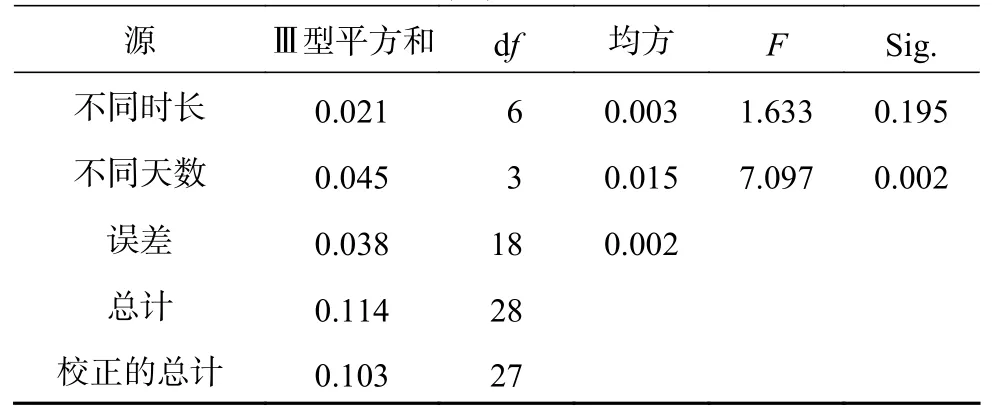
续表 3

表 4 不同天数对叶片增长速率均数的多重比较Table 4 Multiple comparative analysis of the average growth rate of leaf number in different days
2.3 不同淹水时长对红花玉蕊幼苗地径的影响
由图3可知,淹水胁迫期间,不同时长处理的红花玉蕊幼苗地径均有所增大,处理期间地径总增量为0.36~0.58 mm,在淹水8 h/d时地径增量出现最低值,但各处理植株地径较CK均无显著差异,表明不同淹水时长对地径生长影响不大。由表5可知,淹水不同时长对地径增长率影响差异不显著,淹水不同天数对地径增长率影响差异极显著(P<0.01)。多重比较分析结果如表6所示,地径的最大增长速率出现在15~21 d,较其他处理周数均呈显著差异(P<0.05),地径的最大增长速率在处理后第3周出现,地径的快速增长提高了植株的根冠比,利于应对逆境,表明红花玉蕊对淹水胁迫已表现出一定的适应性。
2.4 不同淹水时长对幼苗叶片SOD活性的影响
由图4可知,红花玉蕊全淹时间0~8 h/d时幼苗叶片内SOD活性保持稳定;当淹水时长增至10 h/d时,SOD总酶活性为最大值9.00 U/g,为CK的104.3%,两者之间的差异性极显著(P<0.01),表明大于10 h/d的淹水时长对红花玉蕊产生胁迫作用,SOD活性的升高有助于植物抵抗逆环境。
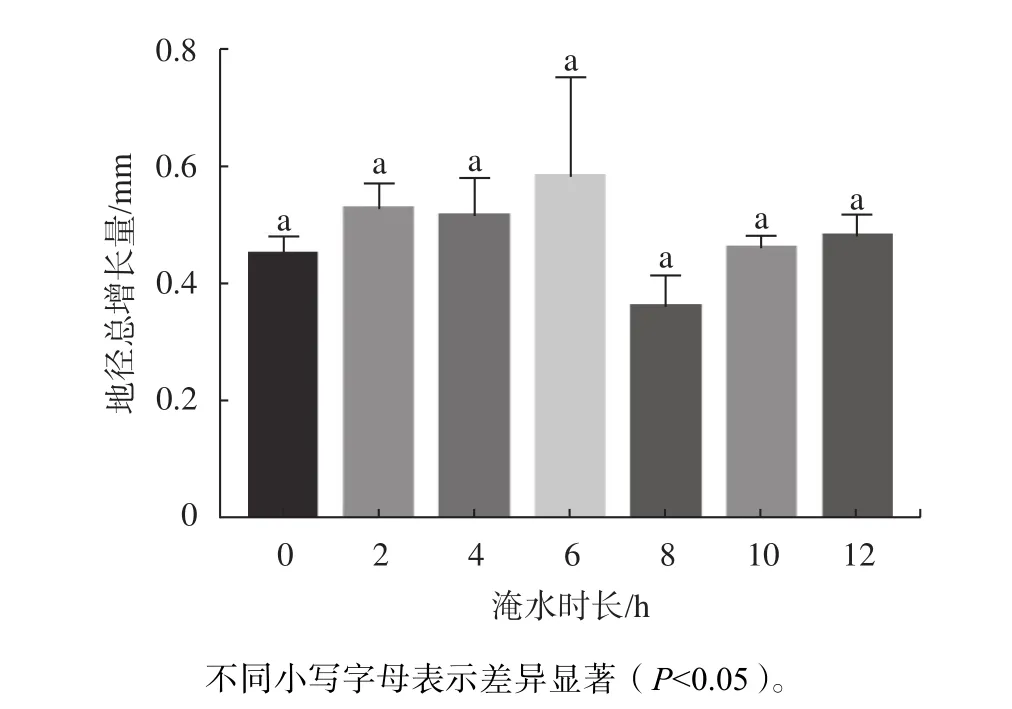
图 3 不同淹水时长对幼苗地径的影响Fig. 3 Effects of different flooding time on ground diameter

表 5 不同时长及天数对地径增长速率影响的方差分析Table 5 Variance analysis of the effects of different time and days on the growth rate of ground diameter
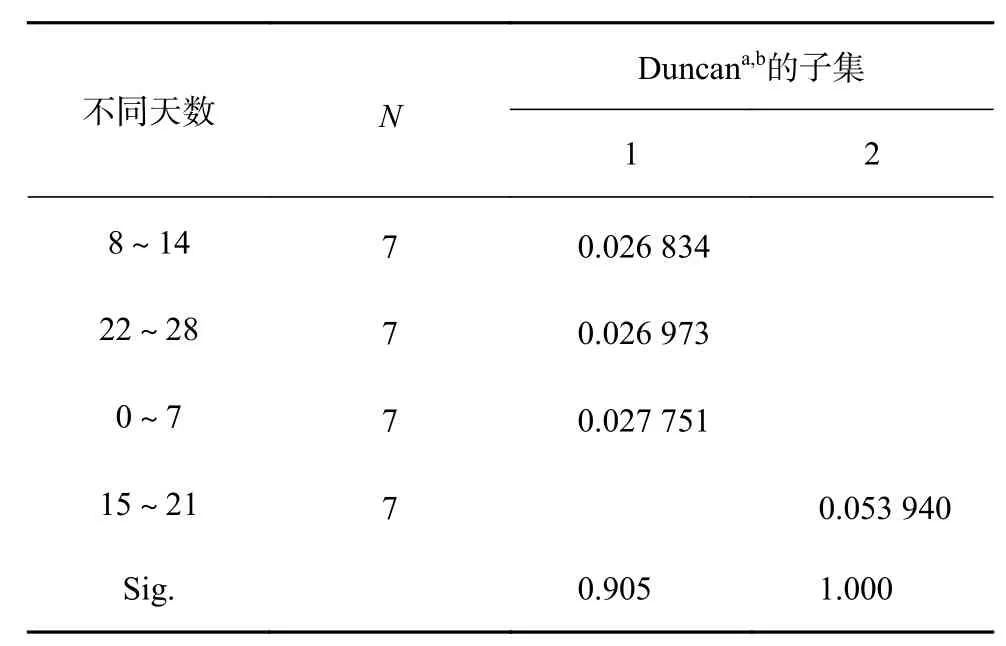
表 6 不同天数对地径增长速率均数的多重比较分析Table 6 Multiple comparative analysis of the average growth rate of ground diameter in different days
2.5 不同淹水时长对幼苗叶片POD活性的影响
如图5可知,POD活性随着淹水时长的增大先增加后减小再增加,但淡水全淹下不同时间处理与对照相比,POD活性差异不显著。当淹水时长是2 h/d时,POD活性时最高的,POD活性为CK的115.0%,但当淹水时长继续增大时POD活性逐渐下降;当淹水时长为10 h/d时,POD活性最低,CK是该处理的127.1%,POD活性最高值与最低值差异显著(P<0.05),结合POD和SOD活性变化得知,较短时间淹水后红花玉蕊主要启动POD以促进植株生长,较长时间淹水胁迫后红花玉蕊主要启动SOD提高植株适应性;当淹水时长大于10 h/d后就同时启动SOD和POD来抵抗逆环境。可见POD和SOD是红花玉蕊淹水胁迫后的重要响应指标。

图 4 不同淹水时长对幼苗叶片SOD活性的影响Fig. 4 Effects of different flooding time on SOD activity in leaves

图 5 不同淹水时长对幼苗叶片POD活性的影响Fig. 5 Effects of different flooding time on POD activity in leaves
2.6 不同淹水时长对幼苗叶片MDA含量的影响
在水分胁迫下,植物体内MDA和活性氧的产生及积累是植物的主要生理响应特征之一[16]。由图6可知,MDA含量变化随着淹水时长的增加呈现平缓的趋势,淹水各时间梯度处理植物叶片MDA含量与CK相比差异不显著,说明淹水0~12 h/d胁迫对红花玉蕊叶片膜脂损害不大,植株显示出具有良好的耐水淹能力。
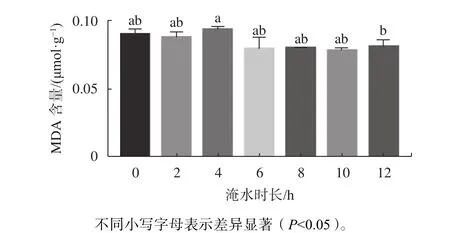
图 6 不同淹水时长对幼苗叶片MDA含量的影响Fig. 6 Effects of different flooding time on MDA content in leaves
2.7 不同淹水时长对幼苗叶片脯氨酸含量的影响
由图7可知,红花玉蕊幼苗叶片脯氨酸含量随着淹浸时间的增加表现出先降低后增加的趋势,最低值与最高值分别出现在淹没6 h/d和12 h/d,两者间呈显著差异(P<0.05)。当淹没时间为4、6、10 h/d时,脯氨酸含量较低,且与CK相比差异性显著(P<0.05),说明模拟半日潮每天淹水小于10 h并没有对植株产生胁迫,而适当的淹水时长反而促进植物生长发育;当淹水时长增加至12 h/d时,脯氨酸含量急剧上升与0、4、6、10 h/d差异显著(P<0.05)。结果表明,大于10 h/d的淹水时长对植物有胁迫作用,此时脯氨酸含量急剧上升是红花玉蕊表现出一定的适应性以及抗淹水胁迫的能力。
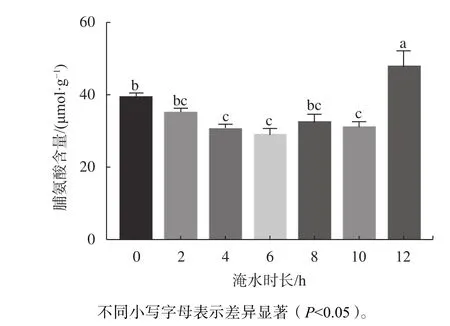
图 7 不同淹水时长对幼苗叶片脯氨酸含量的影响Fig. 7 Effects of different flooding time on proline content in leaves
3 结论与讨论
3.1 红花玉蕊对淹水胁迫的生长响应
环境胁迫下研究植物生长指标的响应情况,是判断植物抗逆性较直观便捷的方法之一。全淹对植物最大的胁迫就是氧气供应不足,导致植物无氧呼吸增加,有机物的利用率下降,加速了植物体内营养物质的消耗,同时,由于水下光照和CO2的不足,植物的光合作用严重受阻[17-18]。缺氧条件下,植物往往通过提高根冠比来适应逆境[19]。叶片是植物重要的同化器官,反映植物生长和发育情况,且对外界环境反应较为敏感,也是植物对外界环境反映较为直接的器官。红花玉蕊在淹水0~6 h/d时叶片数为正增长,淹水8、12 h/d出现负增长,说明较长时间的淹水不利于叶片生长。此外,红花玉蕊幼苗叶片在淹水10 h/d反而出现叶片正增长,这是跟植株在淹水10 h/d时叶片的SOD活性达到了最大值,较CK呈极显著差异相关,即植株在淹水≥10 h/d时启动了SOD保护酶系统响应。
本试验中,不同淹水时长处理对红花玉蕊幼苗株高、地径、叶片的总增量影响差异均不显著,株高和地径均有所增长,叶片有生长也有受胁迫致变黄脱落,3个生长指标的最低增长量均出现在8 h/d,说明淹水时长≥8 h/d是红花玉蕊幼苗生长的胁迫环境,而淹水时长<8 h/d利于植株生长。
另外,不同天数处理对株高、叶片数、地径增长速率的影响均达到极显著水平,说明随着胁迫天数的延长,各处理的生长速率都受到显著影响,这与水分胁迫处理对桃叶杜鹃(Rhododendron annae)生长指标的影响相似[20]。3个生长指标的最大增长速率分别出现在处理前期(0~7 d),处理中期(8~14 d),处理中后期(15~21 d),说明红花玉蕊各营养器官在应对淹水胁迫的响应时间有差异,前期主要集中在株高,这是红花玉蕊采取“逃避策略”应对全淹胁迫,这与凌子然[21]对不同程度水淹中山杉(Taxodium hybrid)及亲本的研究结果相似,他认为半淹中山杉后株高能快速生长也是采取“逃避策略”应对半淹胁迫中后期地径增大较快,且叶片出现负增长,这是植物应对全淹胁迫的策略,前期利用“逃避策略”加快株高叶片数生长,有效进行光合作用,提高有机物的利用效率,后期使用“静默策略”应对全淹胁迫时间的增大,叶片脱落减少能量消耗,同时增大地径,提高根冠比,利于应对胁迫。
3.2 红花玉蕊对淹水胁迫的保护酶系统响应
SOD是植物体内的抗氧化保护酶,清除氧自由基,防止氧自由基破坏细胞的组成、结构和功能保护细胞免受氧化损伤,当植物遇到胁迫时会通过SOD活性来增强抗逆性[22]。POD是植物体内参与活性氧代谢的主要酶,是植物清除H2O2的酶,其活性变化在一定程度上反映了植物体内活性氧的代谢情况[3,23]。研究发现,随着淹水时长的增加,红花玉蕊幼苗叶片SOD酶活性在小于8 h/d时变化趋于平稳,但在全淹10 h/d时达到最高值,且与CK相比差异极显著,而POD活性先增高后降低再增高,在淹水10 h/d时出现最低值,但与CK比无显著性,可见其活性较于稳定,说明红花玉蕊在全淹12 h/d胁迫下,红花玉蕊幼苗主要通过启动SOD、POD,升高酶活性来清除活性氧,从而保护细胞膜。可见,这些酶的表达是红花玉蕊幼苗木对水淹胁迫的适应性响应,这与秋茄、水杉(Metasequoia glyptostroboides)的淹水胁迫和大花紫薇(Lagerstroemia speciosa)、毛萼紫薇(Lagerstroemia balansae)的干旱胁迫时酶系统响应结果一致[24-26]。因此,当红花玉蕊幼苗在淡水模拟潮汐淹浸一定时间的条件下时,适当采用淹水胁迫条件,诱导红花玉蕊幼苗体内SOD、POD的活性增强,使植株生长发育速率增快。
3.3 水淹对细胞膜的影响及其渗透调节物质的响应
植物在逆境中,遭受氧化胁迫发生膜质过氧化而产生MDA[27],其对细胞具有很强的毒性,并且参与破坏生物膜的结构和功能,通常利用其表示细胞膜脂过氧化程度及植物对逆境条件反应的强弱[28-30]。廖宝文等研究发现秋茄叶片MDA含量随着淹水时长的增加而增加,表明受害程度亦随着淹水时长的增加而增加[31]。而本实验淹水处理后叶片的MDA含量随着淹水时长的增加变化不大接近平缓,说明红花玉蕊幼苗在全淹小于12 h/d的逆境条件下受伤害不严重,此结果有可能是因为在淹水胁迫过程中,SOD、POD活性升高,促进了O2的歧化反应使水-水循环正常运行,从而引起O2的明显减少,活性氧的减少不能造成膜脂过氧化,导致MDA含量明显下降。另一可能原因是红花玉蕊在处理期间已经对淹水胁迫做出适应响应,因此全淹小于12 h/d对其叶片膜结构并无伤害。
脯氨酸是植物体内重要的渗透调节剂,淹水胁迫下,植物体内蛋白质合成受抑制,而分解被促进,使脯氨酸含量上升[32],研究发现在淡水全淹胁迫下,红花玉蕊游离脯氨酸含量在淹水12 h/d急剧上升,与0、4、6、10 h/d对比差异显著,说明每天淹水12 h/d对红花玉蕊可能是一种胁迫环境,脯氨酸急剧上升以使植物适应淹水胁迫,调节细胞的渗透势。植物的抗逆性是外界环境刺激产生的保护和抵抗性状,这会使植物脯氨酸含量升高,这与李昳乐等[33]研究水淹胁迫对青竹复叶槭(Acer negundo)叶片中脯氨酸含量的影响变化一致,青竹复叶槭也通过快速增加脯氨酸的含量以增强了植物的抗逆性。同样表明红花玉蕊有强的抗水淹能力。
植物在长期的进化过程中形成自身内在的抗逆机制,以减轻或消除各种逆境胁迫所致的伤害。综合分析本实验结果得知,淡水全淹0~12 h/d对并未影响红花玉蕊植株的生长发育进程,在形态响应上,红花玉蕊应对短时间淹水胁迫先采取“逃避策略”,株高和叶片数增长速率较高,但随着淹水时长的增加,又采取“静默策略”,株高增长缓慢,叶片数部分脱落,地径增长速率增大,以提高根冠比抵抗逆境。在生理响应上,随着淹水时长的增加红花玉蕊幼苗叶片通过改变保护酶活性来抑制MDA形成,降低由淡水全淹胁迫引发的膜脂过氧化对细胞膜系统的破坏,同时通过渗透调节剂脯氨酸在长时间淹水胁迫时急剧上升促使红花玉蕊幼苗迅速适应逆境。红花玉蕊幼苗在淡水全淹环境下淹水胁迫环境的临界时间为8 h/d,最小适生淹水时长范围是0~12 h/d,综上均表明红花玉蕊幼苗具有极强的耐水淹能力。但是否适生大于的12 h/d淹水时长及其在淹水12 h/d后又如何启动淹水逆境的生理适应机制和分子机理还有待后续实验研究。

