乙酸溶剂中空心钛硅分子筛催化甲苯氧化制甲基苯酚研究
彭欣欣,林 民,朱 斌,夏长久,罗一斌,舒兴田
(中国石化石油化工科学研究院石油化工催化材料与反应工程国家重点实验室,北京 100083)
甲基苯酚(甲酚)具有邻甲酚、间甲酚和对甲酚3种异构体,广泛应用于农药、医药、抗氧剂、香料、染料和合成树脂等领域[1]。随着甲酚下游产品的不断开发,我国逐渐成为甲酚消费大国。然而由于国内甲酚产能有限,特别是高品质甲酚产品供给不足,每年仍需从欧洲、美国、日本等发达国家和地区进口来满足。
传统的甲酚生产方法如甲苯磺化碱熔法[2]、异丙基甲苯氧化法[3]、甲苯氯化水解法[4]和甲基苯胺重氮化水解法等,均存在一定的环境污染、设备腐蚀或者操作复杂等问题,而且由于受到工艺本身的限制,难以得到高纯度的产品。
20世纪80年代钛硅分子筛(TS-1)[5]的出现为绿色、温和氧化过程的开发提供了新的思路。TS-1是具有MFI型拓扑结构和骨架钛原子的分子筛,其活性钛物种能活化双氧水(H2O2),并实现烯烃、芳烃、酮、醛、醇等多种有机物分子的选择性氧化。将TS-1/双氧水氧化体系用于甲苯一步氧化制备甲酚,主要副产物为水,可以避免传统方法工艺流程复杂、污染严重的问题。TS-1分子筛发明不久,Esposito等[6]就证明了此种分子筛可用于甲苯温和氧化反应制甲酚,此后陆续有学者[7-8]对该反应进行了研究报道。由于苯环分子尺寸与TS-1分子筛孔道尺寸接近,因而反应分子的扩散对反应结果有明显的影响。另外,由于苯环活化难度大,文献报道的反应效果均不理想。
本研究一方面考虑利用TS-1分子筛重排扩孔得到的空心钛硅分子筛(HTS)为催化剂提高原料和产物分子的扩散性能,另一方面采用乙酸[36%(w),下同]为溶剂,促进甲苯氧化制甲酚的反应,以期得到较优的反应效果。
1 实 验
1.1 试剂与样品
试剂:甲苯,分析纯,北京益利精细化学品有限公司生产;双氧水[30%(w)]、无水甲醇、无水乙醇、丙酮、乙酸[36%(w)]、冰醋酸,分析纯,北京化工厂生产;乙腈,分析纯,北京化学试剂公司生产;二氯甲烷,分析纯,国药集团化学试剂有限公司生产。
样品:HTS,比表面积为429 m2/g,总孔体积为0.29 mL/g,微孔体积为0.178 mL/g,湖南建长股份有限公司生产。
1.2 分子筛表征
采用荷兰Philips公司生产的Panalytical X’pert X射线衍射仪测定晶体结构,测试条件为:Cu靶,Kα辐射,Ni滤波片,管电压为40 kV,管电流为250 mA,闪烁计数器,步宽为0.02°,扫描范围2θ为5°~35°,扫描速率为0.4(°)/min。采用日本JASCO UV-visible 550型紫外分光光度计,通过压片分析样品的钛物种配位状态,扫描范围为190~800 nm。采用日本日立S4800高分辨冷场发射扫描电镜分析样品的形貌尺寸,加速电压为20 kV。采用美国FEI公司生产的Tecnai G2F20S-TWIN型透射电镜分析样品的内部空心结构,加速电压为200 kV。
1.3 反应条件考察
在带有电磁搅拌、加热和冷凝回流的250 mL三口烧瓶中进行甲苯氧化反应。将一定配比的原料置于三口烧瓶中,在400 r/min的转速和一定温度下常压反应一定时间后取样分析。
1.4 产物分析
采用美国Agilent 公司生产的7890/5975C型GC-MS进行产物定性分析。采用美国Agilent公司生产的6890N型气相色谱及外标法进行产物定量分析。气相色谱条件为:HP-5毛细管色谱柱;载气为氮气(80 mL/min);分流进样(分流比为50∶1);进样口温度为280 ℃;检测器温度为300 ℃(FID检测器);升温程序为100 ℃保持2 min,然后以10 ℃/min升到170 ℃,保持5 min。
根据分析结果设定以下考察指标。
①甲苯转化率:
②甲酚选择性:
③产物对邻比:
式中:n0表示反应初始时各反应物的物质的量;n为反应结束时各反应物或产物的物质的量;C甲苯为甲苯转化率;S甲酚为甲酚选择性;Q对位/邻位为反应产物中对甲酚与邻甲酚的摩尔比。
2 结果与讨论
2.1 HTS分子筛物化表征
对HTS分子筛的晶体结构进行表征,结果如图1所示。从图1可以看出,样品在2θ为22°~25°之间存在“五指峰”型特征峰,表明HTS分子筛为MFI结构。另外,在2θ为25.3°附近还存在锐钛矿型钛物种的特征峰,表明HTS分子筛样品中还存在少量的锐钛矿型二氧化钛。
通过紫外可见吸收光谱(UV-Vis)对HTS分子筛的钛物种配位状态进行表征,结果如图2所示。从图2可以看出,HTS分子筛在波长为210 nm和330 nm附近存在明显的吸收峰。其中,波长为210 nm附近的吸收峰一般归属于骨架四配位钛的Ti—O—Si结构中氧的成键2 p电子跃迁到钛的3d空轨道激发的特征吸收光谱,该特征峰可以作为钛进入MFI型分子筛骨架的判据[9-10]。而波长为330 nm处的特征峰一般归属于锐钛矿型钛物种[11]。因此,HTS分子筛中的钛物种主要以四配位状态插入到骨架结构中,另外还有少量钛物种以锐钛矿的形式存在。

图2 HTS分子筛的UV-Vis图谱
对HTS分子筛样品进行扫描电镜和透射电镜形貌分析,结果如图3所示。从图3(a)可以看出,HTS分子筛粒径较均匀,约为300~500 nm,单个分子筛颗粒由多个小晶粒聚集生长呈“黑莓”形貌。从图3(b)可以看出,HTS分子筛晶粒内部存在一定数量的空心结构分布。与TS-1分子筛相比,这些空心结构的存在可有效缩短反应物和产物分子的扩散路径长度,有利于提高扩散性能。

图3 HTS分子筛的SEM和TEM分析结果
2.2 甲苯氧化制甲酚
2.2.1 主副反应分析 通过对不同反应条件下得到的产物进行GC-MS分析发现,产物中主要含有原料甲苯、主产物邻甲酚和对甲酚,副产物甲基对苯醌、苯甲醇和4-甲基邻苯二酚,不含间甲酚。由此可判断在实验条件下主要发生了以下反应。
主反应:

(1)

(2)
主要的副反应:

(3)

(4)

(5)
甲苯在HTS 分子筛的催化作用下主要发生苯环氧化反应生成邻甲酚和对甲酚[如反应式(1)、式(2)所示]。这一结果与苯环发生亲电取代反应时甲基在苯环上的邻、对位定位效应一致。甲基通过斥电子效应,将苯环上原本平均化分布的环上电子云密度变为极性交替分布,从而使得苯环各个位置具有不同的与亲电试剂发生取代反应的能力,最终甲苯氧化主要得到邻甲酚和对甲酚。
本试验条件下可测得的副反应主要是苯环侧链甲基的氧化反应,以及甲酚产物发生进一步氧化反应。其中,甲苯氧化生成苯甲醇的反应主要以自由基机理发生,钛硅分子筛/双氧水催化的苯环氧化反应主要以亲电取代的机理进行,因而苯甲醇的生成量较少;而邻甲酚和对甲酚的进一步氧化反应受到分子筛孔道动力学直径的限制,因而反应几率也较低。
2.2.2 溶剂的影响 不同类型的溶剂由于性质不同,对反应产生不同的影响。添加适宜的溶剂可能有助于改善反应物的溶解状况、促进传质、甚至影响反应发生的路径。对于TS-1而言,质子型溶剂更有利于促进生成“五元环”[12]的钛过氧化氢物种中间体,从而有利于有机物分子的氧化反应(如图4所示)。

图4 TS-1分子筛活性钛物种的产生路径
为了考察不同类型溶剂的影响,在n(溶剂)∶n(甲苯)=10、n(双氧水)∶n(甲苯)=0.5、m(HTS)∶m(甲苯)=1、泡点反应温度(86 ℃)、反应时间1 h的条件下考察几种质子型溶剂和非质子型溶剂下的甲苯氧化反应效果,结果如图5所示。从图5可以看出,在不同溶剂条件下,甲苯的转化率均低于16%,其中以乙酸为溶剂时甲苯转化率最高,达到15.1%,而以乙醇为溶剂时甲苯的转化率最低,仅为0.5%。在其他溶剂的条件下,甲苯的转化率基本变化不大。以二氯甲烷为溶剂时,甲酚的选择性最低,约为71.0%,其他溶剂条件下的甲酚选择性均大于88.0%,以叔丁醇为溶剂时甲酚的选择性最高,达到97.7%,以乙酸为溶剂时甲酚的选择性也可达95.0%以上。总体而言,以乙酸为溶剂时,甲苯氧化反应可以达到较高的转化率和目的产物选择性,表现出较优的反应效果。

图5 不同溶剂下的甲苯氧化反应效果对比■—C甲苯; ■—S甲酚
2.2.3 反应时间的影响 在n(乙酸)∶n(甲苯)=10、n(双氧水)∶n(甲苯)=0.5、m(HTS)∶m(甲苯)=1、泡点反应温度下考察反应时间对甲苯氧化反应的影响,结果如图6所示。由图6可以看出,甲苯转化率随着反应时间的延长逐渐增加,在反应1 h后增幅逐渐变缓,最终稳定在15%左右。甲酚总选择性随反应时间的延长呈先降低后增加的趋势,反应5 min后出现拐点,这可能是由于HTS分子筛表面也存在少量的反应活性中心,甲苯优先在表面发生反应,随着反应的进行,原料分子扩散进入分子筛孔道反应。而甲苯氧化主、副反应是连串反应,生成的目的产物可在表面进一步反应生成副产物,造成目的产物选择性降低。随着扩散进入孔道中的甲苯增多,甲酚的选择性逐渐增加。

图6 反应时间对甲苯氧化反应的影响
Kumar等[13]发现,反应液体系的相态对反应结果有明显的影响。在以水为溶剂的三相反应中,双氧水的有效利用率以及转换频率为共溶剂存在下两相反应结果的两倍以上,对位与邻位产物摩尔比约为1.35;而两相反应时更容易形成邻位产物,对位与邻位产物摩尔比仅为0.41。在乙酸溶剂条件下,反应溶液也为液-液非均相,试验中发现反应产物的对邻比随反应时间的延长逐渐增加,反应5 min后增幅变平缓。在反应初期,产物对邻比小于1,这表明可能在反应初期,邻位产物相对于对位产物更容易生成,随着分子筛孔道内反应增加,由于邻位产物在分子筛孔道内的扩散性能不及对位产物,分子筛体现出择形效应,因而在反应后期表现出产物对邻比大于1,且持续增大。在HTS/双氧水/乙酸反应体系下,甲苯氧化反应速率较快,反应1 h左右基本达到稳定状态。
2.2.4 溶剂含水量的影响 以冰醋酸和水配制不同浓度的冰醋酸溶液,考察溶剂含水量的影响。在n(冰醋酸)∶n(甲苯)=10、n(双氧水)∶n(甲苯)=0.5、m(HTS)∶m(甲苯)=1、泡点反应温度、反应时间1 h的条件下考察n(水)∶n(冰醋酸)对甲苯氧化反应的影响,结果如图7所示。由图7可以看出,甲苯转化率、甲酚总选择性与产物对邻比均随着n(水)∶n(冰醋酸)增加呈先迅速增加后缓慢降低的趋势。当n(水)∶n(冰醋酸)为6∶1时,甲苯转化率与甲酚总选择性达到极大值,而这一配比下的冰醋酸溶液质量分数约为36%。随着溶剂中含水量的增加,冰醋酸的电离能力越来越强,溶液的pH逐渐降低。当n(水)∶n(冰醋酸)≥6∶1时,溶液的pH为2.0~2.5,继续增加溶剂的含水量会导致冰醋酸浓度较低,pH增加。这说明,体系中适宜冰醋酸含量可能有助于甲苯氧化反应的发生,质量分数为36%的冰醋酸溶液有利于甲苯氧化反应的进行。
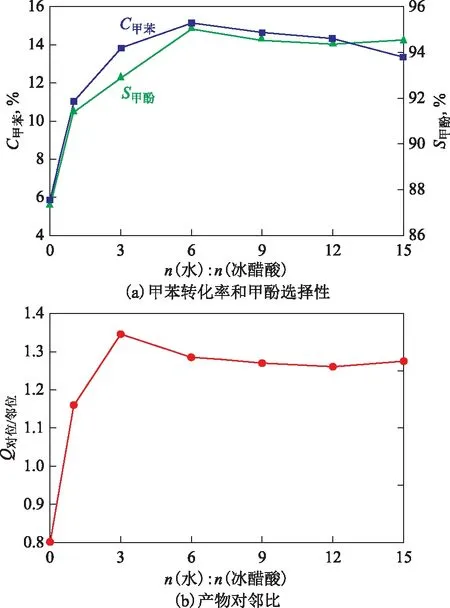
图7 溶剂含水量对甲苯氧化反应的影响
2.2.5 溶剂用量的影响 在n(双氧水)∶n(甲苯)=0.5、m(HTS)∶m(甲苯)=1、泡点反应温度、反应时间1 h的条件下,考察n(乙酸)∶n(甲苯)对甲苯氧化反应的影响,结果如图8所示。由

图8 溶剂用量对甲苯氧化反应的影响
图8可以看出,尽管随着乙酸与甲苯摩尔比的增加,反应物的浓度在不断降低,但甲苯转化率和甲酚总选择性却逐渐增加。这表明,乙酸的存在对甲苯氧化存在促进作用。产物对邻比也随着乙酸溶剂用量的增加而增加。在反应初始阶段,邻甲酚生成速率略快于对甲酚,但对甲酚在分子筛孔道内的扩散速率较快,HTS分子筛孔道存在择形效应,因此,随着反应的进行,对甲酚的选择性逐渐增加。
2.2.6 双氧水用量的影响 在n(乙酸)∶n(甲苯)=10、m(HTS)∶m(甲苯)=1、泡点反应温度、反应时间1 h的条件下,考察n(双氧水)∶n(甲苯)对甲苯氧化反应的影响,结果如图9所示。由图9可以看出,随着双氧水用量的增加,甲苯转化率增加,但当n(双氧水)∶n(甲苯)大于1.0时,增幅变平缓。经过测试发现,反应完毕后的溶液中仅残余微量双氧水,这说明大部分双氧水未能有效氧化甲苯,而双氧水的有效利用率却随双氧水用量降低而增加。苯环由于本身活化难度大,甲苯的氧化过程速率相对较慢,当双氧水浓度与甲苯浓度以及反应活性中心数量相匹配时,双氧水可以得到最大程度的有效利用,多余的双氧水由于来不及参与主反应而发生主产物的深度氧化或者无效分解。因此,随着双氧水用量的增加,目的产物的选择

图9 双氧水用量对甲苯氧化反应的影响
性逐渐降低。产物对邻比的降低可能是由于在分子筛孔道中,对位产物优先生成,同时由于双氧水用量的增加而优先发生深度氧化。
2.2.7 反应温度的影响 在n(乙酸)∶n(甲苯)=10、n(双氧水)∶n(甲苯)=0.5、m(HTS)∶m(甲苯)=1、反应时间1 h的条件下,考察反应温度对甲苯氧化反应的影响,结果如图10所示。从图10可以看出,由于反应温度升高,反应物得到活化,且物料的扩散性能得到增强,因此甲苯转化率、甲酚总选择性与产物对邻比也随之增加。在86 ℃的反应温度下,反应实际是在泡点下进行,反应体系内的传质效果得到强化,因而反应效果相对最优。反应温度为90 ℃的反应是在密闭的容弹反应器中进行,从试验结果可以看出,超过泡点温度后,甲苯转化率和甲酚选择性均出现明显下降。

图10 反应温度对甲苯氧化反应的影响
2.2.8 催化剂用量的影响 在n(乙酸)∶n(甲苯)=10、n(双氧水)∶n(甲苯)=0.5、泡点反应温度、反应时间1 h的条件下,考察m(HTS)∶m(甲苯)对甲苯氧化反应的影响,结果如图11所示。由图11可以看出,随着催化剂用量的增加,甲苯转化率与甲酚总选择性逐渐增加,当m(HTS)∶m(甲苯)大于1时,可能因为反应所需的活性中心数量达到饱和,所以甲苯转化率和甲酚总选择性基本保持稳定,继续增加催化剂用量对提高反应效果意义不明显。在不同催化剂用量下,产物对邻比均大于1,当m(HTS)∶m(甲苯)大于0.4时,产物对邻比约为1.28。

图11 催化剂用量对甲苯氧化反应的影响
3 结 论
(1)溶剂对甲苯氧化反应具有重要影响,以乙酸为溶剂,在HTS分子筛/双氧水体系的催化作用下,甲苯氧化制甲酚的反应效果较优。
(2)甲苯氧化反应初期,主要发生在分子筛的外表面,因此产物的对邻比较低;随着反应的进行,分子筛孔道中的反应增加,择形效应增强,产物对邻比提高。
(3)经过反应条件优化,在n(乙酸)∶n(甲苯)=10、n(双氧水)∶n(甲苯)=0.5、m(HTS)∶m(甲苯)=1、泡点反应温度的条件下反应1 h,甲苯转化率可达15.1%,甲酚总选择性超过95%,产物对邻比约为1.28。

