甲磺酸阿帕替尼片治疗晚期非小细胞肺癌的临床效果分析
金元虹 潘炯伟
[摘要] 目的 探讨晚期非小细胞肺癌患者应用甲磺酸阿帕替尼片治疗的效果。 方法 选取2015年1月~2017年5月于我院行化疗的晚期非小细胞肺癌患者55例,其中应用紫杉醇联合顺铂治疗的27例患者为常规组,加用甲磺酸阿帕替尼治疗的28例患者为干预组。观察患者的治疗效果、相关指标变化、不良反应及生存质量。 结果 干预组患者的ORR、DCR、不良反应总发生率及生存质量均高于常规组(P<0.05);两组患者治疗后的CEA、VEGF和MMP-9水平均低于治疗前(P<0.05),且干预组患者治疗后CEA、VEGF和MMP-9水平更低(P<0.05)。 结论 甲磺酸阿帕替尼治疗晚期非小细胞肺癌的临床效果显著。
[关键词] 肺癌;非小细胞肺癌;晚期;甲磺酸阿帕替尼
[中图分类号] R734.2 [文献标识码] B [文章编号] 1673-9701(2019)10-0112-04
Analysis on the clinical effect of apatinib mesylate tablet in the treatment of advanced non-small cell lung cancer
JIN Yuanhong PAN Jiongwei
Department of Respiratory Medicine,Lishui Peoples Hospital in Zhejiang Province,Lishui 323000,China
[Abstract] Objective To investigate the effect of lapatinib mesylate tablets in the patients with advanced non-small cell lung cancer. Methods A total of 55 patients with advanced non-small cell lung cancer who were given chemoth·erapy in our hospital from January 2015 to May 2017 were selected. Among them, 27 patients who were given paclitaxel combined with cisplatin for treatment were assigned to the conventional group. 28 patients who were given apatinib mesylate for treatment were assigned to the intervention group. The patient's therapeutic effect, related index changes, adverse reactions and quality of life were observed. Results ORR, DCR, total incidence rate of adverse reactions and quality of life in the intervention group were higher than those in the conventional group(P<0.05); the levels of CEA, VEGF and MMP-9 in the two groups after treatment were lower than those before treatment(P<0.05). Patients in the intervention group had lower levels of CEA, VEGF, and MMP-9 after treatment(P<0.05). Conclusion The clinical effect of lapatinib mesylate in the treatment of advanced non-small cell lung cancer is significant.
[Key words] Lung cancer;Non-small cell lung cancer;Advanced;Lapatinib mesylate
肺癌是呼吸系統常见的一种恶性肿瘤,其发病率和死亡率均较高,有统计资料显示,2012年全球新增肺癌患者180万例,在全球新增癌症患者中所占的比例高达13%[1]。肺癌有非小细胞肺癌和小细胞肺癌之分,约80%的患者为非小细胞肺癌,又有腺癌和鳞癌两种亚型,因非小细胞肺癌细胞具有生长和分裂较慢、扩散转移晚的特点,56%以上患者就诊时已出现不同程度的转移[2]。甲磺酸阿帕替尼片是一种抗血管生成的靶向药物,已在胃癌、肝癌等恶性肿瘤治疗中取得了较好的效果,为了研究其在晚期非小细胞肺癌治疗中的效果,现报道如下。
1 资料与方法
1.1一般资料
选取2015年1月~2017年5月于我院行化疗的晚期非小细胞肺癌患者55例,均经细胞学、病理组织学等检查方法确诊,并排除合并慢性基础性疾病干扰治疗效果、肝肾功能异常、合并其他原发性肿瘤、Karnofsky功能状态评分<60分、3分≤PS评分≤5分及终末期耐受性差者。
依治疗方法的不同将55例患者分为常规组(n=27)和干预组(n=28)。常规组男17例,女10例;年龄43~81岁,平均(59.74±5.28)岁;肿瘤直径2.45~5.61 cm,平均(3.17±0.52)cm;病理类型:腺癌16例,鳞癌11例;病理分期:Ⅲ期8例,Ⅳ期19例;组织分化程度:高分化2例、中分化9例和低分化16例。干预组男18例,女10例;年龄42~81岁,平均(59.72±5.31)岁;肿瘤直径2.44~5.63 cm,平均(3.18±0.53)cm;病理类型:腺癌17例,鳞癌11例;病理分期:Ⅲ期9例,Ⅳ期19例;组织分化程度:高分化2例、中分化10例和低分化16例。两组患者一般资料的差异无统计学意义(P>0.05)。
1.2治疗方法
常规组:患者应用紫杉醇注射液(上海创诺制药有限公司生产,国药准字H20103297)联合顺铂注射液(江苏豪森药业股份有限公司生产,国药准字H2004 0813)进行化疗,即75 mg/m2的紫杉醇和25 mg/m2顺铂静脉滴注,连续用药3周为1个疗程,停药1 d再继续下1个疗程的治疗。
干预组:患者加用甲磺酸阿帕替尼片治疗,即850 mg的甲磺酸阿帕替尼片(江苏恒瑞医药股份有限公司生产,国药准字H20140103)口服,每天1次,连续用药3周为1个疗程,停药1 d再继续下1个疗程的治疗。
所有患者均连续进行4个疗程的治疗,同时给予补液、止呕、纠正水电解质紊乱等支持治疗,治疗过程中对患者的呼吸、心率和血压等生命体征进行严格的监测。
1.3 观察指标
观察患者的治疗效果、相关指标[血清癌胚抗原(CEA)、血管内皮生长因子(VEGF)和基质金属蛋白酶-9(MMP-9)]变化、不良反应及生存质量。
所有患者4个疗程的治疗结束后,以实体瘤疗效评价标准(RECISF)[3-4]为依据,对患者的近期疗效进行评估,主要分为4个级别,患者所有病灶均消失为完全缓解(CR)、患者肿瘤体积缩小≥30%为部分缓解(PR)、患者肿瘤体积有缩小但<30%为疾病稳定(SD)、患者肿瘤体积增加≥20%或未见新病灶为疾病进展(PD),CR和PR患者在所有患者中所占的百分比为客观反映率(ORR),CR、PR和SD患者在所有患者中所占的百分比为疾病控制率(DCR)。
治疗前后抽取患者清晨空腹状态下的静脉血5 mL,离心后取上清液,应用放射免疫法检测患者CEA水平,应用酶联免疫法检测患者的VEGF和MMP-9水平。
以美国国立癌症研究院通用毒性标准(NCI-TCT)[5]为依据,对患者的不良反应进行评估。
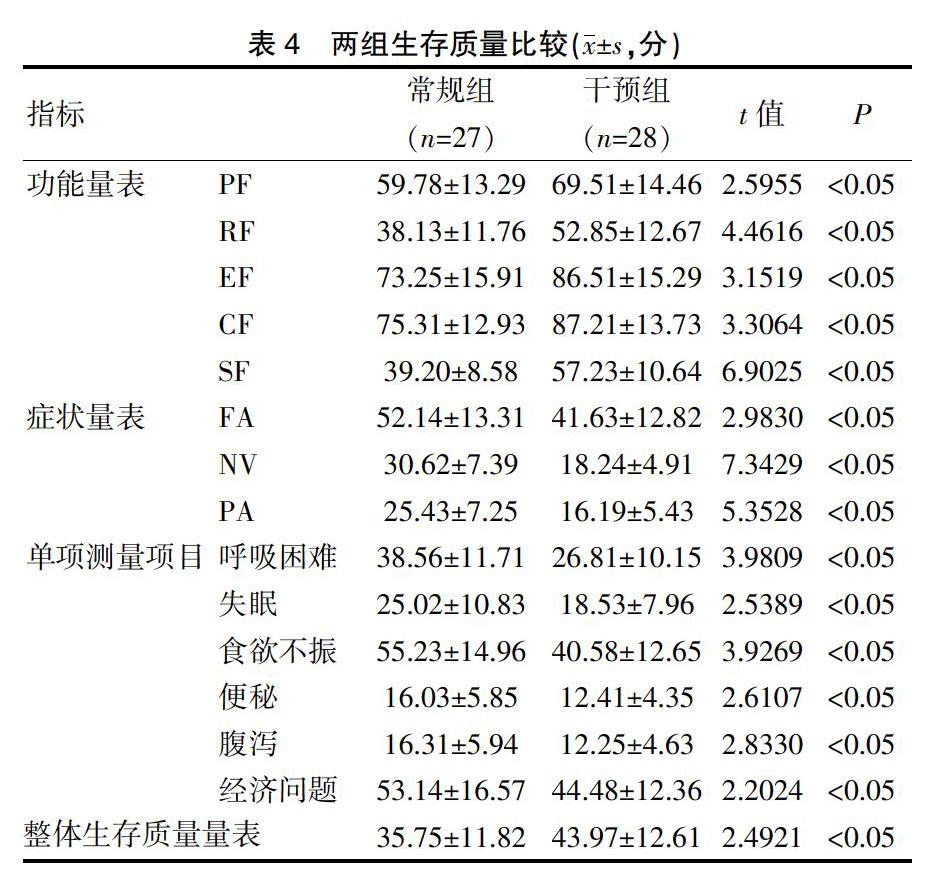
以欧洲癌症研究与治疗组织(E-OR-TC)编制的生存质量核心问卷(QLQ-C30)[6-7]为依据,评估患儿的生存质量,量表主要包括5个功能量表[躯体功能(PF)、角色功能(RF)、情绪功能(EF)、认知功能(CF)和社会功能(SF)]、3个症状量表[疲乏(FA)、恶心呕吐(NV)和疼痛(PA)]、6个单项测量项目和1个整体生存质量量表(GQL),共30个条目,功能量表和整体生存质量量表的评分高低与患儿功能、生存质量的优良呈正相关,症状量表和单项测量项目的评分高低与患儿症状、单项测量项目的严重程度呈正相关。
1.4 统计学方法
研究数据录入SPSS18.0软件数据。计量资料以(x±s)表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组近期疗效比较
干预组患者的ORR和DCR均明显高于常规组(P<0.05)。见表1。
2.2 兩组治疗前后相关指标比较
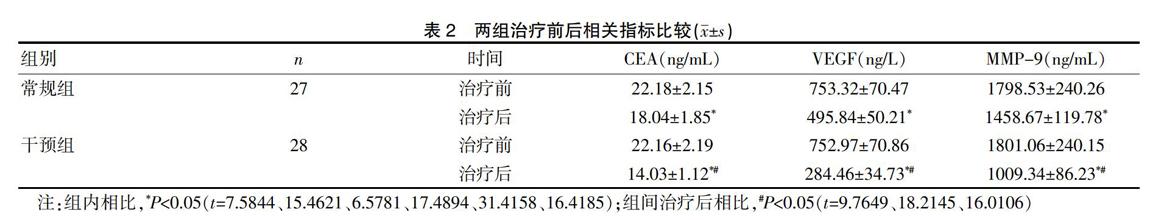
两组患者治疗后的CEA、VEGF和MMP-9水平均明显低于治疗前(P<0.05),且干预组患者治疗后CEA、VEGF和MMP-9水平更低(P<0.05)。见表2。
2.3两组不良反应比较
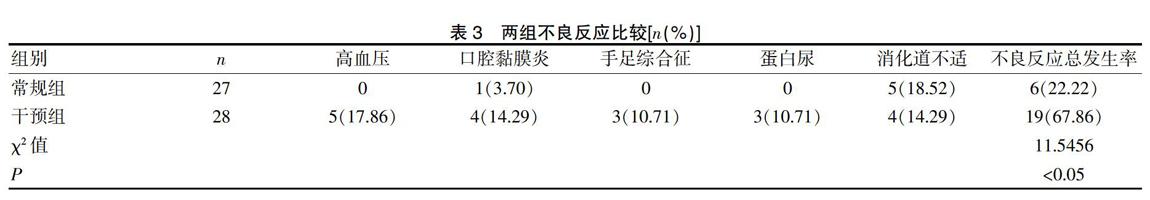
干预组患者的不良反应总发生率明显高于常规组(P<0.05)。见表3。
2.4 两组生存质量比较
干预组患者各功能量表评分和整体生存质量量表评分均明显高于常规组(P<0.05),各症状量表评分和各单项测量项目评分均明显低于常规组(P<0.05)。见表4。
3 讨论
晚期非小细胞肺癌是一种复发率和转移风险均比较高的恶性病变,与遗传、环境及二手烟等因素的关系密切,临床治疗难度较大[8],近年来,一线化疗方案失败后,临床医师和患者多采用2线方案进行治疗,但疗效欠佳,有学者提出了启动三线化疗方案,即靶向治疗,以减缓肺癌进展、改善患者生存质量的措施[9]。
恶性肿瘤组织的生长需要血液提供营养和氧气,其生长过程中产生的一氧化碳、尿酸和肌酐等代谢产物也需要经血液运输排出,若抑制了新生血管的生成,当肿瘤体积达到一定大小,其原有的血液供应不足以满足肿瘤细胞代谢的需要,引起肿瘤组织缺氧,恶性肿瘤组织的生长因营养和氧气的缺乏而受到抑制,进一步引起肿瘤细胞凋亡[10]。
Folkman教授在1971年提出了肿瘤的生长主要依赖于肿瘤血管的形成,并指出未来肿瘤的治疗将以“抗肿瘤血管生成”为主,之后的30多年抗血管生成成为肿瘤治疗领域的热点研究方向[11]。分子靶向治疗是对肿瘤增殖、分化、侵袭和转移等过程相关信号通路的关键靶点进行干扰或阻断,以控制肿瘤的生长。VEGF及其受体(VEGFRs)在多种肿瘤血管内皮及淋巴管中的表达较高,为临床肿瘤靶向治疗提供了新方向,而VEGFR2是VEGF介导的血管生成通路的主要介质[12],故靶向治疗的主要机制是将激活的和游离状态的VEGF浓度降低,将VEGF与VEGFR-2信号间的传导通路切断。
血管的生成在肿瘤的发生、发展、侵袭、转移及复发中具有重要的作用,其中VEGF对血管内皮细胞具有刺激作用,可增加肿瘤微血管的通透性,有助于肿瘤血管的生成,诱发血管内皮细胞的增殖,是血管生成因子中作用最强的一种[13],同时VEGF可激活肿瘤细胞上的酪氨酸激酶受体,血管内皮生长因子受体-1(VEGFR-1)具有正调控单核细胞和巨噬细胞迁移的效果、血管内皮生长因子受体-2(VEGFR-2)主要在淋巴细胞内表达、血管内皮生长因子受体-3(VEGFR-3)主要在血管内皮细胞内表达,在血管发生和生成中起着重要的作用[14]。
甲磺酸阿帕替尼是一种我国自主研发的化学名称为甲磺酸N-[4-(氰基环戊基)苯基]{2-[(4-吡啶甲基)氨基](3-吡啶)}甲酰胺(C25H27N503S)、具有独立产权的新型分子[15],也是分子量为493.58Da的酪氨酸酶抑制剂,对VEGFR-2的选择性较高,明显优于同类小分子酪氨酸激酶抑制剂,且对c-kit和c-src酪氨酸激酶具有轻度抑制作用[16],国家食品药品管理监督总局于2014年10月17日批准其作为国家1.1类新药上市[17],也是全球首个被证实晚期胃癌标准化疗失败后安全有效的小分子抗血管生成的靶向药物[18]。
此外,甲磺酸阿帕替尼可作用于VEFG受体细胞内的ATP结合位点,导致酪氨酸激酶失活,阻断了VEGF与VEGFR-2的结合,减少了VEGF的生成,通过对血管内皮细胞迁移和增殖的抑制作用发挥抑制肿瘤血管的功能,故也被称为VEGFR-2抑制剂[19]。本次研究中,干预组患者加用甲磺酸阿帕替尼治疗后,ORR、DCR及生存质量均高于常规组(P<0.05),CEA、VEGF和MMP-9水平低于常规组(P<0.05)。但本研究中,干预组患者的不良反应总发生率明显高于常规组(P<0.05),说明甲磺酸阿帕替尼的不良反应以高血压、口腔黏膜炎、手足综合征和蛋白尿为主,但均较轻,后三者多是组织中维生素缺乏引起的,治疗中给予大剂量维生素B6可缓解[20];高血压患者给予合理的降压药行2周降压治疗即可控制。
综上所述,甲磺酸阿帕替尼治疗晚期非小细胞肺癌可提高治疗效果和生存质量,降低CEA、VEGF和MMP-9水平,虽不良反应较多,但给予对症处理后可缓解,临床需行进一步,探究甲磺酸阿帕替尼治疗晚期非小细胞肺癌的长期疗效及引起不良反应主要因素,以为临床晚期非小细胞肺癌的靶向治疗提供更为可靠的依据。
[参考文献]
[1] Marquez-Medina Diego,Martin-Marco Antonio,Gatius Caldero Sonia,et al.Little things make big things happen angiolymphatic invasion and tumor necrosis prognosticate the outcome of locally advanced non-small cell lung cancer treated with a prior induction therapy[J].American Journal of Clinical Pathology: Official Publication of American Society of Clinical Pathologists,2015,143(6):889-894.
[2] 于礼建,徐立群,邬晓东,等.参慈胶囊对GP方案治疗晚期非小细胞肺癌的免疫功能及血液学毒性的影响[J].实用医学杂志,2017,33(21):3655-3657.
[3] 杨阳,王凡.厄洛替尼联合贝伐单抗治疗对老年晚期非小细胞肺癌患者免疫功能及血清肿瘤标志物的影响及作用机制[J].中国老年学杂志,2018,38(5):1098-1100.
[4] 罗政军.奈达铂注射剂联合多西他赛注射液治疗老年中晚期非小细胞肺癌的临床研究[J].中国临床药理学杂志,2018,34(3):234-236,243.
[5] 郭运杰,井小会.多西他赛联合阿帕替尼二线治疗非鳞癌小细胞肺癌的有效性及安全性分析[J].中国肿瘤临床,2017,44(11):544-546.
[6] 乔云,惠开元,任岩,等.甲磺酸阿帕替尼联合多靶点抗原肽自体免疫细胞治疗骨与软组织肉瘤的临床实践(小样本报道)[J].中国免疫学杂志,2017,33(1):114-119.
[7] 张欢,周英,李红梅,等.肺癌患者不同治疗阶段心理弹性与生存质量相关性分析[J].中华肿瘤防治杂志,2015, 22(17):1337-1340.
[8] 谭兴平,刘娜娜,付愚,等.吉西他滨联合顺铂对晚期非小细胞肺癌患者生存质量、预后及血清CYFRA21-1、IGF-1水平的影响[J].中国老年学杂志,2018,38(8):1835-1837.
[9] 陈汉锐,田华琴,陈志明,等.康艾注射液联合单药化疗治疗老年晚期非小细胞肺癌的有效性和安全性[J].实用医学杂志,2018,34(2):316-319.
[10] 律慧敏,张梦玮,牛李敏,等.甲磺酸阿帕替尼单药治疗多药耐药晚期乳腺癌临床观察[J].中华医学杂志,2018, 98(16):1246-1249.
[11] 耿海燕.甲磺酸阿帕替尼治疗晚期卵巢癌的疗效评价及其对血清HE4、CA125及CA199的影响[J].中国临床实用医学,2017,8(2):73-74.
[12] Paeng SH,Paeng SH,Park WS,et al.Caffeic acid phenethyl ester reduces the secretion of vascular endothelial growth factor through the inhibition of the ROS, PI3K and HIF-1 alpha signaling pathways in human retinal pigment epithelial cells under hypoxic conditions[J].International Journal of Molecular Medicine,2015,35(5):1419-1426.
[13] Schneider P,Vasse M,Legrand E, et al. Have urinary levels of the angiogenic factors, basic fibroblast growth factor and vascular endothelial growth factor, a prognostic value in childhood acute lymphoblastic leukaemia?[J]. British Journal of Haematology,2015,122(1):163-164.
[14] 于俊岩,郭红亮,田向阳,等.甲磺酸阿帕替尼联合经导管动脉化疗栓塞治疗肝细胞肝癌的Ⅱ期临床试验[J].东南大学学报(医学版),2018,37(1):74-77.
[15] 匡菁,楊家梅.阿帕替尼联合二线化疗方案在晚期甲胎蛋白阳性胃癌中的临床疗效观察[J].实用医学杂志,2018,34(5):810-813.
[16] 成之福,孟令新,丁兆军,等.Survivin、NF-κB、VEGFR-2在食管小细胞癌中的表达及其与甲磺酸阿帕替尼疗效的相关性[J].中国癌症防治杂志,2017,9(3):190-195.
[17] 张从军,孙国平,郝吉庆,等.甲磺酸阿帕替尼三线或三线以上治疗晚期胃腺癌的临床观察[J].临床肿瘤学杂志,2016,21(12):1114-1117.
[18] 殷亮,王荩,黄凤昌,等.甲磺酸阿帕替尼对结肠癌HCT-116细胞增殖的抑制作用及其机制[J].南方医科大学学报,2017,37(3):367-372.
[19] 李威,满文玲,郭欢庆,等.TACE联合甲磺酸阿帕替尼治疗中晚期肝癌的临床研究[J].肿瘤药学,2017,7(1):74-78.
[20] 李小江,姜珊,郭姗琦,等.阿帕替尼联合消岩汤治疗晚期非鳞非小细胞肺癌临床疗效观察[J].中国肿瘤临床,2017,44(14):701-705.

