可控性微结构多孔β-TCP生物陶瓷在颌骨骨缺损修复中的临床应用
曾大顺 喻棣 陈茂冲 陈剑云 贾盛瑞
[摘要] 目的 探討可控性微结构多孔β-TCP生物陶瓷在颌骨骨缺损修复中的临床应用。 方法 选择2016年1月~2017年1月我科收治的颌骨骨缺损病例60例,随机分为实验组和对照组各30例。实验组在术中应用可控性微结构多孔β-TCP生物陶瓷修复颌骨缺损骨腔;对照组未植入任何骨替代材料。研究两组术后骨愈合情况,骨腔感染率及可控性微结构多孔β-TCP生物陶瓷在机体的排斥反应。 结果 实验组术后创口均Ⅰ期愈合,无排斥不良反应发生,术后3月复查CT提示骨愈合良好。对照组术后创口感染6例,病理性骨折1例,分别经抗感染和保守治疗后治愈,术后3月复查CT,缺损骨腔未见明显改变。 结论 可控性微结构多孔β-TCP生物陶瓷作为新型的骨替代材料能有效修复颌骨骨缺损,消除骨缺损死腔,有效降低缺损骨腔引起的感染、病理性骨折等问题,具有较好的应用前景。
[关键词] 可控性微结构多孔β-TCP生物陶瓷;颌骨缺损;修复;骨替代材料
[中图分类号] R783.1 [文献标识码] B [文章编号] 1673-9701(2019)10-0076-03
Clinical application of controllable microstructured porous β-TCP bioceramics in the repair of jawbone defects
ZENG Dashun YU Di CHEN Maochong CHEN Jianyun JIA Shengrui
Department of Oral and Maxillofacial Surgery,the Third Affiliated Hospital of Wenzhou Medical University, Wenzhou 325200,China
[Abstract] Objective To investigate the clinical application of controllable microstructured porous β-TCP bioceramics in the repair of jawbone defects. Methods From January 2016 to January 2017, 60 cases of jawbone defects who were admitted to our department were randomly assigned to the experimental group and the control group, with 30 cases in each group. In the experimental group, the controllable microstructured porous β-TCP bioceramic was used to repair the bone cavity of the jawbone defect. The control group was not implanted with any bone replacement material. The postoperative bone healing, bone cavity infection rate, and the rejection of the controllable microstructured porous β-TCP bioceramics in the body were studied in both groups. Results In the experimental group, the wounds were healed at stage I after surgery, and no rejection and adverse reactions occurred. A review of CT at 3 months after surgery indicated that the bone was healed well. In the control group, there were 6 cases of postoperative wound infection and 1 case of pathological fractures, who were cured after anti-infection and conservative treatment. CT was reexamined 3 months after surgery, and no obvious changes were found in the defected bone cavity. Conclusion Controllable microstructured porous β-TCP bioceramics can effectively repair jawbone defects as a new bone replacement material, eliminate the dead cavity of bone defect, effectively reduce the infection and pathological fractures caused by the defected bone cavity, and has a good application prospect.
[Key words] Controllable microstructured porous β-TCP bioceramics;Jawbone defects;Repair;Bone replacement material\
一直以来,骨缺损的修复是临床和科研的研究热点[1]。在口腔颌面外科领域,口腔颌面部的创伤、肿瘤、感染等造成的上下颌骨缺损在临床工作中十分常见。由于上下颌骨解剖形态特殊性,同时为上下颌牙提供支持,对维持口腔颌面的功能具有重要作用[2,3]。其缺损严重影响患者语音及咀嚼等生理功能,并对患者的心理造成一定的影响[4]。由于正常时口腔内即有大量微生物存在[5],颌骨缺损的修复在临床上变得更为复杂。可控性微结构多孔β-磷酸三钙(β-TCP)生物陶瓷是目前新型的骨替代材料,能有效地解决自体骨骨量不足等诸多问题,快速恢复颌骨的解剖生理外形以及其生物力学功能。我科应用可控性微结构多孔β-TCP生物陶瓷修复颌骨骨缺损,取得满意效果,现报道如下。
1 资料与方法
1.1 一般资料
选择2016年1月~2017年1月我科收治的因颌骨病变术后造成颌骨缺损病例60例,其中上颌骨囊肿33例,下颌骨囊肿20例,下颌骨单囊成釉细胞瘤2例,下颌骨角化囊肿2例,下颌骨慢性骨髓炎3例。其中男36例,女24例,年龄19~68岁,术后造成上下颌骨骨缺损,骨腔缺损直径2.0~5.0 cm不等。以上病例随机分成实验组和对照组。实验组应用上海贝奥路生物材料有限公司的可控性微结构多孔β-TCP生物陶瓷,气孔率>40%,孔径(500±200)μm,力学强度>2 Mpa,对照组未植入任何骨替代材料。两组一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 手术方法
术前行颌面骨CT检查,明确病变范围,评估术后造成的骨缺损范围。所有患者經鼻气管插管全麻下,严格遵守手术操作规范,术中仔细刮除颌骨病变,术中送冰冻病理检查,如为单囊成釉细胞瘤或角化囊肿,需用动力系统磨除部分正常骨质,保证手术成功率。对照组未植入任何骨替代材料,任由血液充盈骨腔。实验组将可控性微结构多孔β-磷酸三钙(β-TCP)生物陶瓷作为骨替代材料置入缺损骨腔内,植入骨腔前将其于生理盐水中浸泡。植入时避免外漏至软组织内,动作轻柔,忌过度挤压影响气孔,充填可控性微结构多孔β-磷酸三钙(β-TCP)生物陶瓷量约为缺损骨腔的4/5,将粘骨膜瓣紧贴创面严密缝合,严防材料与口腔直接沟通。口外弹力绷带包扎,按照国家围手术抗生素应用原则,术前预防使用抗生素,术后24 h停用抗生素。术后监测两组的骨腔感染率,CT平扫观察骨愈合情况以及可控性微结构多孔β-TCP生物陶瓷在骨缺损修复的安全性。
1.3 统计学方法
使用 SPSS 19.0 统计学软件分析数据,计数资料以[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组术后感染率比较
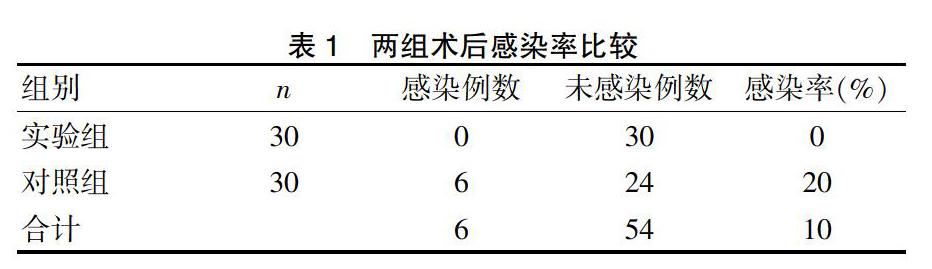
实验组所有病例创口Ⅰ期愈合,无感染及机体排斥反应发生。术后2 d局部肿胀反应逐渐消退,初期观察骨腔缺损处颌骨形态恢复良好,无明显凹陷,充填物无外露。对照组中6例出现骨腔感染,分析原因为骨缺损腔骨腔内血肿继发感染,经抗生素抗感染治疗后治愈,病理性骨折1例,系病灶范围广,术后成骨慢所致。初期口内观察可见缺损处颌骨累及牙槽骨凹陷畸形。两组术后骨腔感染率比较,差异有统计学意义(P<0.05)。见表1。
2.2 两组术后CT断层扫描结果
术后3月实验组行CT断层扫描,实验组30例患者在不同程度上出现在植入的可控性微结构多孔β-TCP生物陶瓷与骨腔缺损边缘之间存在略低密度的影像,骨腔周边的可控性微结构多孔β-TCP生物陶瓷颗粒间存在透射影,与缺损骨腔的骨床有密度移行改变,在影像学上提示有新生骨组织向植入物方向生长。而对照组30例患者术后3月行CT断层扫描,在影像学上骨腔与术前相比未见明显改变,提示成骨效果低于实验组。见封三图1~4。
3 讨论
生物陶瓷是目前学者研究骨替代材料的热点之一[6],它具有良好的生物相容性、生物降解性、骨传导性及抗压性等优点,其结构与天然骨相类似,具有利于细胞增殖,发挥成骨功能等优点[7,8]。与机体组织的反应程度类似羟基磷灰石,但后者降解能力差以及骨再生缓慢等问题很难得到解决[9]。据文献报道,可控性微结构多孔β-TCP 的体内溶解度大约是羟基磷灰石的2倍[10]。临床上用其来修复缺损的骨质,尤其是骨腔缺损,已得到成功验证,其作为骨替代材料已经被许多学者们认同[11,12]。有学者通过基础研究发现可控性微结构多孔β-TCP 可以通过体溶解和吞噬过程逐步被机体部分或完全吸收,最终骨缺损区完全由新生骨组织所取代,完成骨引导再生。其溶解和被吞噬的过程也促进了钙磷的释放,为成骨细胞的成骨过程提供了必要的原材料[13,14]。实验研究发现可控性微结构多孔β-TCP生物陶瓷植入动物骨缺损区1周后,就可以观察到多孔体周围有新生骨生成,气孔内有骨芽细胞侵入[15],为临床提供了理论支持。在口腔颌面外科领域,由于颌骨缺损具有特殊性。首先表现在,人的口腔有适宜各种微生物生存的温度、湿度和营养源如患者的食物唾液等。口腔局部解剖环境复杂,口腔中有各种细菌、真菌、支原体、病毒等存在,这使颌骨术后造成的颌骨缺损修复更具有一定的复杂性。口腔颌面外科临床工作中,对于节段性骨缺损或骨腔缺损,国内学者应用游离髂骨瓣做自体骨移植修复颌骨缺损[16],手术成功案例多,但是存在取骨处的二次创伤和骨量不足的问题以及术后并发症等问题[17]。同时部分患者不能接受自体骨移植带来的损伤。为了克服自体骨骨量不足等限制以及为了解决颌骨骨缺损带来的骨腔感染、病理性骨折以及术后颌骨外形凹陷畸形等问题,应用骨替代材料修复颌骨骨腔缺损的研究日益受到颌面外科医生的重视。目前国内较多开展动物实验研究,国内学者成功应用β-TCP修复犬下颌骨骨缺损[18],修复骨缺损后未出现感染及排斥反应,验证了β-TCP在动物体颌骨骨缺损内应用的安全性、可行性。但在临床实际应用中,极少报道。近期国内文献报道应用β-TCP生物陶瓷修复临床颌骨囊肿术后骨缺损[19],得到成功应用,但临床研究资料甚少。
我科應用可控性微结构多孔β-TCP生物陶瓷作为新型的骨替代材料修复颌骨缺损,实验组和对照组术后均按照国家围手术期抗生素管理要求严格控制使用抗生素,术前口腔清洁,包括局部的预防和治疗措施,控制牙龈炎及牙周炎,尽量创造比较理想的口内环境[20]。实验组在缺损骨腔内植入可控性微结构多孔β-磷酸三钙(β-TCP)生物陶瓷,无感染病例发生,机体无排斥现象,植入物在人体应用安全、可靠。术后3个月行CT检查,缺损骨腔内植入物与骨壁有密度移行的改变,考虑为成骨改变。对照组术后创口有红肿现象,创口可见流脓,分析原因考虑缺损骨腔内血肿易于细菌感染,虽然予抗生素抗感染及局部换药治疗后治愈,但创口二期愈合,增加了患者住院时间和住院费用。术后3个月复查CT,骨腔未见明显变化,骨组织生长缓慢,延迟了后期牙修复治疗,极大地影响了患者的咀嚼生理等功能。可控性微结构多孔β-TCP生物陶瓷作为骨替代材料,价格相对便宜,术中无取自体骨的二次损伤,术后无排斥反应,操作简单,更易于患者接受。在临床上,应用可控性微结构多孔β-TCP生物陶瓷不但有效的克服了自体骨的不足以及颌骨缺损骨腔内血肿带来的骨腔感染风险以及成骨慢、病理性骨折等问题。同时有效恢复了上下颌骨形态,尤其是牙槽骨形态,为以后及时做牙修复治疗提供了有效的骨支持。在无条件使用自体骨或患方拒绝使用自体骨或自体骨数量不足时,可作为理想的骨替代品。但在骨腔破坏骨质过多,无骨板支持的骨缺损或节段性颌骨缺损,使用可控性微结构多孔β-TCP生物陶瓷,仍有一定限制。
综上所述,可控性微结构多孔β-TCP生物陶瓷在有支持骨板的上下颌骨骨腔缺损的修复具有明显优点,其成骨效果显著,具有较好的应用前景。
[参考文献]
[1] Kato H,Matsuoka K,Kato N,Ohkubo T. Mandibular osteomyelitis and fracture successfully treated with vascularised iliac bone graft in a patient with pycnodysostosis[J].Br J Plast Surg,2005,58(2):263-266.
[2] Cordeiro PG,Santamaria E.A classification system and algorithm for reconstruction of maxillectomy and midfacial defects[J].Plast Reconstr Surg,2000,105:2331.
[3] Muzaffar AR,Adams WP,Hartog JM,et al.Maxillary reconstruction functional and aesthetic consideration[J].Plast Reconstr Surg,1999,104:2172
[4] Carlsson GE. Critical review of some dogmas in pro-sthodontics[J].J prosthodontic Res,2009,53(1):3-10.
[5] 邱蔚六,张震康,王大章.口腔颌面外科理论与实践[M].北京:人民卫生出版社,1998:348.
[6] Laruie SW,Kaban LB,Mulliken JB,et al.Donor-site morbidity after harvesting rib and ilia bone[J].Plast Reconstr Surg,1984,73(6):933-938.
[7] Wang QP,Xie H,Yuan LQ,et al.Effect of progesterone on apoptosis of murine MC3T3-E1 osteoblastic cells[J].Amino Acids,2009,36(1):57-63.
[8] Lisignoli G,Zini N,Remiddi G,et al.Basic fibroblast groth factor enhances in vitro mineralization of rat bone marrow stromal cells rrowm on non-woven hyaluronic acid based polymer scaffold[J].Biomaterials,2001,22(15):2095-2105.
[9] Wang M. Developing bioactive composite materials for tissue replacement[J]. Biomaterials,2003,24:2133.
[10] Lee JH,Kim YH. Temporary tongue-lip traction during the initial period ofmandibular distraction in Pierre Robin sequence[J].The Cleft Palate Craniofac J,2009,46(1):19-23.
[11] Beloti MM,Rosa AL. Osteoblast differentiation of human bone marrow cells under continuous and discontinuous treatment with dexamethasone[J].Braz Dent J,2005,16(2):156-161.
[12] Zou L,Zou X,Chen L,et al. Multilineage differentiation of porcine bone marrow stromal cells associated with specific gene expression pattern[J].J Orthop Res,2008,26(1):56-64.
[13] Ara T,Song L,Shimada H,Keshelava N,Russell HV,Metelitsa LS,et al.Interleukin-6 in the bone marrow microenvironment promotes the growth and survivalof neuroblastoma cells[J]. Cancer Res,2009,69(1):329-337.
[14] Yamauchi K,Takahashi T,Funaki K,et al. Periosteal expansion osteogenesis using highly purified beta-tricalcium phosphate blocks:A pilot study in dogs[J]J Periodontol,2008,79(6):999-1005.
[15] Knabe C,Koch C,Rack A,et al. Effect of beta-tricalcium phosphate particles with varying porosity on osteogenesis after sinus floor augmentation in humans[J].Biomaterials,2008,29(14):2249-2258.
[16] 董艷丽,沈国英.游离髂骨瓣用于上颌骨前壁缺损整复的临床研究[J].口腔医学,2007,27(4):222-223.
[17] Seto I,Marukawa E,Asahina I.M andibular reconstnction using a combination graft of rhB M P-2 with bone maowcells expanded in vitro[J].Plast Reeonstr Surg,2006, 117(3):902-908.
[18] 蔡晓清,裴庆国,吕臻,等. BMSC/β-TCP修复犬下颌骨缺损的实验研究[J]. 口腔颌面外科杂志,2010,20(4):249-253.
[19] 王丽丽,复合性生物活性陶瓷在颌骨囊肿缺损修复中的应用[J].黑龙江医药,2012,25(1):140.
[20] 胡敏,许亦权,张立海,等.颌骨缺损骨移植修复后感染分析[J].中华医院感染学杂志,2005,15(3):287-288.

