电子束变性处理对大米蛋白酶解效率的影响
张新霞 陈正行 王 莉
(1.江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2.江南大学食品学院,江苏 无锡 214122)
大米蛋白是最接近FAO/WHO理想模式的植物蛋白,氨基酸组成配比合理,生物价高,过敏性低,是一种优质谷物蛋白[1]。近年研究[2-3]发现,大米蛋白具有重要保健功能,如抗糖尿病、抗胆固醇、抗癌变等。尽管大米蛋白的营养价值和保健价值已被认可,但低溶解性严重限制了其在工业中的应用。酶解改性可以较好地改善大米蛋白的溶解性,使水解产物具有各种生物活性[4]。然而,大米蛋白分子结构紧密,具有高疏水性,对蛋白酶的水解作用有较强的抵抗力,现有资料[5-8]显示,在适宜的酶解条件下,利用不同的蛋白酶水解大米蛋白,其水解度为10%~20%,制约了大米蛋白酶解改性的实际效果,也导致利用酶法制备活性肽时产率较低。因此,寻求大米蛋白高效水解技术是大米蛋白酶法改性的关键。目前很多学者通过物理手段提高酶解效率,如超声波[5,9]、微波[10-11]、超高压[12-13]和电子束辐照[14-15]等。
电子束辐照(electron beam irradiation,EBI)是一种新型的冷处理改性技术,与其他物理手段相比,EBI技术参数简单(只需控制处理剂量),易控制且操作简便,非常适合工业化应用。EBI作用可使蛋白质表面微观结构和空间构象发生改变。林松毅等[14]发现EBI处理剂量为3.24 kGy 时,玉米蛋白的表面完整性明显降低,紧密结构被打开。Lv等[16]研究了EBI变性处理对肌原纤维蛋白的影响,结果表明1 kGy处理剂量使α-螺旋含量下降,但继续增加EBI处理剂量,α-螺旋含量增加。Zhao等[17]发现EBI处理剂量为0~15 kGy时,核桃蛋白的非结晶结构未发生变化,但其表面完整性下降,热稳定性增加。Wang等[18]利用EBI变性技术处理小麦胚芽蛋白,结果发现EBI变性处理能降低小麦胚芽蛋白的表面疏水性,并使其二级结构中的有序α-螺旋结构向无规则卷曲转化。上述研究表明EBI变性处理能改变蛋白结构,但可能会对蛋白酶解产生影响。然而,目前关于EBI技术对蛋白酶解敏感性的报道较少[14],而关于EBI变性处理改变蛋白质酶解效果的构效关系尚未见报道。
大米蛋白是植物蛋白中疏水性最强者,本研究拟以大米蛋白为例,研究新型EBI冷处理蛋白质变性技术,探索其提高酶解性能的作用机理,为植物蛋白的开发利用提供新途径和方法。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
大米蛋白:无锡金农生物科技有限公司;
碱性蛋白酶:13.8万U/g,诺维信(中国)生物技术有限公司;
中性蛋白酶:7.5万U/g,诺维信(中国)生物技术有限公司;
复合蛋白酶:12.5万U/g,诺维信(中国)生物技术有限公司;
胰蛋白酶:8.7万U/g,中国医药集团上海化学试剂公司;
其他试剂:分析纯,国药集团化学试剂有限公司。
1.1.2 仪器与设备
电子加速器:5.0 MeV型,无锡爱邦电子加速器公司;
氨基酸分析液相色谱仪:L-8800型,日本Hitachi公司;
扫描电镜:TM-3030型,日本Hitachi公司;
FTIR光度计:Nicolet iS10型,美国ThermoFisher公司;
荧光光度计:F-7000型,日本Hitachi公司。
1.2 方法
1.2.1 EBI变性处理大米蛋白 将大米蛋白粉装入自封袋(聚乙烯)中,使其铺平后厚度约为1 cm。采用 5.0 MeV 电子加速器进行辐照,束流2 mA,传送速率6 m/min,辐照吸收剂量分别为5,10,20,30,40 kGy,辐照后的样品储存于-20 ℃备用。
1.2.2 大米蛋白酶解 选用4种蛋白酶进行水解,其各自最适酶解条件由商家提供,碱性蛋白酶(pH 8.5,55 ℃),中性蛋白酶(pH 7.0,45 ℃),复合蛋白酶(pH 7.0,50 ℃),胰蛋白酶(pH 8.0,50 ℃)。蛋白酶的最适添加量通过前期预试验确定。将大米蛋白配成5 g/100 mL 悬液,在4种酶的最适酶解条件下搅拌30 min,使其充分分散。然后加入蛋白酶进行水解120 min。蛋白酶与大米蛋白的比例为1∶100(质量比)。通过加入1 mol/L NaOH溶液控制水解过程中溶液pH。反应结束后,沸水浴中灭酶10 min。将水解液pH调至中性后,10 000 r/min离心20 min。上清液冷冻干燥后储存于-20 ℃备用。水解过程中的水解度按式(1)计算:
(1)
式中:
B——消耗的氢氧化钠溶液的体积,mL;
Mb——氢氧化钠溶液的浓度,mol/L;
α——蛋白平均的解离程度,1/α=1.01;
Mp——水解的蛋白质的质量,g;
htot——蛋白质基质肽键总数(对于大米蛋白取7.4 mmol/g)。
1.2.3 多肽产率测定 取步骤1.2.2中离心后上清液,与等体积10 g/100 mL三氯乙酸充分混合,4 ℃静置30 min,8 000 r/min 离心5 min,采用考马斯亮蓝法测定上清液中多肽含量。多肽产率为上清液中多肽的质量与原料蛋白中蛋白的量的比值。
1.2.4 电子扫描电镜 将蛋白样品置于导电胶表面,进行喷金处理。采用扫描电镜观察样品的微观结构。
1.2.5 傅里叶红外光谱(FTIR) 称取2~3 mg粉末样品与适量KBr混合并充分研磨,用压片机压成透明小块,采集FTIR图谱。采集参数为分辨率2 cm-1,扫描范围4 000~400 cm-1,扫描次数32次。利用PeakFit 4.12对FTIR图谱中酰胺Ⅰ区(1 700~1 600 cm-1)进行解析,得到蛋白质4种二级结构含量。
1.2.6 紫外光谱 用0.01 mol/L pH 8.0磷酸缓冲液配制终浓度为2.0 mg/mL蛋白溶液。用紫外—可见分光光度计采集紫外光谱。采集参数为波长范围200~400 nm,步长2.0 nm,速度60 nm/min,以磷酸缓冲液作空白。
1.2.7 内源荧光光谱 用0.01 mol/L pH 8.0磷酸缓冲液配制终浓度为0.04 mg/mL蛋白溶液,采集内源荧光光谱。采集参数为波长范围300~500 nm,激发波长280 nm,步长2.5 nm,速度10 nm/s,以磷酸缓冲液作空白。
1.2.8 数据分析 数据结构形式均为均值±SD。采用SPSS对数据进行分析,采用Duncan多范围测试分析显著性差异(P<0.05)。
2 结果与分析
2.1 EBI变性处理对大米蛋白水解度的影响
由图1可知,EBI处理组大米蛋白初始水解速率快,DH值明显增加,碱性蛋白酶和复合蛋白酶水解过程中,DH值随EBI处理剂量的升高快速增加。而中性蛋白酶和胰蛋白酶水解过程中,随着EBI处理剂量的增加,DH值增长比较缓慢。EBI处理剂量30 kGy,水解120 min时,不同蛋白酶对大米蛋白的水解度均达到最大值,DH值分别增加(19.02±0.37)%(碱性蛋白酶),(16.71±0.48)%(复合蛋白酶),(11.44±0.39)%(中性蛋白酶),(7.26±0.50)%(胰蛋白酶)。在相同的EBI处理剂量下,不同种类的蛋白酶水解的大米蛋白的DH值增加程度不同,与蛋白酶的特异性有关。碱性蛋白酶和中性蛋白酶是非特异性内切酶,酶切位点广泛;复合蛋白酶含有内切蛋白酶和外切肽酶,作用位点较多;胰蛋白酶是特异性内切酶,只作用于Lys和Arg残基中的羧基端,酶切位点有限。当大米蛋白在EBI作用下结构发生改变时,作为底物,与具有广泛特异性的酶的相互作用效果比与限制性内切酶的作用效果要好。
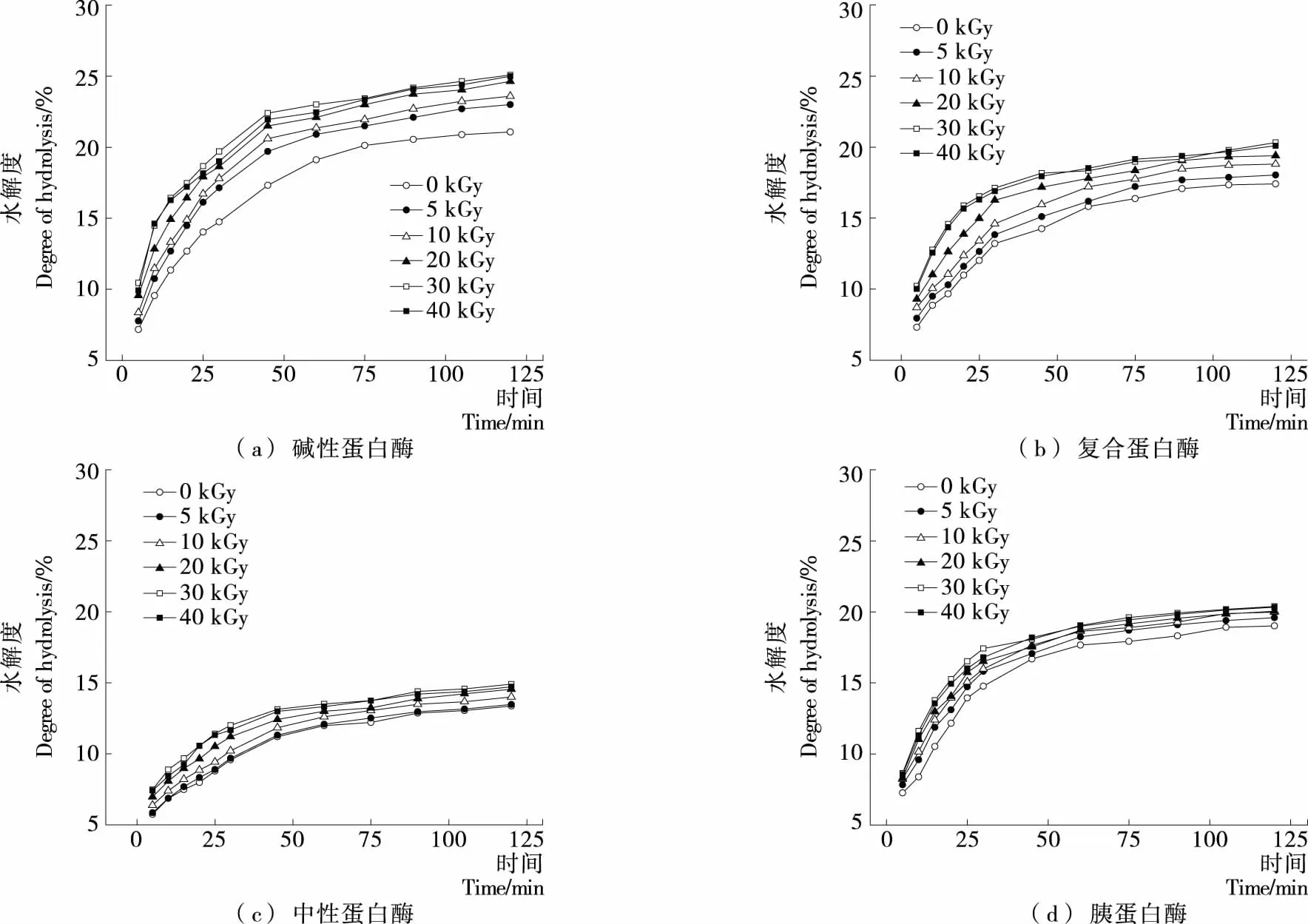
图1 EBI处理剂量和蛋白酶种类对大米蛋白酶解进程的影响Figure 1 Effect of irradiation does and enzyme type on enzymatic hydrolysis of rice protein
2.2 EBI变性处理对多肽产率的影响
由表1可知,采用碱性蛋白酶和复合蛋白酶对大米蛋白进行水解,变性处理剂量为10~30 kGy时,多肽产率随EBI变性处理剂量的增加而显著上升,变性处理剂量为30 kGy时,多肽产率分别增加(13.5±0.29)%和(8.19±0.38)%,当变性处理剂量继续增加时,多肽产率无显著性变化。而采用中性蛋白酶和胰蛋白酶对大米蛋白进行水解,变性处理剂量为5,10 kGy时,多肽产率增加效果不显著(P>0.05),当变性处理剂量为30 kGy时,大米蛋白多肽产率由(53.62±0.89)%(中性蛋白酶)和(64.16±1.21)%(胰蛋白酶)分别显著提高至(55.73±1.05)%和(66.92±1.12)%。
2.3 EBI变性处理对大米蛋白表面形态的影响
由图2可知,大米蛋白的微观表面结构在EBI变性处理前后发生了明显的变化。未经EBI变性处理的大米蛋白为致密的球状结构,表面凹凸不平,存在细小的裂痕和孔隙,但整体完整性较好。经EBI变性处理的大米蛋白表面结构发生了明显的变化。当变性处理剂量增加至30 kGy时,大米蛋白微观表面完整性被破坏,大量小球形颗粒附着于大颗粒上,颗粒变的疏松。可能是EBI产生的能量使蛋白质分子间的氢键和范德华力发生断裂,破坏蛋白质分子间的交联。结果表明,随着EBI变性处理剂量的增加,大米蛋白致密的球状结构被打开,比表面积增加。由于表面的孔隙和小颗粒数量的增加,大米蛋白作为底物在酶解过程中与蛋白酶接触的表面积增加,使其更容易被水解。另外,孔隙结构也有利于蛋白酶进入底物颗粒内部,使肽键断裂,产生更多小分子肽[19]。扫描电镜的结果可从宏观角度解释EBI变性处理提高大米蛋白水解度的原理。
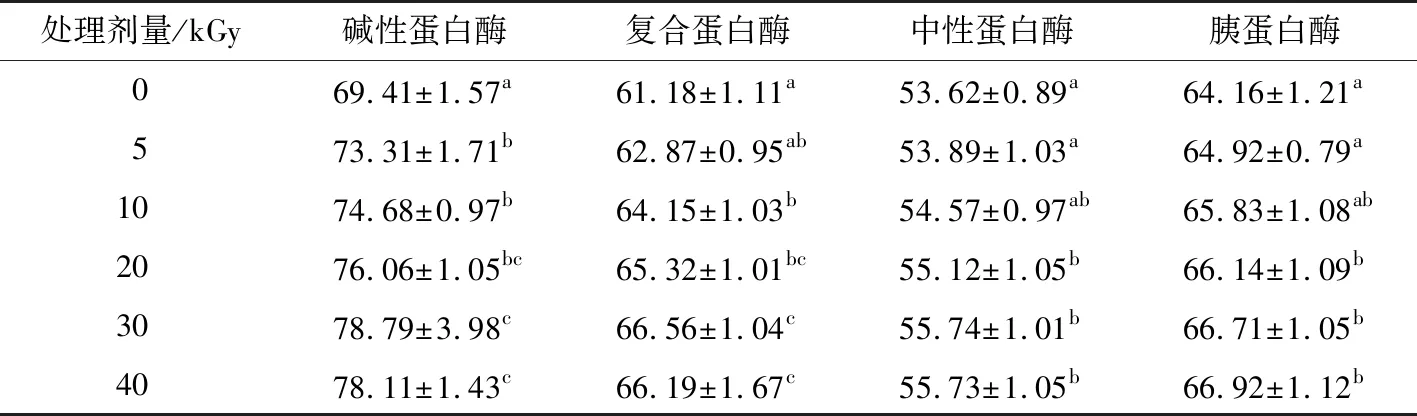
表1 EBI变性处理剂量对不同酶水解产物多肽产率的影响†Table 1 Effect of irradiation does on peptide production of rice protein hydrolysates obtained by various enzyme (n=3) %
† 同列不同字母表示差异显著(P<0.05)。

图2 不同EBI变性处理剂量下大米蛋白扫描电子显微镜图Figure 2 The SEM picture of rice protein pretreated with different irradiation
2.4 EBI变性处理对大米蛋白二级结构的影响
1 700~1 600 cm-1的FTIR图谱为蛋白质二级结构的特征振动峰,通过软件对其结构进行解析(表2)发现,大米蛋白的二级结构含量在EBI变性处理前后发生了明显的变化。当变性处理剂量为5~30 kGy时,EBI变性处理组的大米蛋白的α-螺旋结构含量随变性处理剂量增加显著下降,而β-折叠、β-转角和无规则卷曲结构含量呈上升趋势。EBI变性处理剂量为30 kGy时,α-螺旋结构含量降低了75.73%,而β-折叠、β-转角和无规则卷曲结构的含量分别增加了16.63%,10.70%,24.77%。继续增加变性处理剂量,蛋白质二级结构含量变化不显著(P>0.05)。在蛋白质的4种二级结构中,α-螺旋为致密的有序结构,β-折叠、β-转角属于相对舒展的有序结构,而无规则卷曲则为无序结构[16,20]。EBI变性处理使大米蛋白中致密的α-螺旋结构向相对舒展的β结构以及无序的无规则卷曲结构转化,说明EBI作用破坏了大米蛋白紧密的分子结构,使分子结构变动灵活疏松,更有利于蛋白质与酶接触,从而增强酶解效果。
2.5 紫外可见光光谱分析
由图3(a)可知,EBI作用后,大米蛋白的特征紫外吸收峰随变性处理剂量的增加呈先增强后减弱的趋势,但都远大于变性处理前的水平。说明EBI变性处理使大米蛋白分子展开,内部显色团外露,但当变性处理剂量增加到一定程度时,蛋白质分子出现重新聚集的趋势,导致吸收峰强度下降。200 nm处的特征吸收峰由肽键贡献[21],EBI变性处理后,其吸收强度增加,表明大米蛋白经EBI变性处理后其肽键的空间结构发生改变,更多的肽键暴露到分子表面参与酶解反应。

表2 蛋白二级结构百分含量†Table 2 Results of secondary structure analysis by FTIR (n=3) %
† 同列不同字母表示差异显著(P<0.05)。
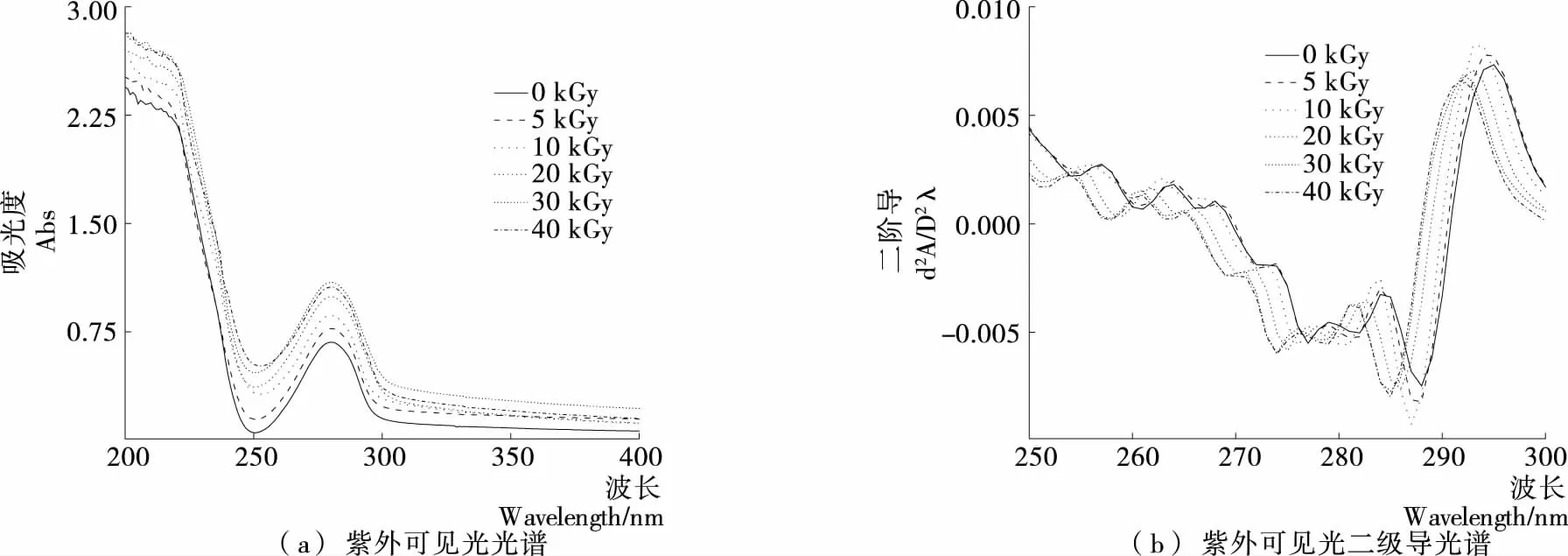
图3 EBI变性处理前后蛋白质的紫外可见光光谱分析Figure 3 The UV spectra of protein with or without EBI treatment
由图3(b)可知,当氨基酸残基所处的微环境疏水性下降时,其紫外吸收二阶导光谱特征峰向低波数迁移(蓝移)[22]。270~282 nm处吸收峰归属于苯丙氨酸、酪氨酸和色氨基酸残基,其λmax从279 nm蓝移至276 nm(30 kGy);288 nm处吸收峰由色氨酸和酪氨酸残基共同贡献,EBI作用使其发生3 nm蓝移(30 kGy)。吸收峰的蓝移说明EBI变性处理后的大米蛋白分子展开,芳香族氨基酸残基所处的微环境更加亲水,与蛋白酶作用的空间位阻下降,从而使酶解效率提高。
2.6 内源荧光光谱分析
由图4可知,随着EBI变性处理剂量的增加,大米蛋白的最大吸收波长向长波长方向移动,在变性处理剂量为30 kGy时,红移程度最大(由335 nm红移至347 nm)。红移程度越大,说明蛋白质空间构象的变化程度越大,蛋白质分子更加伸展[23-24]。结合图3(b)表明大米蛋白的空间构象发生变化,EBI作用使蛋白质分子空间构象展开,内部疏水区的酶切位点暴露,参与酶解反应。
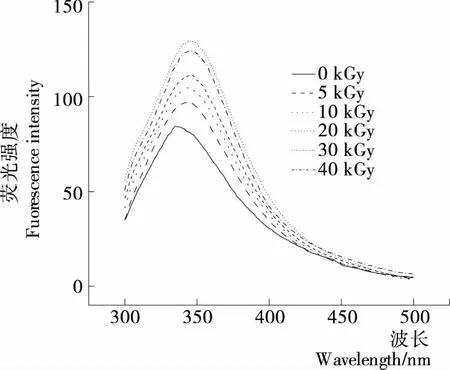
图4 EBI变性处理前后蛋白质的内源荧光光谱Figure 4 The intrinsic fluorescence spectrum of protein with or without EBI treatment
3 结论
EBI变性处理能有效提高大米蛋白的酶解效率和多肽产率。不同蛋白酶对EBI变性大米蛋白的水解度不同:碱性蛋白酶>复合蛋白酶>中性蛋白酶>胰蛋白酶,其中EBI辅助碱性蛋白酶水解效果最好,大米蛋白水解度提高(19.02±0.37)%,多肽产率提高(13.50±0.29)%。表面形态分析表明,EBI变性处理使致密的大米蛋白颗粒变得疏松,颗粒化程度增加;此外,EBI变性技术使蛋白质二级结构发生重组,致密的α-螺旋结构向舒展的β结构和无序结构转化,使蛋白分子灵活性增加;紫外光谱和内源荧光光谱分析表明,EBI变性技术使大米蛋白分子空间构象展开,暴露出更多包埋在内部疏水区域的活性基团。EBI变性处理导致的大米蛋白结构的变化,既增加了蛋白质与酶接触的比表面积,又释放出更多的酶切位点,从而提高了酶解效率。目前,对动植物蛋白进行适度酶解是改善其溶解性、乳化性、起泡性以及抗氧化性等生理活性的重要手段。通过酶法改性能够提高蛋白资源的利用率,提升其资源价值。但随着水解程度的加深,蛋白酶解物的功能性质和生理活性不会无限增加,当水解度达到一定程度时,其功能性质和生理活性出现下降的趋势。本研究发现EBI变性处理能有效提高大米蛋白的酶解效率,提高多肽产率,因此,后续可对经过EBI变性处理的大米蛋白酶解物的功能性质和生理活性进行深入研究,以扩大大米蛋白的利用率。

