利用泛素结合结构域UBAN探针鉴定线性泛素化底物
司 甜,杜现礼,刘 峰,段小涛
(军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
泛素(ubiquitin)是一个含有76 个氨基酸的小分子蛋白,广泛存在于真核生物体内且序列高度保守。泛素化(ubiquitination)修饰由多个泛素链连于底物蛋白上形成,是一种重要的蛋白质翻译后修饰,在真核细胞中发挥着重要的作用。在泛素激活酶(ubiquitin activating enzyme,E1)、泛素缀合酶(ubiquitin-conjugating enzyme,E2)和泛素连接酶(ubiquitin ligase,E3)的作用下,泛素分子发生一系列的酶促反应,使泛素蛋白连接到相应底物上。其具体作用方式如下:在ATP供能的情况下,E1酶司职激活泛素分子的赖氨酸残基,将其转移到E2 酶上,E2 酶携带激活的泛素转交给E3 酶,E3 酶识别底物,并将泛素分子连接到底物上,使底物发生泛素化修饰。目前,已知在人类基因组中存在2种E1酶,数十种E2 酶,1000 多种E3 酶和100 多种去泛素化酶。每种E2酶都可匹配多种E3酶,而E3酶具有与底物结合的选择特异性,该特异性决定了E3酶在泛素化进程中至关重要的作用。
泛素分子主要有8 种不同类型的连接方式,其中7种涉及泛素分子C端的甘氨酸G与泛素链内部赖氨酸K 相连接的方式,包括K6,K11,K27,K29,K33,K48 和K63 位 的多聚泛素化修 饰。K11 和K48的泛素连接方式在蛋白降解过程中发挥重要作用。K63类型的泛素化修饰参与了一系列重要的生物学过程,包括DNA损伤修复、先天免疫及蛋白膜转运等[1-3]。自2006年线性泛素链组装复合体(linear ubiquitin chain assembly complex,LUBAC)被发现以来[4],对由泛素N 端甲硫氨酸的氨基基团与另一泛素甘氨酸Gly76的羧基基团相连形成的第8种连接方式的研究逐步展开。该复合体由血红素氧化铁调节蛋白的泛素连接酶1 长变体(longer isoform of haem-oxidized iron-regulatory protein ubiquitin ligase 1,HOIL-1)相互作用蛋白(HOIL-1-interacting protein,HOIP),HOIL-1和SHANK 相关RH 结构域结合蛋白(Shank associated RH domain interacting,SHARPIN)组成。初步研究发现,在先天性免疫和抑制炎症反应等过程中,这种头尾相连的泛素化修饰发挥着重要作用。由于线性泛素化特殊的连接方式和极低的丰度使其相关蛋白底物的鉴定异常困难。目前已报道的LUBAC复合体底物仅有NF-kB必需调节蛋白(NF-kB essential modulator,NEMO)[5],ISG15连接酶(ISG15 ligase)TRIM25[6],受体互作丝氨酸/苏氨酸蛋白激酶2(receptor-interacting serine/threonine-protein kinase 2,RIPK2)[7],含CARD凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)[8],Fas 相关死亡结构域(Fas associated via death domain,FADD)[9],RIPK1[10]及CASP8 和FADD 样凋亡调节蛋白(CASP8 and FADD like apoptosis regulator,c-FLIP)[11],更多的线性泛素化底物及生物学功能尚待进一步探索。因此,系统筛选和鉴定线性泛素化底物对于充分理解线性泛素化的生物学功能具有重要意义。
目前,针对泛素化底物的富集策略主要包括:在肽段水平针对泛素残基的特异性抗体免疫纯化法、标签富集法以及在蛋白水平基于泛素结合结构域(ubiquitin-binding domains,UBD)的亲和纯化方法。对于抗体富集法,特异性针对线性泛素化的抗体多数不适用于免疫共沉淀富集底物而只适用于潜在线性泛素化底物的确认[12];对于标签富集法,由于泛素链连接方式特殊,在泛素分子N 和(或)C端加上标签能影响泛素的线性连接[13]。鉴于此,在接近生理条件下建立高效富集线性泛素化的底物的方法就显得尤为重要。本研究利用UBAN 结构域构建线性泛素化底物探针[14],结合蛋白质组学捕捉和富集线性泛素化修饰的底物,极大地丰富了线性泛素化底物鉴定领域的研究方法,并为进一步探索线性泛素链的更多生物学功能提供新的思路。
1 材料与方法
1.1 细胞、试剂和仪器
HeLa 细胞和293T 细胞来源于本实验室细胞库;大肠杆菌DH5-α感受态细胞购自博迈德有限公司。带有GST 标签的M1-SUB 质粒及pGEX-6P1-GST-空载体质粒来源于本实验室,其中M1-SUB质粒载体为pGEX-6P1,其UBAN 结构域拷贝自NEMO 的第257~346 残基。5×上样缓冲液购自北京鼎国科技有限公司;GST 琼脂糖微珠购自美国GE Healthcare 公司;Western 蛋白印迹法所用苏氨酸288位磷酸化兔抗人极光激酶A(Aurora kinase A,Aurora-A)单克隆抗体、兔抗人Aurora-A 单克隆抗体、兔抗人NEMO多克隆抗体及小鼠抗人微管蛋白(tubulin)多克隆抗体均购自美国Cell Signaling Technology 公司;线性泛素化抗体由Vishva Dixit博士实验室馈赠;显影试剂购自美国威哥拉斯公司;HOIP,HOIL-1 和SHARPIN 基因干涉序列购自美国Invitrogen 公司,货号分别为HSS123836,HSS145705和HSS149631。恒温金属浴购自金银杏生物科技有限公司;Western蛋白印迹电泳槽和电泳仪购自美国Bio-Rad 公司;细胞孵箱购自日本SANYO公司;常温台式离心机购自美国Sigma 公司;低温台式离心机购自德国Eppendor 公司;细胞操作台购自美国Airtech公司;Q-Exactive高分辨质谱仪购自美国Thermo公司。
1.2 M1-SUB探针制备
把UBAN 连接至大肠杆菌表达载体pGEX-6P1-GST,利用大肠杆菌纯化体系对该质粒进行表达纯化,纯化出带有GST标签的特异性识别线性泛素链的蛋白,称为GST-UBAN蛋白;利用GST标签与GST琼脂糖微珠的亲和性将该GST-UBAN蛋白与GST 琼脂糖微珠连接制成探针,即M1-SUB 探针。利用大肠杆菌纯化体系对pGEX-6P1-GST 载体表达纯化,纯化出GST标签;将GST标签与GST琼脂糖微珠连接制成GST-空载体,即对照探针。具体步骤如下:①菌种活化:将1 mL 菌液接种于100 mL LB 培养基中,30℃,200 rpm 振荡扩大培养,取1 mL 菌液于600 nm 波长处测定吸光度(A600nm)值约0.5 时,即为对数生长期;②加入诱导剂IPTG 至终浓度0.2 mmol·L-1,18℃,180 rpm 振荡诱导过夜;③用50 mL离心管4℃,5 000×g离心5 min收集菌体;④在菌体中加入A液(0.4%NP-40、Tris-HCl pH7.9 40 mmol·L-1、40%丙三醇、EDTA 2 mmol·L-1、MgCl2 1 mmol·L-1、苯扎嘧啶0.3 mol·L-1、PMSF 0.2 mol·L-1、DTT 1 mol·L-1和溶菌酶200 g·L-1)10 mL重悬;⑤冰浴超声破碎细胞,频率约7。超声2~3 s 停2~3 s,15~20 次1 个循环,至菌液清亮;⑥收集菌体裂解液至50 mL离心管中,4℃,11 000×g离心10 min,取上清置另一50 mL 离心管中;⑦平衡GST琼脂糖微珠:把GST琼脂糖微珠80~100 μL加入到1 mL A 液,4℃混悬2~3 min 后4℃,600×g离心5 min,弃上清,重复3 次;⑧把平衡好的GST琼脂糖微珠加入菌体裂解液上清中,4℃旋转约4 h使GST-UBAN 蛋白或者GST 标签结合至GST 琼脂糖微珠上;⑨通过4℃,600×g离心10 min 弃上清,收集混合在菌体裂解液上清中的GST琼脂糖微珠;⑩用A 液1 mL 洗涤GST琼脂糖微珠以去除非特异性结合的蛋白,4℃旋转10 min 后4℃,600×g离心5 min,弃上清,重复洗涤3 次,即制备获得M1-SUB 探针或对照探针;后于该两探针中分别加入A液100 μL,4℃保存。
1.3 M1-SUB探针中GST-UBAN蛋白含量测定
用SDS-PAGE 电泳分离和考马斯亮蓝染色测定M1-SUB 探针中UBAN-GST 蛋白的含量。同时利用梯度稀释法,用蒸馏水把BSA 标准品配制为0.5,1.0,4.0,8.0 和12.0 g·L-1,每浓度取10 μL 上样,作为标准品。
1.4 M1-SUB探针功能验证
以已知底物NEMO为阳性对照,将M1-SUB探针与293T 细胞裂解液共孵育,免疫共沉淀法富集与UBAN 相互作用的底物,验证M1-SUB 探针是否具有结合线性泛素链的能力。①把共转染LUBAC复合体及底物NEMO 的293T 细胞用裂解液(Na2HPO420 mmol·L-1,NaH2PO420 mmol·L-1,1%NP-40,EDTA 2 mmol·L-1,DTT 1 mmol·L-1,NEM 5 mmol·L-1)裂解,4℃冰箱混悬仪上混悬30 min;②超声仪超声裂解细胞直至裂解液清澈;③4℃,12 000×g离心15 min,留上清,弃沉淀;④把M1-SUB 探针加入细胞裂解液中,其中每1 mL裂解液对应加入100 μg 探针,于4 ℃冰箱混悬过夜;⑤用4℃PBS(加0.2%吐温)将免疫共沉淀后的GST 琼脂糖微珠洗6 次,每次1 mL,每次混悬10 min;⑥把1×上样缓冲液加入GST 琼脂糖微珠中,煮样25 min;⑦把上述样品进行SDS-PAGE电泳分离,用Western 蛋白印迹法检测M1-SUB 探针结合线性泛素链的能力。
1.5 用M1-SUB探针免疫共沉淀富集线性泛素化底物
用RIPA裂解液裂解293T细胞,用上述所制备探针与293T 细胞共孵育,富集线性泛素化底物:①根据定量结果取M1-SUB探针加入到RIPA裂解液平衡(1 mL 菌液加80 μL M1-SUB 探针),4℃旋转2~3 min 后4℃,600×g离心5 min,弃上清,重复3 次;②用RIPA 裂解液600 μL 裂解293T 细胞,加入平衡后的M1-SUB探针孵育结合过夜,4℃,600×g离心5 min,弃上清;③RIPA 裂解液洗涤沉淀,4℃旋转10 min 后4℃,600×g离心5 min,2~3 次;④向沉淀中加入1×上样缓冲液30 μL,95℃,20 min 使蛋白变性,进行SPS-PAGE 电泳分离,随后进行质谱鉴定。
1.6 蛋白质质谱鉴定潜在线性泛素化底物
①将上述免疫共沉淀样品进行SDS-PAGE电泳,根据分子质量把全胶之间的样品分为4部分,切下目的条带,置于1.5 mL EP 管中;②每管加入脱色液500 μL 振荡,更换脱色液至脱色完全,用微型台式真空泵吸弃上清;③每管加入75%乙腈200 μL,振荡30 min,用微型台式真空泵吸弃上清;④每管加去离子水500 μL,振荡60 min,用微型台式真空泵吸弃上清,重复1次;⑤每管加入50 mmol·L-1NH4HCO3溶液300 μL,振荡5 min后用微型台式真空泵吸弃上清;⑥每管加入50 mmol·L-1NH4HCO3溶液20 μL,再加入胰酶1~2 μL后破碎凝胶,37℃温育6 h,重复1 次;⑦每管加入100%乙腈200 μL 振荡5 min,吸取上清移至EP 管;剩余凝胶中再加入0.1%甲酸30 μL振荡5 min,再加入100%乙腈200 μL振荡5 min,吸取上清移至同一EP 管中合并,真空干燥;⑧对干燥后的样品进行LC/MS-MS 质谱鉴定,将所获得的质谱数据利用Mascot 中的Swissport人源蛋白质数据库进行搜索,筛查M1-SUB探针与对照探针中差异表达的蛋白质。质谱一级质量的误差是20 ppm,二级质量的误差是0.5 u,利用胰蛋白酶进行酶切,设置2个胰蛋白酶错切位点。
1.7 潜在线性泛素化底物生物功能分析
将质谱鉴定的共计403 个差异蛋白(最少匹配2个肽段且质谱得分>10,P<0.05)通过WEB-based GEne SeT AnaLysis Toolkit 搜索引擎选择人源种属进行生物信息学分析。
1.8 Western蛋白印迹法验证Aurora-A与线性泛素链结合活性
①将Aurora-A与LUBAC复合体共转入293T细胞中,用加入蛋白酶抑制剂PMSF 1 mmol·L-1,10×phosSTOP 和NEM 20 mmol·L-1的RIPA裂解液裂解细胞,4℃冰箱混悬仪上混悬30 min;②超声至细胞裂解液清澈;③4℃,12 000×g离心10 min,弃沉淀;④重复步骤③,取10%细胞裂解液进行Western蛋白印迹实验,以检测免疫共淀沉效果;⑤取90%细胞裂解液加入10%SDS(终浓度为1%),95℃沸水煮5 min;⑥待冷却后,用加入PMSF 1 mmol·L-1和NEM 2 mmol·L-1的RIPA 裂解液将煮后的上清稀释10倍;⑦用HA(氨基酸序列为YPYDVPDYA)微珠与其共孵育过夜,4℃,600×g离心5 min,弃上清;⑧用RIPA 裂解液将沉淀后的微珠洗6 次,每次混悬10 min;⑨弃上清后加入1×上样缓冲液煮样25 min,使微珠上结合的蛋白溶解;⑩取样品进行SDS-PAGE电泳分离,用Western蛋白印迹法检测Aurora-A线性泛素链的结合活性。
1.9 Western蛋白印迹法检测Aurora-A功能
在HeLa细胞中干涉LUBAC复合体三组分,并将细胞同步化至M期,用Western 蛋白印迹法验证线性泛素化调控Aurora-A 在细胞周期中的功能。具体步骤如下:①接种HeLa 细胞至12 孔板内,每孔1×105细胞,待细胞贴壁,细胞密度达到约40%时,将培养基换液成原体系的2/5,将2 μL iMAX和1 μL原浓度为20 μmol·L-1的siRNA分别加入50 μL减血清培养基Opti-MEM中混匀,静置5 min;②把siRNA 体系与iMAX 体系相互混匀后室温静置15 min;③将混合液逐滴均匀加入HeLa细胞中,转染6 h 后更换为1 mL DMEM 完全培养基;④于第1 次干涉24 h 后重复上述步骤,再次干涉;⑤将干涉后的细胞周期同步化至M 期:第2 次干涉6 h 换液,加入浓度为2.5 mmol·L-1的胸苷(thymidine)处理18~24 h。用生理盐水洗细胞5~6 次去除胸苷,加入DMEM 完全培养基培养4~6 h。加入浓度为100 ng·L-1的诺考达唑(nocodazole)处理8~10 h,至M 期;⑥用RIPA 裂解液裂解细胞并收集裂解上清,用Western蛋白印迹法检测Aurora-A磷酸化水平的变化。
2 结果
2.1 M1-SUB探针中GST-UBAN蛋白的含量
把约10 μL M1-SUB探针结合的蛋白溶解在上样缓冲液中,通过SDS-PAGE电泳分离和考马斯亮蓝染色,对该探针所含GST-UBAN蛋白含量进行大致估算。如图1所示,用BSA标准品5,10,40,80和120 μg 做定量对照,分别测定M1-SUB探针和对照探针GST-空载体的蛋白含量,分子质量分别为35 ku和25 ku。根据BSA 标准品蛋白条带大小与目的蛋白条带大小的对比,大致估算得出每10 μL M1-SUB探针含有80 μg蛋白。
2.2 M1-SUB域探针与线性泛素链的结合能力
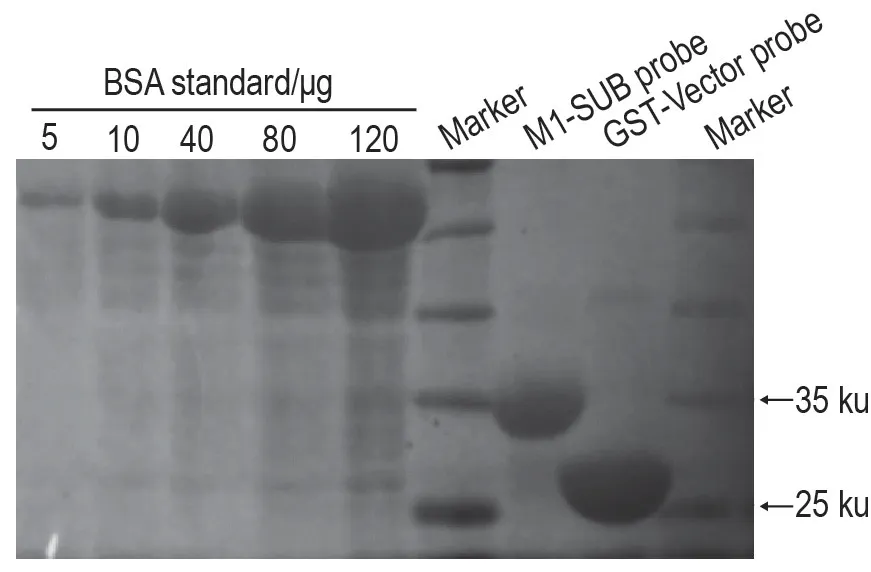
Fig.1 Glutathione S-transferase (GST)-UBAN protein content in M1-SUB probe.The GST-UBAN protein was overexpressed by Escherichia Coli and connected with glutathione agarose beads by GST tag to be used as the UBAN probe(named M1-SUB probe).The GST-UBAN protein content was tested by SDS-PAGE and Coomassie blue staining.
用M1-SUB 探针免疫共沉淀富集样品后分别用线性泛素化和NEMO的抗体显影。如图2所示,左边条带为单独转染NEMO的对照组,在未共转染LUBAC 复合体时,NEMO 上发生线性泛素化修饰的比例和含量极低。右边条带为共转染LUBAC复合体和底物NEMO的实验组。与对照组比较,实验组能够检测到极强的线性泛素化修饰条带和线性泛素化的NEMO条带。该结果表明,用M1-SUB探针能够在293T 中富集线性泛素链连接的NEMO,即该蛋白探针能够与线性泛素链发生极强的相互作用,从而起到底物富集和鉴定的作用。

Fig.2 M1-SUB probe can bind with linear ubiquitination substrate.Using M1-SUB probe,linear ubiquitin chains binding to NEMO were purified from the lysate of 293T cells transfected with the substrate NEMO along with linear ubiquitin chain assembly complex(LUBAC),composed of longer isoform of haem-oxidized iron-regulatory protein ubiquitin ligase 1(HOIL-1)-interacting protein(HOIP),HOIL-1 and Shank-associated RH domain-interacting protein(SHARPIN).IP:immunoprecipitation.
2.3 用M1-SUB探针富集的潜在线性泛素化底物及其生物功能
用M1-SUB 探针在293T 细胞中鉴定线性泛素化潜在底物。实验组利用M1-SUB探针进行潜在底物的富集,对照组为GST-空载体探针,把所富集的底物蛋白进行质谱鉴定,实验组中共鉴定到1816个蛋白,对照组中共鉴定到1860 个蛋白。在实验组中去除对照组所鉴定到的全部非特异性吸附蛋白,共得到403 个差异蛋白。如图3 所示,对富集到的蛋白进行功能聚类分析,在匹配上的402个蛋白中,潜在底物可能参与细胞增殖、蛋白合成和降解等多种生物学过程。在鉴定到的底物中,根据底物蛋白功能的重要性和文献调研结果,选择细胞周期的关键蛋白Aurora-A 进行结合线性泛素链活性鉴定和功能检测。

Fig.3 Functional clustering analysis of M1-SUB probeenriched linear ubiquitination substrates.403 differential proteins were enriched by M1-SUB probe and identified by mass spectrometry.402 proteins were matched and analyzed using a web-based GEne SeT AnaLysis Toolkit search engine.A:biological process categories;B:cellular component categories;C:molecular function categories.
2.4 潜在底物Aurora-A与线性泛素链的结合活性
为进一步验证质谱分析的准确性,在293T 中对该潜在底物Aurora-A 的线性泛素化能力进行验证。图4结果表明,在细胞中转染潜在底物Aurora-A后收集细胞裂解液,用潜在底物上所带标签HA 的抗体微珠与细胞裂解液进行免疫共沉淀反应,随后通过Western蛋白印迹法分离免疫共沉淀后所得样品,用线性泛素化抗体检测。与左边条带只转潜在底物组相比,右边条带在共转染LUBAC复合体和潜在底物Aurora-A后有线性泛素化修饰的特征带型。

Fig.4 Linear ubiquitination can combine with Aurora kinase-A(Aurora-A)in 293T cells.HA-Aurora-A protein was purified from 293T cell lysate by anti-HA affinity gel.The linear ubiquitination level of Aurora-A was higher when co-overexpressed with LUBAC(HOIP,HOIL-1 and SHARPIN)except for Aurora-A.
2.5 线性泛素化对Aurora-A功能的影响
应用siRNA 干涉线性泛素化特异性E3 酶LUBAC复合体3 组分,并利用胸苷和诺考达唑将HeLa细胞周期同步化至M期,分别用LUBAC复合体3组分相应的抗体检测其3组分的干涉效果。如图5 所示,与未干涉LUBAC 复合体的对照组相比,可观察到Aurora-A 288位苏氨酸磷酸化水平升高,而该位点磷酸化表示Aurora-A 本身自激活水平。由此提示,Aurora-A的线性泛素化水平能够影响其自激活能力。

Fig.5 Knockdown of LUBAC increases self-activation of Aurora- A.After knockdown of LUBAC(siHOIP,siHOIL-1 and siSHARPIN)for 48 h in HeLa cells,the cells were then treated with thymidine(2.5 mmol·L-1)for 18-24 h,released with DMEM for 4-6 h,and then added with nocodazole(100 ng·L-1)for 8-10 h to stay in M phase.Then,Western blotting analysis was used to test the phosphorylation level of Aurora-A.
3 讨论
线性泛素化在NF-кB 通路和细胞凋亡中发挥着重要的作用。近年来,随着线性泛素化底物的相继报道,人们对这种特殊泛素链所调控的生物学功能的了解也越来越深入。本研究将NEMO 中特异性识别线性泛素化链的UBAN 结构域制成探针,利用该探针钓取细胞裂解液中潜在底物并通过质谱技术进行鉴定分析。相较于在肽段水平针对泛素残基的特异性抗体免疫纯化法和标签富集法而言,此种方法不受限于线性泛素化抗体苛刻的实验条件,可以直接在细胞裂解液中进行底物蛋白的富集;也不受限于线性泛素链特殊的连接方式,不需要在泛素分子首尾添加标签从而破坏其形成线性泛素链的能力。此种方法简单、高效且易行。
在质谱鉴定到的底物中,Aurora-A是细胞有丝分裂相关丝氨酸/苏氨酸激酶家族的重要成员之一,它在细胞有丝分裂和减数分裂过程中发挥重要的调控作用。此外,Aurora-A能够在288位苏氨酸上发生磷酸化修饰进而促进其激活,并且其自身活性在细胞周期中的G2期至M期转变时达到峰值,而在细胞周期其他时相中其磷酸化活性极低。为验证质谱数据的可靠性,本研究利用Western 蛋白印迹法对Aurora-A上的线性泛素化修饰进行了验证;并在细胞水平首次证实,在有丝分裂M 期,干涉线性泛素化特异E3酶LUBAC 复合体3 组分均能够使Aurora-A 288 位苏氨酸磷酸化水平升高从而激活Aurora-A。本研究扩展了线性泛素化底物及其在细胞周期中新的调控功能,即在细胞有丝分裂中,Aurora-A 的线性泛素化水平能够调控其作为细胞周期相关激酶的活性,但其在细胞周期中的作用机制和其他调控功能有待进一步探索。此外,已知Aurora-A 的活性与多种肿瘤的发生发展密切相关[20],而线性泛素化修饰在其中扮演的角色和功能尚未见文献报道,
综上,本研究应用UBAN 结构域探针在细胞裂解液中对线性泛素化底物进行富集,并以此为基础建立规模化的亲和质谱蛋白质组学技术,分析鉴定到线性泛素化新的底物Aurora-A,这些线索将有利于探索线性泛素化修饰在细胞周期中新的生物学功能,扩展人们对线性泛素化修饰调控细胞功能的认识。

