板蓝根多糖llP-A-1和llP-2作为疫苗佐剂的免疫原性
李海霞*,刘坤璐*,贾培媛,于卫立,武军华,胡 涛,王 勃,王玉霞,单俊杰
(1.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850;2.中国科学院过程工程研究所,北京 100190;3.广西医科大学药学院,广西 南宁 530021)
近年来,国内外学者研究发现,多糖具有免疫佐剂的作用,与疫苗合用可增强疫苗的免疫效果,促进机体特异性免疫和非特异性免疫、细胞免疫和体液免疫反应,克服铝佐剂细胞免疫弱的缺点。多糖自身具有天然、低毒和无药物残留等优点,在安全性方面有良好的优势,已成为疫苗佐剂研究的一个热点[1]。然而,目前报道的多糖佐剂多为粗多糖,理化性质不明确,不仅含多种多糖成分,还含有性质未知的非糖成分。因此存在药效不稳定、难以进行质量控制、作用机制不清和具有免疫原性等缺陷。
本课题组前期研究发现,板蓝根粗多糖具有良好的疫苗佐剂活性[2],继而对该粗多糖进行分离和纯化。同时采用H1N1流感灭活疫苗和乙肝疫苗抗原(亚单位蛋白)进行活性追踪和评价,最终从粗多糖中分离获得2个活性多糖成分,分别为IIP-A-1和IIP-2[3]。IIP-A-1是一种α-(1→4)葡聚糖,分子质量为3 600 u。IIP-2 是一种阿拉伯半乳聚糖,分子质量66 400 u,阿拉伯糖与半乳糖摩尔比为1∶1.5。研究表明,两者对H1N1流感灭活疫苗、乙肝疫苗和狂犬病疫苗均具有显著佐剂作用,佐剂效果明显优于铝佐剂[4-6]。 本研究测定IIP-A-1 和IIP-2 的免疫原性,为其作为疫苗佐剂提供参考。
1 材料与方法
1.1 动物、药物、试剂和仪器
BALB/c 小鼠,雌性,6~8 周龄,18~20 g,购于军事科学院军事医学研究院实验动物中心,许可证编号SCXK-(军)2012-0004;大耳白家兔,雌性,体质量1.8~2.2 kg,北京金牧阳实验动物养殖有限公司,许可证编号SCXX(京)2015-0005。IIP-A-1 和IIP-2 为军事科学院军事医学研究院毒物药物研究所天然药物化学研究室制备[3]。辣根过氧化物酶(HRP)标记山羊抗小鼠IgG、山羊抗兔IgG(H+L)和N-四甲基联苯胺购自北京中杉金桥生物技术公司;甲型H1N1流感病毒裂解液由北京科兴生物制品有限公司生产;口蹄疫病毒灭活疫苗(Aftosa)由兰州兽医研究所提供(生产批号:H150420J);乙肝病毒重组亚单位蛋白乙肝表面抗原(hepatitis B surface antigen,HbsAg)由大连汉信生物制药有限公司生产;钥孔血蓝蛋白(keyhole limpet hemocyanin,KLH)、牛血清白蛋白(bovine serum albumin,BSA)和抗小鼠亚类抗体购自美国Sigma公司;脱脂奶粉为伊利集团产品;其余试剂均购自国药集团化学试剂有限公司,均为分析纯。酶标仪(美国Thermo Scientific VARIOSKAN FLASH);洗板机(美国Thermo Scientific WELLWASH VERSA)。
1.2 KLH-llP-A-1,KLH-llP-2,BSA-llP-A-1和BSA-llP-2的制备
称取IIP-A-1 2 mg,溶于20 mmol·L-1醋酸-醋酸钠缓冲液(pH 5.8)。然后加入高碘酸钠将IIP-A-1的邻位羟基氧化成醛基,IIP-A-1和高碘酸钠的终浓度分别为2 g·L-1和20 mmol·L-1。室温下避光反应20 min 后,加入适量的乙二醇终止反应。用磷酸盐缓冲液(pH 7.4)20 mmol·L-1对反应液进行透析,随后加入KLH 2 mg和氰基硼氢化钠1 mg,于4℃反应过夜,得到多糖-蛋白偶联物KLH-IIP-A-1。偶联物KLH-IIP-2,BSA-IIP-A-1 和BSA-IIP-2 的制备方法与KLH-IIP-A-1相同。
1.3 KLH-llP-A-1和KLH-llP-2联用弗氏佐剂免疫方案和抗体检测
大耳白家兔9只,分为3组,每组3只,分别皮内注射抗原KLH-IIP-A-1 和KLH-IIP-2,剂量为每只300 μg。初次免疫配伍弗氏完全佐剂,免疫后28 d进行加强免疫,加强免疫配伍弗氏不完全佐剂。佐剂与抗原按1∶1 比例(m/m)混合充分乳化,皮内多点注射。分别在免疫后14 d耳缘静脉取血,分离血清,酶联反应板分别包被KLH 和BSA 及检测抗原BSA-IIP-A-1和BSA-IIP-2 5 mg·L-1,用ELISA检测KLH,IIP-A-1和IIP-2抗体水平。
1.4 llP-A-1和llP-2单独免疫方案和抗体检测
BALB/c 小鼠18 只,分为3 组,每组6 只。分别im给予生理盐水、IIP-A-1和IIP-2。IIP-A-1和IIP-2的剂量为每只小鼠500 μg,生理盐水为0.1 mL。共免疫3 次,每次间隔28 d。每次免疫后14 d 剪尾采血,分离血清。用BSA-IIP-A-1或BSA-IIP-2 5 mg·L-1包被酶联反应板,用ELISA测定血清IIP-A-1和IIP-2抗体水平。
1.5 llP-A-1或llP-2作为HBsAg,H1N1和Aftosa疫苗佐剂的免疫方案和抗体检测
参考文献[7],以IIP-A-1 作为Aftosa 疫苗佐剂;以IIP-2 分别作为Aftosa,H1N1 和HBsAg 疫苗佐剂,im 免疫。与H1N1 疫苗配伍共免疫3 次,与HBsAg或Aftosa疫苗配伍共免疫2次,每次间隔均为28 d。Aftosa 免疫剂量为每只小鼠2 μg,H1N1为每只小鼠3 μg,HBsAg为每只小鼠2 μg。IIP-A-1和IIP-2 的剂量均为每只小鼠200 μg。免疫后14 d,小鼠断尾取血50 μL,血清用吐温-20 的磷酸盐缓冲液(PBST,pH 7.4)稀释。分别采用KLH,KLH-IIP-2 或KLH- IIP-A-1(2 mg·L-1)包被酶联反应板,ELISA 法检测免疫小鼠血清中抗IIP-A-1 或IIP-2抗体水平。
1.6 ELlSA检测血清抗体水平
小鼠或家兔血清用含0.1% PBST 等比稀释。相应的检测抗原均采用抗原包被液(0.05 mol·L-1碳酸盐缓冲液,pH 9.6)稀释至终浓度5 mg·L-1包被96 孔板,每孔100 μL,4℃包被过夜。包被酶联反应板用PBST 洗板3 次,每孔加入5%脱脂奶粉(PBS 配制)250 μL,37℃封闭1 h。后用PBST 洗涤3 次,加入稀释的小鼠或家兔血清每孔100 μL,37℃孵育1 h。PBST 洗涤3 次,然后加入HRP 标记的山羊抗兔IgG 或HRP 标记的山羊抗小鼠IgG抗体(PBST 1∶1000 稀释),每孔100 μL,37℃孵育1 h。弃二抗,PBST 洗涤5 次,再加入TMB 底物显色液,每孔100 μL,室温避光显色15 min。每孔加入50 μL 硫酸溶液0.2 mol·L-1终止显色,酶标仪测定450 nm 波长处的吸光度(A450nm)值。免疫组A450nm≥生理盐水对照组A450nm2 倍的结果为阳性[8]。
2 结果
2.1 KLH-llP-A-1和KLH-llP-2配伍弗氏佐剂免疫家兔血清KLH,llP-A-1和llP-2特异性抗体水平
KLH-IIP-A-1和KLH-IIP-2分别作为免疫抗原,免疫家兔2 次后,ELISA 检测家兔血清中抗KLH,IIP-A-1 和IIP-2 抗体水平(图1)。结果表明,①以KLH包被酶联反应板,检测出家兔血清中产生高滴度水平的抗KLH 抗体,滴度≥1∶50 000(图1A1 和B1);②以BSA 包被酶联反应板,未检测出血清中抗BSA 抗体(图1A2 和B2);③以BSA-IIP-A-1 或BSA-IIP-2 包被酶联反应板,检测发现血清中能产生较高滴度的抗IIP-A-1 或抗IIP-2 的多糖抗体,抗IIP-A-1抗体滴度≥1∶20 000(图1A3),抗IIP-2抗体滴度≥1∶100 000(图1B3)。
2.2 llP-A-1和llP-2单独免疫小鼠血清抗llP-A-1和llP-2抗体水平
小鼠分别肌注生理盐水、IIP-A-1 和IIP-2 进行免疫,间隔28 d 免疫1 次,共免疫3 次,免疫剂量均为每只小鼠500 μg。免疫后14 d采用ELISA方法,酶联板包被BSA-IIP-A-1或BSA-IIP-2 5 mg·L-1,测定1∶200稀释的小鼠血清IgG1和IgM(图2和图3)。结果表明,①3 次免疫后血清抗IIP-A-1 IgG1 和IgM 抗体均为阴性(图2A 和C);②初次免疫后14 d,小鼠血清中未检测出抗IIP-2 的IgG1抗体,第2次和第3次免疫后血清中IgG1抗体信号显著提高(图2B)。IIP-2初次免疫和加强免疫后IgM 抗体阴性,检测信号低于生理盐水对照组(图2D)。表明IIP-A-1单独免疫3次未显示出免疫原性,而IIP-2加强免疫后产生较高水平的抗IIP-2 IgG1抗体,具有一定的免疫原性。
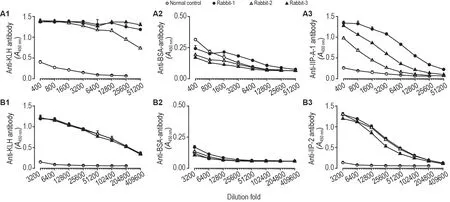
Fig.1 Serum antibody titers of rabbits immunized with Keyhole limpet hemocyanin-Isatis indigotica polysaccharides(KLH-llP-A-1)(A1,A2 and A3)and KLH-llP-2(B1,B2 and B3)plus Freund adjuvant at 14 d after second immunizations detected by ELlSA.Each rabbit was given KLH-IIP-A-1 or KLH-IIP-2 intradermally at the dose of 300 μg,and 28 d after the first immunization,the booster 300 μg was given.96-well EIA plates were coated with KLH,BSA,BSA-IIP-A-1 and BSA-IIP-2 at a concentration of 5 mg·L-1,respectively.A1 and B1:anti-KLH antibody in serum of rabbits immunized with KLH-IIP-A-1 and KLH-IIP-2,respectively;A2 and B2:anti-BSA antibody in serum of immunized rabbits;A3 and B3:anti-IIP-A-1 or anti-IIP-2 antibodies in serum of immunized rabbits.The titer of each serum sample from immunized rabbits was respectively measured by ELISA.±s,n=3.
图3结果显示,IIP-2注射后小鼠血清中出现抗IIP-2 IgG1抗体,抗小鼠IgG1亚类抗体与BSA 有一定的反应本底。因此,本研究包被KLH-IIP-2 测定了3次免疫后小鼠血清IgG1滴度(T)。与生理盐水对照组比较,IIP-2 3次免疫后LgT为3.05±0.16,提示IIP-2免疫后小鼠确实产生了抗IIP-2的抗体。

Fig.3 Serum lgG antibody titers of mice immunized intramuscularly with llP-2 three times detected by ELlSA.Each mouse was im given IIP-2 500 μg.Four weeks and eight weeks after the first immunization,the booster 500 μg was im given.Anti-IIP-2 IgG1 in mouse serum diluted with PBST was detected at 14 d after the third immunization by ELISA.96-well EIA plates were respectively coated with KLH-IIP-2 or KLH,200 ng per well.±s,n=6.
2.3 llP-A-1或llP-2多糖作为Aftosa疫苗佐剂免疫小鼠血清抗llP-A-1或llP-2抗体水平
IIP-A-1 或IIP-2(每只200 μg)与Aftosa 疫苗(每只2 μg)肌注免疫小鼠2次。第2次免疫后14 d,采用KLH,KLH-IIP-A-1和KLH-IIP-2 2 mg·L-1包被酶联反应板检测血清多糖抗体。ELISA 结果表明,2 次免疫后小鼠血清中未检测到抗IIP-A-1 或IIP-2的IgM抗体(图略)。小鼠免疫2次后,血清未检测到抗IIP-A-1 的IgG1抗体(图4C),A450nm值与生理盐水对照组(图4A)和Aftosa无佐剂对照组(图4B)无明显差异,但在血清中检测到抗IIP-2的IgG1(图4D)。
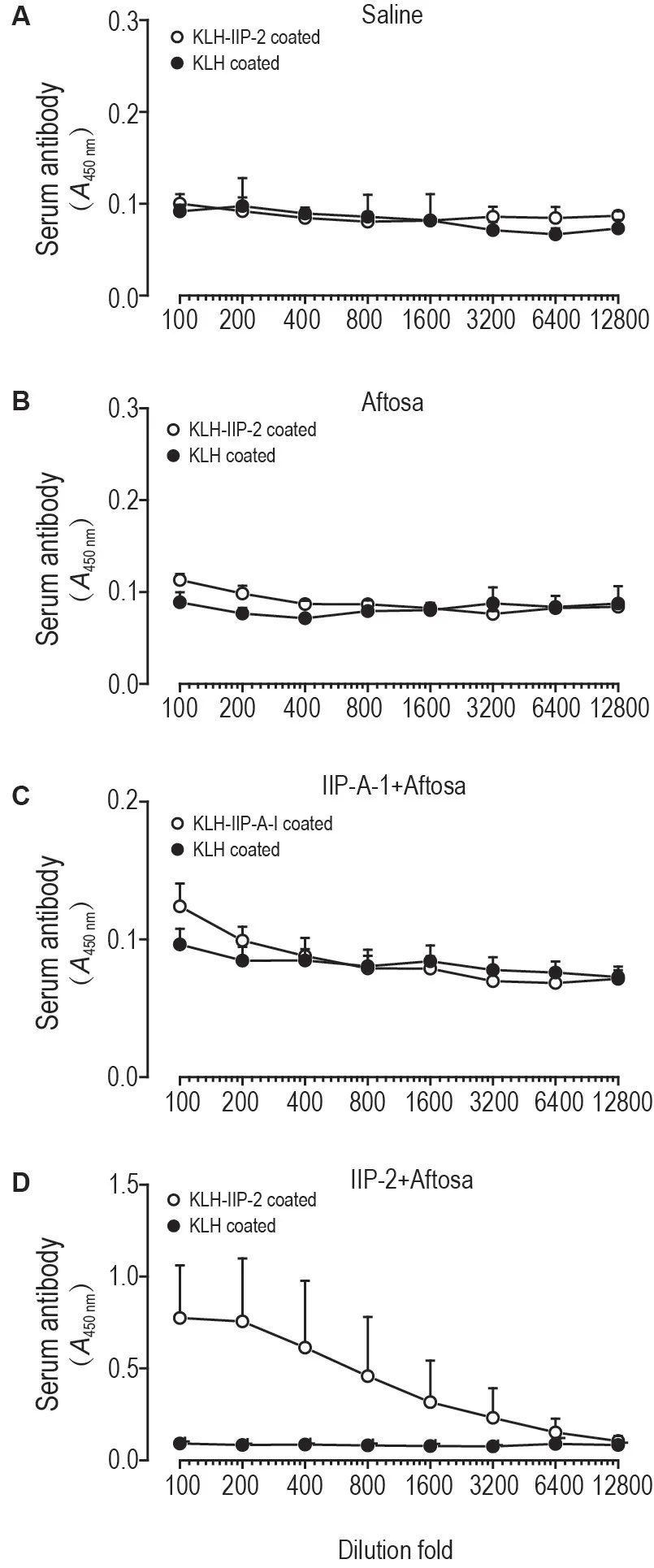
Fig.4 Serum anti-polysaccharides antibody of mice immunized intramuscularly with Aftosa with llP-A-1 or llP-2 for two times detected by ELlSA.Each mouse was im given Aftosa(2 μg per mice)and IIP-A-1 or IIP-2(200 μg per mice).Four weeks after the first immunization,the booster again.Anti-IIP-A-1 or anti-IIP-2 IgG1 in mouse serum was detected at 14 d after the second immunization by ELISA.96-well EIA plates were respectively coated with KLH-IIP-2 or KLH 2 mg·L-1.±s,n=6.
2.4 llP-2作为H1N1佐剂免疫小鼠血清抗llP-2抗体水平
H1N1 裂解病毒疫苗(每只3 μg)与IIP-2(每只200 μg)肌注免疫小鼠3次。在第3次免疫后14 d,采用KLH和KLH-IIP-2 2 mg·L-1包被酶联反应板检测血清抗IIP-2抗体。ELISA检测结果表明,小鼠免疫3 次后,血清未检测到抗IIP-2 的IgM 抗体(图略),免疫小鼠血清中检测到抗IIP-2的IgG1抗体(图5)。

Fig.5 Serum anti-llP- 2 lgG1 of mice immunized intramuscularly plus H1N1 with llP- 2 for two times detected by ELlSA.Each mouse was im given H1N1(3 μg)and IIP-2 200 μg.Four weeks after the previous immunization,the booster again.Anti-IIP-2 IgG1 in mouse serum was detected at 14 d after the third immunization.IgG1 against IIP-2 was determined by ELISA.96-well EIA plates were respectively coated with KLHIIP-2 or KLH 2 mg·L-1.±s,n=6.
2.5 llP-2作为HBsAg佐剂免疫小鼠血清抗llP-2抗体水平
HBsAg(每只2 μg)与IIP-2(每只200 μg)肌注免疫小鼠2次。在第2次免疫后14 d,采用KLH和KLH-IIP-2 2 mg·L-1包被酶联反应板检测血清抗IIP-2抗体。ELISA 检测结果表明,小鼠免疫2次后14 d,血清中抗IIP-2 IgG1抗体水平很低,与单独HBsAg和生理盐水组相近,只有在1∶100稀释时为弱阳性(图6A);第2次免疫后90 d,免疫小鼠血清抗IIP-2 IgG1抗体水平仍为弱阳性(图6B)。
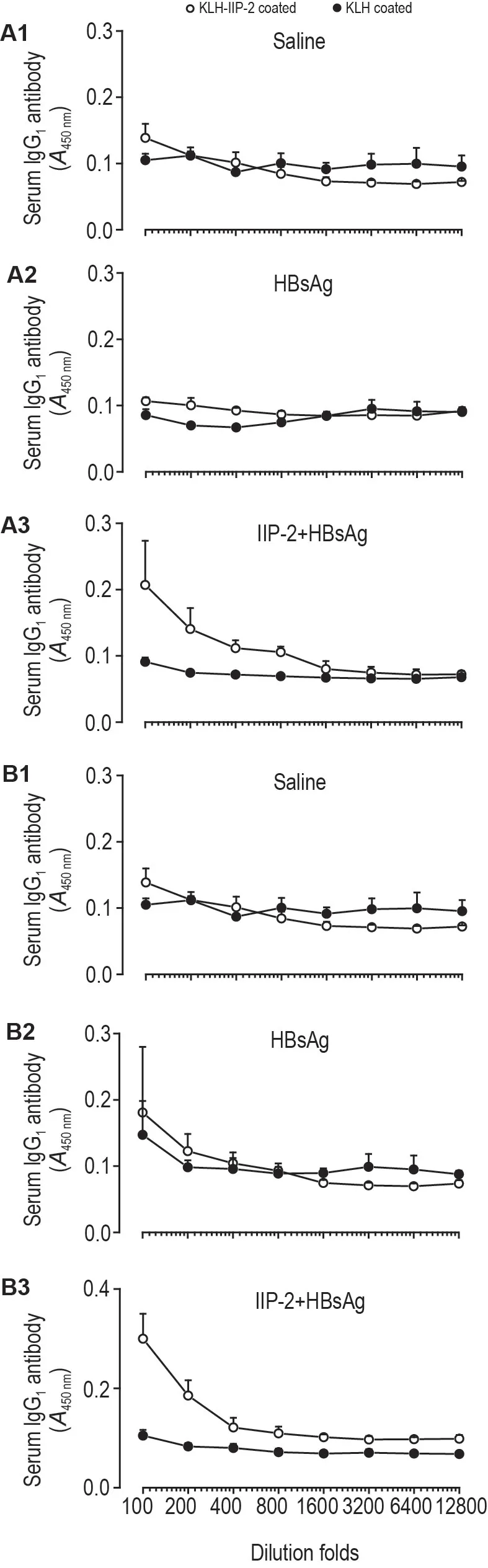
Fig.6 Serum lgG1 antibody titers of mice immunized with HBsAg plus llP-2.Each mouse was immunized twice at an interval of 28 d with HBsAg 2 μg plus IIP-2 200 μg.Serum IgG1 antibody titers in mice immunized with saline(A1,B1),HBsAg(A2,B2)or HBsAg plus IIP-2(A3,B3)by intramuscular injections at 14 d(A)and 90 d(B)after second vaccine.IgG1 against IIP-2 was determined by ELISA.96-well EIA plates were respectively coated with KLH-IIP-2 or KLH 2 mg·L-1.±s,n=6.
3 讨论
多糖佐剂是高分子活性物质,可作为佐剂增强抗原的免疫反应。免疫后动物体内是否产生多糖抗体是评价其作为佐剂安全性的关键问题。目前认为,多糖类成分是T细胞非依赖性抗原,只能激活B 细胞产生亲和力低的IgM 抗体,几乎不能发生类别转换产生IgG 和IgA 等抗体,也不能产生记忆性的T 细胞和B 细胞[9-10]。目前单独研究多糖免疫原性的报道较少,一般多见于细菌多糖疫苗的研究,特别是病原菌荚膜多糖作为疫苗或检测试剂,测定疫苗的特异性抗体水平。由于多糖本身免疫原性弱,特别对于≤2 岁婴儿,不能诱生保护性水平的抗体。因此,病原菌荚膜多糖多与蛋白偶联后作为疫苗进行免疫,增强抗原的特异性抗体产生[11-12]。
本课题组在前期研究中从中药茯苓中分离了2个杂多糖(PCP-Ⅰ和PCP-Ⅱ),发现它们具有较好的疫苗佐剂活性。PCP-I 的分子质量为3.0×105u,PCP-Ⅱ的分子质量为2.9×105u,二者均由岩藻糖、甘露糖、葡萄糖和半乳糖组成,但单糖摩尔数不同。发现茯苓多糖PCP-Ⅰ和PCP-Ⅱ本身免疫原性较弱,免疫后仅产生低水平的IgM,未检出IgG1抗体[8]。
本研究对板蓝根多糖IIP-A-1和IIP-2免疫原性进行研究。首先,将IIP-A-1和IIP-2分别与KLH偶联,将制备KLH-IIP-A-1和KLH-IIP-2完全抗原配伍弗氏佐剂免疫家兔,在家兔血清中检测到抗IIP-A-1 和抗IIP-2 抗体,说明作为半抗原与载体蛋白连接后,IIP-A-1和IIP-2可产生相应的抗体。
为研究无载体蛋白存在下IIP-A-1和IIP-2是否有免疫原性,将IIP-A-1和IIP-2单独免疫小鼠,结果在IIP-A-1 免疫小鼠血清中未检测到抗IIP-A-1 抗体,在IIP-2免疫小鼠血清中检测到IgG1型抗IIP-2抗体。尽管此研究中多糖免疫剂量较高(每只500 mg),免疫小鼠产生抗IIP-2 IgG1这一结果提示有必要研究IIP-A-1或IIP-2作为免疫佐剂时是否也会产生多糖抗体。本研究将IIP-A-1和IIP-2多糖(每只200 mg)分别配伍Aftosa疫苗免疫小鼠,得到与多糖单独免疫一致的检测结果,即只有IIP-2多糖作为佐剂免疫的小鼠血清中检测到IgG1型抗IIP-2 抗体。为进一步验证IIP-2 佐剂的免疫原性,使用IIP-2 佐剂配伍H1N1裂解病毒抗原和HBSAg免疫小鼠,在其血清中均检测到IgG1型抗IIP-2抗体。
阿拉伯半乳聚糖广泛存在于多种植物中,是一类具有较强免疫活性的多糖。国外有学者从落叶松树皮中分离获得1 种阿拉伯半乳聚糖,分子质量10×106~12×106u,该多糖骨架结构与IIP-2 相似。目前,该阿拉伯半乳聚糖作为佐剂与肺炎疫苗配伍使用,已进行了临床试验。结果表明,该阿拉伯半乳聚糖能明显提高疫苗的免疫原性,安全性良好[13]。此外,阿拉伯半乳聚糖已被美国FDA批准作为药品、膳食纤维和食品添加剂,用于提高NK细胞杀伤作用,具有较强的抗肝癌和抗转移功效,应用过程中显示良好的安全性[14]。目前尚未见有关阿拉伯半乳聚糖抗体方面的报道。
本研究中板蓝根多糖IIP-A-1 是一种含有少量1→6 分支的α-(1→4)-葡聚糖,IIP-2 是一种阿拉伯半乳聚糖,其分子质量为6.6×106u。由此推测,IIP-2 的强免疫原性可能与其骨架结构与阿拉伯半乳聚糖密切相关。总之,板蓝根多糖佐剂IIP-A-1抗原性弱,而IIP-2具有一定的免疫原性,IIP-2产生抗体的水平与可能其剂量和配伍抗原的性质有关。由此提示,在IIP-2作为疫苗佐剂的研究和开发过程中,需要关注多糖剂量以及IIP-2 本身抗体水平的变化。

