CD44基因多态性与宫颈癌及非小细胞肺癌的相关性
赵雨笛,谭 芳,严志凌,李盈甫,戴书颖,周紫云,张新文,刘舒媛,史 荔,姚宇峰
1.中国医学科学院/北京协和医学院医学生物学研究所,云南省重大传染病疫苗研发重点实验室,云南 昆明 650118 ;
2.昆明医科大学第一附属医院干部医疗科,云南 昆明 650032;
3.昆明医科大学第三附属医院妇科,云南 昆明 650118;
4.昆明医科大学基础医学院,云南 昆明 650500;
5.昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500
由于人口老龄化加剧、生活方式改变、环境恶化等因素的影响,全球恶性肿瘤发病率及死亡率持续增长,已成为人类死亡的首要原因[1]。除以上环境因素外,宿主因素尤其是宿主基因中的遗传多态性在肿瘤的发生、发展过程中发挥着重要作用[2]。CD44属于细胞黏附分子家族中的透明质酸黏素(hyaladherin),是一种跨膜糖蛋白,由细胞内结构域、细胞外结构域及跨膜结构域三个部分构成,是许多细胞因子、生长因子的受体。CD44由人类第11号染色体短臂上的CD44基因编码,全长50 kb,由20个外显子和19个内含子组成[3]。CD44是众多肿瘤干细胞的标志分子之一[4],在肿瘤细胞中,过表达的CD44已被确认与人类许多恶性肿瘤的发生、发展具有相关性[5-12],包括宫颈癌、肺癌等[13-18]。大量研究结果显示,CD44基因中的单核苷酸多态性(single nucleotide polymorphism,SNP)与人类多种癌症的易感性相关[19-22]。基因的3'UTR区域在miRNA参与的基因表达调控过程中发挥重要作用,而位于3'UTR区域的SNP位点可能通过影响miRNA的结合而影响基因的表达。因此,本研究选择了CD44基因3'UTR区域可能与miRNA结合相关[20,23]的两个SNP位点(rs13347C>T、rs8193C>T),分别研究其与云南汉族人群宫颈癌和非小细胞肺癌(non-small cell lung cancer,NSCLC)的相关性。
1 资料和方法
1.1 对象
随机选取2012年10月—2016年5月在昆明医科大学第三附属医院被确诊为宫颈癌的患者497例作为宫颈癌病例组,随机选取同期被确诊为NSCLC的患者483例作为NSCLC病例组,并排除:① 术前接受放化疗等抗肿瘤治疗的患者;② 患有其他恶性肿瘤,或合并心血管疾病、糖尿病、肝炎、肾病等疾病的患者;③ 资料不全者。选取同期在昆明医科大学第三附属医院体检的人类乳头状瘤病毒(human papilloma virus,HPV)阴性且无宫颈癌变的健康女性500名作为宫颈癌对照组,选取同期在昆明医科大学第三附属医院参加体检的471名健康体检者作为NSCLC对照组。所有参与者均为居住于云南地区的彼此无血缘关系的汉族个体,并签署知情同意书。
1.2 样本基因组DNA提取
采集研究对象静脉血5 mL(EDTA或肝素钠抗凝),使用全血基因组DNA提取试剂盒(QIAamp DNA Blood Mini Kit,德国QIAGEN公司,货号51106)提取DNA。并用超微量紫外可见分光光度计(NanoDrop2000,美国ThermoFisher Scientific公司)检测DNA的浓度及纯度。
1.3 SNP位点基因分型
本研究采用TaqMan探针实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)对研究对象SNP位点进行基因分型。TaqMan探针分型试剂盒及分型试剂(TaqMan Genotyping Master Mix)购自美国ABI公司(http://www.appliedbiosystems.com)。其中SNP位点rs13347基因分型试剂盒编号为C_ _7619022_10;S N P位点r s 8 1 9 3基因分型试剂盒编号为C_ _2143188_1_。基因分型使用PCR仪为QuantStudio 6(美国ABI公司),PCR反应体积为20 μL,反应程序为:95 ℃预变性10 min,92 ℃变性15 s,60 ℃退火延伸1 min,共40个循环,40 ℃长延伸5 min。基因分型试验设阴性对照(以水代替样本DNA)。基因分型实验数据采用QuantStudioTMReal-Time PCR软件进行分析,并选取每个位点不同基因型的样本进行测序。
1.4 统计学处理
本研究采用SPSS 19.0软件进行统计学分析;采用Hardy-Weinberg平衡检验样品代表性;采用t检验分析病例组和对照组间年龄是否存在差异;采用χ2检验分析病例组和对照组性别是否有差异,并分析病例组和对照组中CD44基因两个SNP位点基因型、等位基因分布频率的差异。采用SHEsis软件计算SNP位点间的连锁不平衡关系[24],用D'值表示两个位点间的连锁关系,当D'>0.8时说明SNP位点间存在强连锁。构建存在强连锁SNP的单倍型,并用χ2检验分析所构建的单倍型在病例组和对照组之间分布频率的差异。P<0.05为差异有统计学意义,在单倍型分析过程中的多重比较采用Bonferroni进行校正。
2 结 果
2.1 研究对象基本情况
本研究共纳入宫颈癌病例组497例,宫颈癌对照组500例;NSCLC病例组483例,NSCLC对照组471例(表1)。

表 1 本研究选取病例的临床特征Tab. 1 The clinical characteristics of the subjects enrolled in this study
2.2 研究样本的代表性
CD44基因中的SNP位点rs13347(C>T)、rs8193(C>T)的基因型分布在宫颈癌病例组和对照组,以及NSCLC病例组和对照组中全部符合Hardy-Weinberg平衡定律(P>0.05),说明本研究中所选择的样本是具有群体代表性的随机样本。
2.3 CD44基因SNP位点与宫颈癌和NSCLC的相关性分析
CD44基因中的两个SNP位点等位基因和基因型在宫颈癌组和对照组中分布特征见表2。结果显示,rs13347(C>T)和rs8193(C>T)位点等位基因和基因型在宫颈癌组和对照组中的分布频率的差异均无统计学意义(P>0.05)。
CD44基因中的两个SNP位点rs13347(C>T)和rs8193(C>T)位点等位基因和基因型在NSCLC组和对照组中的分布特征见表3。结果显示,rs13347(C>T)和rs8193(C>T)位点等位基因在NSCLC组和对照组中分布频率的差异有统计学意义(P=0.020和0.004);其中rs13347位点等位基因C在NSCLC组的分布频率显著高于对照组,可能是NSCLC发生的风险因素(OR=1.250,95%CI:1.035~1.509),而rs8193位点等位基因C在对照组中的分布频率显著高于NSCLC组,可能是NSCLC发生的保护性因素(OR=0.768,95%CI:0.641~0.921)。
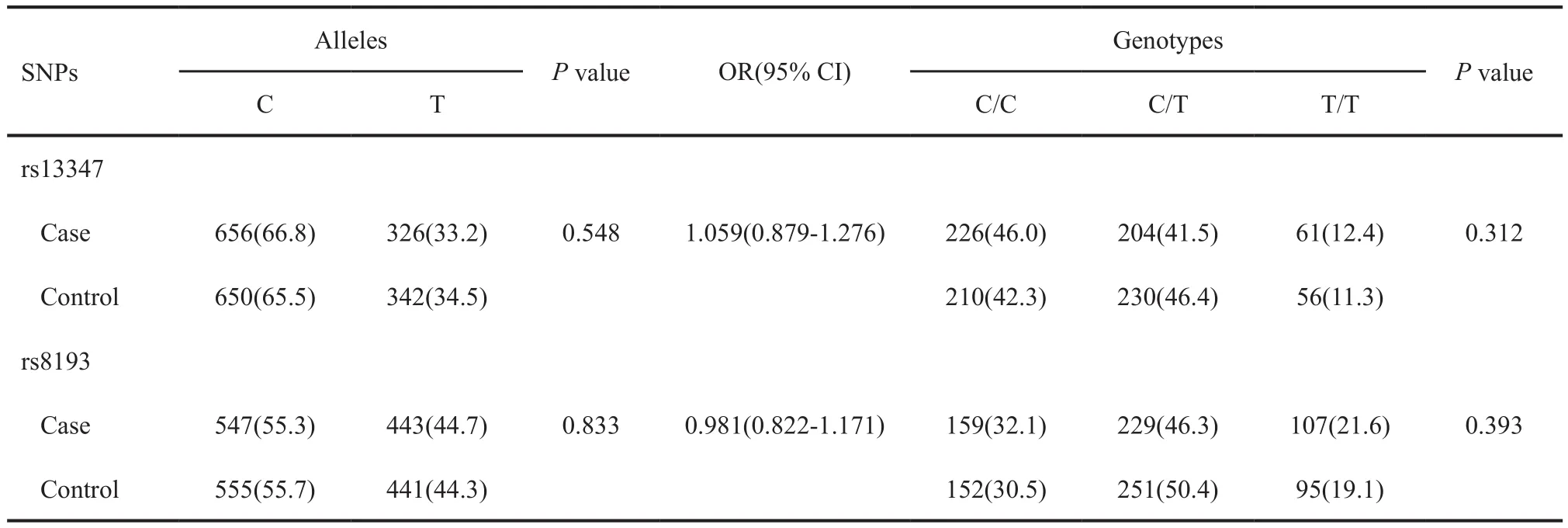
表 2 CD44基因中SNP位点的等位基因和基因型在宫颈癌病例组和对照组的分布Tab. 2 Comparison of the allelic and genotypic frequencies distribution of SNPs in CD44 gene among case and control groups of cervical cancer[n(%)]
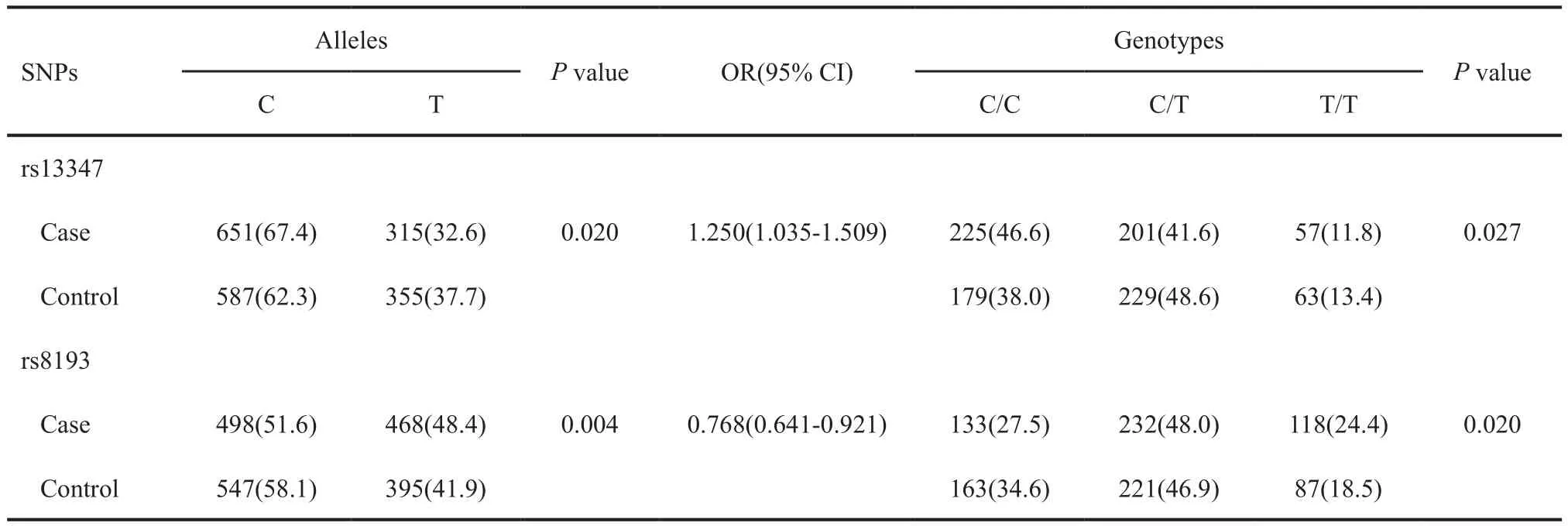
表 3 CD44基因中SNP位点的等位基因和基因型在NSCLC病例组和对照组的分布频率Tab. 3 The allelic and genotypic frequencies of SNPs in CD44 gene between NSCLC case and control groups[n(%)]
2.4 CD44基因SNP位点间连锁不平衡关系及单倍型分析
CD44基因SNP位点连锁不平衡分析结果显示,在宫颈癌和NSCLC的分析中 rs13347(C>T)和rs8193(C>T)之间均存在强连锁(D'>0.8)。根据连锁不平衡结果构建CD44基因SNP位点rs13347(C>T)和rs8193(C>T)的单倍型,并比较分布频率大于3%的单倍型在病例和对照组中的分布频率差异。结果显示,rs13347和rs8193两位点单倍型C-C、C-T和T-C在宫颈癌病例组和对照组中的分布频率差异无统计学意义(P>0.05)。在NSCLC病例组和对照组中,rs13347(C>T)和rs8193(C>T)两位点单倍型C-C的分布频率差异无统计学意义(P>0.05);单倍型C-T和T-C在NSCLC对照组和病例组中分布频率的差异有统计学意义(P=0.003和P=0.022),但经Bonferroni校正后,单倍型T-C在两组间的差异无统计学意义(P>0.05),表明rs13347C-rs8193T单倍型可能是NSCLC发生的风险因素(OR=1.316,95%CI:1.096~1.579,表4)。

表 4 CD44基因 SNP 位点单倍型与宫颈癌及NSCLC的相关性Tab. 4 The haplotype frequencies of SNPs in CD44 gene in case and control groups of cervical cancer and NSCLC[n(%)]
3 讨 论
癌症是全球主要的疾病负担,每年新发生病例1 000多万,我国新增病例约占全球的20%[25],其中肺癌发病例数居全球首位,宫颈癌发病例数居全球第2位。恶性肿瘤发生过程中个体间遗传因素的差异发挥着重要作用,基因组SNP是个体对肿瘤易感性差异的重要遗传学基础。遗传学肿瘤标志物已逐渐成为恶性肿瘤早期预防和诊治的重要监测指标。
CD44广泛表达于各类细胞表面,包括淋巴细胞、上皮细胞、中胚层细胞。CD44的过表达会干扰细胞的凋亡作用,从而促进癌细胞的增殖、迁移及侵袭能力[26]。Dasari等[27]在印度人群宫颈癌研究中发现,宫颈癌患者血清中CD44水平显着增加,这说明CD44的异常表达可能在肿瘤发生、发展过程中发挥重要作用。多项研究结果表明,CD44基因多态性与多种恶性肿瘤之间有着密切的联系,比如肺癌、胃肠癌、B细胞慢性淋巴细胞性白血病、甲状腺癌和卵巢癌等癌症中CD44的表达均显著升高[28-32]。研究发现基因中的SNP位点可能通过多种方式对基因的表达产生影响,其中位于基因3'-UTR区域的SNP位点可能通过干扰miRNA的结合而干扰miRNA对靶基因表达的调控[33]。因此本研究选取了位于CD44基因3'-UTR区域的两个多态性位点,分析其与云南汉族人群NSCLC、宫颈癌的相关性。其中rs13347(C>T)位点位于CD44基因3'-UTR区域,可通过影响hsa-miR-509-3P对CD44的调控而影响CD44的表达[20,34-35]。Shi等[36]的研究发现,该多态性位点与亚洲人尤其是中国人群患某些癌症的风险性有关,包括胆囊癌、鼻咽癌、乳腺癌和急性髓细胞性白血病等[8,20,34-35,37]。Tulsyan等[38]在北印度人群的研究中未发现CD44 rs13347与乳腺癌易感性的关联。本研究结果显示,CD44基因中的rs13347位点可能与云南汉族人群NSCLC具有相关性,而与云南汉族人群宫颈癌无相关性。综合以上研究资料发现,rs13347在不同研究中发挥的作用存在不一致,造成这种不一致结果的原因可能是由于不同研究选取的人群不同造成的,通过Ensemble数据库查询发现rs13347位点等位基因及基因型在不同人群中的分布频率差异较大(http://asia.ensembl.org/index.html);另一个可能的原因是不同疾病的发病机制不同,所以同一SNP位点在不同疾病中发挥的作用可能不同。本研究选取的CD44基因中的另一个SNP位点rs8193(C>T)与疾病的相关性的研究较少,本研究结果显示,CD44基因上rs8193(C>T)位点与云南汉族人群宫颈癌发病风险之间无关联性,但该位点可能与云南汉族人群NSCLC的易感性相关。3'UTR区域可以通过控制mRNA稳定性和翻译效率参与转录和翻译水平的基因调控。而rs8193位于CD44基因3'UTR中转录因子的结合区域,因此,有研究者推测转录因子与位于CD44基因3'UTR区域的rs8193多态性位点结合的变化使得CD44基因的转录活性受到影响[23,39]。
本研究分析了CD44基因中两个多态性位点的连锁不平衡关系,构建了两个位点的单倍型,并对分布频率大于3%的单倍型在病例组和对照组中的分布差异进行了分析,结果显示,C-T单倍型与云南汉族人群NSCLC的易感性相关。该结果与等位基因和基因型分析结果中rs13347和rs8913等位基因在NSCLC发生过程中发挥的作用相一致。
综上所述,本研究中CD44基因中的两个多态性位点rs13347和rs8193可能与云南汉族人群宫颈癌的易感性无关。但在NSCLC的分析中,多态性位点rs13347基因型C/C可能是肺癌发生的风险因素;rs8193位点基因型C/C可能是NSCLC发生的保护因素,单倍型C-C则可能与NSCLC风险增加有关。这两个位点位于CD44基因的3'UTR区域,其中rs13347是hsa-miR-509-3P的结合序列,而rs8193可能位于转录相关因子结合区域,两个多态性位点均可能会对CD44的表达产生影响,从而与肿瘤发生、发展具有相关性。但研究结果仍存在着争议,因此后期会通过增加样本量进一步分析两个SNP位点与宫颈癌和肺癌的相关性。

