TBRG4在肺腺癌中的作用及其机制研究
叶 柯,郑晓丽,葛 红,李 雪,王 浩
郑州大学附属肿瘤医院放疗科,河南 郑州 450000
肺癌是目前临床上最常见的恶性肿瘤,又称为原发性支气管肺癌。根据其形态学及生物学特征,肺癌可分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞癌(small cell lung cancer,SCLC)。临床治疗肺癌的主要方法有靶向药物治疗、化疗、放疗及手术切除等,但目前大多数治疗方法的疗效仍较差,5年生存率较低[1]。因此,深入研究肺癌发生、发展的机制及其过程中的关键分子并开展靶向治疗,对提高肺癌患者的生存率、改善其生存质量具有重要意义。
转化生长因子β调节子4(transforming growth factor β regulator 4,TBRG4)是编码转化生长因子β(transforming growth factor-β,TGF-β)的调节子。近年来研究发现TBRG4表达异常与肿瘤密切相关[2]。研究发现,TBRG4在头颈部鳞状细胞癌患者的细胞系中存在异常扩增[3],同时,TBRG4在乳腺癌细胞的增殖等方面发挥重要作用,但是其在肺癌中的作用尚未阐明。因此,本实验拟采用免疫组织化学方法检测TBRG4在临床收集的NSCLC患者癌组织及癌旁组织样本中的表达,分析其表达的临床意义。构建TBRG4的RNA干扰(RNA interference,RNAi)载体并转染肺癌细胞系NCI-H1299,分析TBRG4在肺癌细胞增殖及调亡等生物学行为中的作用,为初步探讨TBRG4基因作为治疗肺癌的可能潜在靶点提供实验基础。
1 材料和方法
1.1 材料
1.1.1 临床样本
本研究中所有病例资料的收集以及临床组织样本的采集均获得郑州大学附属肿瘤医院医学伦理委员会的审批并在其监督下进行。2017年6月—2018年6月采集郑州大学附属肿瘤医院收治的NSCLC患者肿瘤组织标本,同时,采集NSCLC患者距离癌组织5 cm以上的正常肺组织,共63例,为肺叶切除组织。所有NSCLC患者术前均未接受任何治疗。术后所有临床样本均送郑州大学附属肿瘤医院病理科经病理学检查证实为肺腺癌。同时记录相关的临床资料和病理资料,结果见表1,而NSCLC的肿瘤分级和临床分期依据第7版肺癌TNM分期标准[4]。
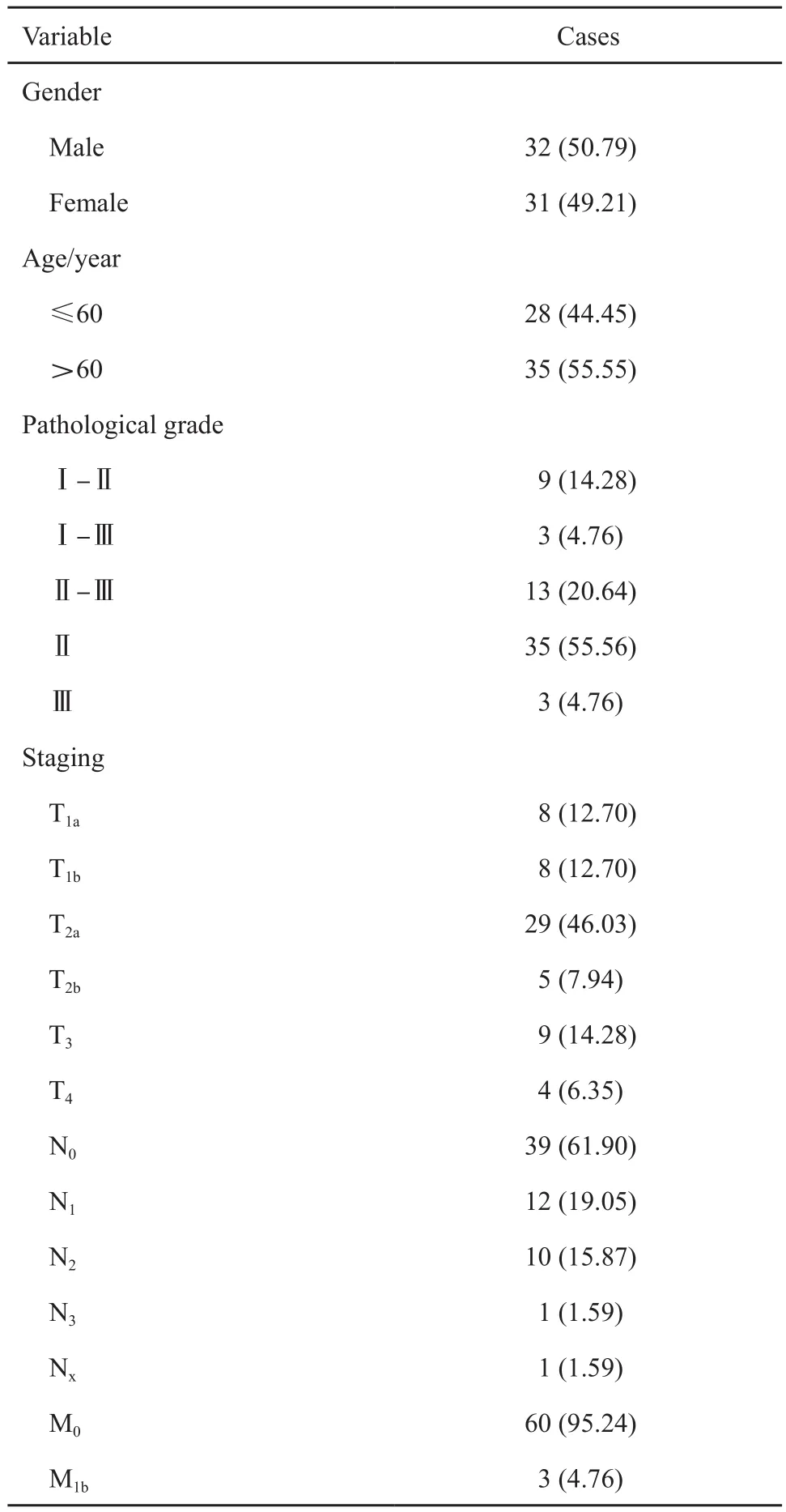
表 1 NSCLC患者临床特征(N=63)Tab. 1 Clinical characteristics of NSCLC patients (N=63)[n (%)]
1.1.2 主要试剂
慢病毒包装试剂盒购自上海吉凯基因化学技术有限公司,细胞计数试剂盒(cell counting kit-8,CCK-8)购自美国Biosharp公司,AnnexinVFITC/PI和PI/RNases试剂盒购自美国BD公司,RPMI-1640培养基、胎牛血清购自美国Gibco公司,抗IGF2抗体(ab18954)、抗RAP1A抗体(ab115776)和抗TBRG4抗体(ab180775)购自英国Abcam公司,羊抗兔二抗购自美国Cell Signaling Technology公司(#5151)。
1.2 方法
1.2.1 肺癌组织和癌旁组织样本中TBRG4的表达
固定后的组织样本进行脱水、透明和浸蜡后切片。再进行脱蜡和水化后,用0.01 mol/L柠檬酸钠缓冲液浸没切片,沸水浴20 min,在室温下自然冷却,用PBS漂洗3次。用3%的H2O2的双蒸水滴盖切片组织,室温温育10 min,灭活内源性过氧化物酶,PBS漂洗2次。封闭后用TBRG4一抗4 ℃温育过夜。取出切片用PBS漂洗3次后,滴加HRP标记的二抗,37 ℃温育30 min。滴加DAB工作液染色5 min后用蒸馏水冲洗。苏木精染液复染3 min,蒸馏水冲洗,温水返蓝5 min,乙醇浓度梯度脱水,二甲苯透明5 min后封片。每张切片随机选择5个区域进行拍照,并根据切片棕黄色强度及面积来评估染色结果。
1.2.2 慢病毒感染
收集H1299细胞制备成细胞悬液,调整细胞密度为5×104个/mL,取100 μL细胞悬液至96孔板中,培养24 h。吸弃上清液,依次加入试剂盒中的试剂,培养12 h后换液。感染72 h后在倒置荧光显微镜下观察,当感染效率达到80%以上时,选择该感染条件继续进行后续实验。取5×104个/mL密度的细胞悬液2 mL至6孔板中培养24 h。弃上清液,加入包含沉默TBRG4基因的小发夹RNA(small hairpin RNA,shRNA)的慢病毒(5'-GTTCTTCAGCCTGGTACAT-3')及空载体病毒。将感染成功的细胞置于培养瓶中培养,感染72 h后,荧光显微镜下观察,同时观察细胞感染后的情况,若细胞未出现大量死亡,且生长状况良好,即可进行下一步实验,并将NCI-H1299细胞分为对照组(TBRG4-vector组)、干扰组(TBRG4-RNAi组)和未进行转染的空白对照组(Control组)。
1.2.3 CCK-8增殖实验
收集细胞,以2×103个/孔密度将3组细胞接种于96孔板中,每组设3个复孔。待细胞贴壁后换含有10 μL CCK-8试剂的100 μL培养基,继续在培养箱中温育2 h,用酶标仪在450 nm检测每孔吸光度(D)值。同时,分别在24、48、72和96 h时测得各组细胞的D值。并根据所测得D值绘制3组细胞的生长曲线。
1.2.4 细胞克隆形成实验
将3组生长状态良好的细胞接种于6孔板中,每孔约1 000个细胞,每组设3个复孔。每隔3 d观察1次细胞状态,视细胞状态更换培养基,2周后出现肉眼可见的成团细胞集落,即可终止培养。用PBS清洗细胞1次后加入4%多聚甲醛进行固定,再用0.1%结晶紫染液进行染色15 min,用PBS清洗后拍照并计数。细胞克隆形成率=(克隆数/接种细胞数)×100%。
1.2.5 细胞凋亡实验
本实验采用Annexin V-FITC/PI 双染法检测细胞凋亡。将3组细胞以5×105个/mL的密度接种到6孔板中,在培养箱中培养24 h后收集细胞,用预冷的PBS洗涤2次后,加入1×结合缓冲液重悬细胞,调整细胞的密度约为1×106个/mL。取100 μL至流式管中,分别加入5 μL Annexin V-FITC和5 μL PI混匀后室温避光温育15 min,再加入400 μL×结合缓冲液采用流式细胞术进行检测。
1.2.6 细胞周期实验
本实验采用PI/RNase单染检测细胞周期,制备细胞悬液并以5×106个/mL的密度接种于6孔板中,在培养箱中温育过夜。消化收集细胞,并用预冷的PBS洗涤2次。弃上清液,每管逐滴加入1 mL预冷的70%的乙醇,吹打混匀,-20 ℃避光过夜。固定24 h后1 000 r/min离心5 min。吸弃上清液,用预冷的PBS洗涤细胞1~2次。加入500 μL的PI/RNase染液染色,室温避光温育15 min,用300目尼龙网过滤后,采用流式细胞术进行检测。
1.2.7 蛋白质印迹法(Western blot)检测蛋白水平
用PBS清洗细胞,加入含蛋白酶抑制剂的放射免疫沉淀分析(radio-immunoprecipitation assay,RIPA)裂解液,在冰上裂解30 min。12 000 r/min,4 ℃低温离心15 min,收集上清液,采用BCA法测定蛋白浓度。根据测得浓度调整上样量后在10%的分离胶中进行电泳。电泳完后,采用湿转方法在200 mA恒流条件下将蛋白转移到PVDF 膜上。电转结束后,将PVDF膜置于闭液封闭2 h 后,用一抗在4 ℃条件下温育过夜。取出PVDF膜用洗膜缓冲液(Tris-buffered saline with Tween 20,TBST)洗涤3次,用二抗在室温下温育2 h。取出PVDF膜后用TBST洗涤3次后用Odyssey双色红外激光成像系统进行扫描分析。
1.2.8 统计学处理
本次实验数据均采用SPSS 17.0软件进行处理,计数资料采用χ2检验;计量资料用x±s表示,组间比较用t检验;P<0.05为差异有统计学意义。
2 结 果
2.1 TBRG4在NSCLC患者癌组织和癌旁组织中表达情况的比较
NSCLC患者癌组织中TBRG4的阳性表达率显著高于其在癌旁组织中的阳性表达率,差异有统计学意义(P<0.05)。由此可见,在NSCLC患者癌组织中TBRG4蛋白水平升高(图1,表2)。

图 1 TBRG4在NSCLC患者癌组织和癌旁组织中表达比较Fig. 1 Comparison of the expression of TBRG4 in cancer tissues and paracancerous tissues of NSCLC patients

表 2 TBRG4在癌组织和癌旁组织中的表达Tab. 2 The expression of TBRG4 in cancer tissues and paracancerous tissues
2.2 慢病毒感染后H1299中TBRG4蛋白的表达量
慢病毒感染后H1299中TBRG4蛋白的表达量结果见图2,TBRG4-RNAi组中TBRG4蛋白的表达量显著性低于TBRG4-vector组和Control组,差异有统计学意义(P<0.05),表明H1299细胞中TBRG4的shRNA慢病毒感染成功,敲低了TBRG4的表达量。
2.3 TBRG4敲低抑制H1299细胞的生长
为了探究TBRG4敲低对H1299细胞生长的影响,本实验采用CCK-8法连续4 d观察细胞的生长情况,结果见图3,与TBRG4-vector组和Control组相比,TBRG4-RNAi组细胞增殖明显受到抑制,差异有统计学意义(P<0.05),表明下调TBRG4的表达后抑制了H1299细胞的增殖能力。

图 2 各组细胞中TBRG4蛋白的表达量Fig. 2 Expression of TBRG4 protein in each group of cells

图 3 CCK-8 实验检测各组细胞增殖能力Fig. 3 CCK-8 assay to detect the proliferation of cells in each group
2.4 TBRG4敲低抑制H1299细胞克隆形成
结果见图4。TBRG4-RNAi组细胞形成集落数目显著性低于与TBRG4-vector组和Control组形成的集落数,差异有统计学意义(P<0.05)。这表明抑制TBRG4的表达能够减弱H1299细胞的克隆形成能力。
2.5 TBRG4敲低促进H1299细胞的凋亡
本实验研究了TBRG4敲低后是否对细胞的凋亡产生影响。流式细胞术检测结果见图5,与TBRG4-vector组相比,BRG4-RNAi组细胞凋亡率显著性增加,差异有统计学意义(P<0.05)。这表明TBRG4敲低后能促进H1299细胞的凋亡。
2.6 TBRG4敲低导致H1299细胞周期停滞于G0/G1期
TBRG4敲低导致H1299细胞周期的影响结果见表3。结果表明,TBRG4-RNAi组S期和G2/M期的细胞百分比较Control组和TBRG4-vector组明显下降,G0/G1期的细胞百分比明显升高,差异有统计学意义(P<0.05)。因此,TBRG4敲低会导致H1299细胞周期停滞于G0/G1期。
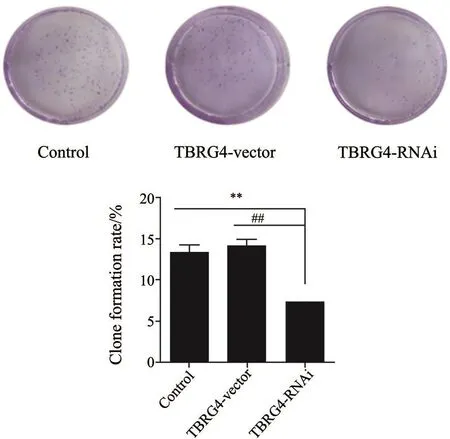
图 4 各组细胞克隆形成能力比较Fig. 4 Comparison of cell colony forming ability of each group
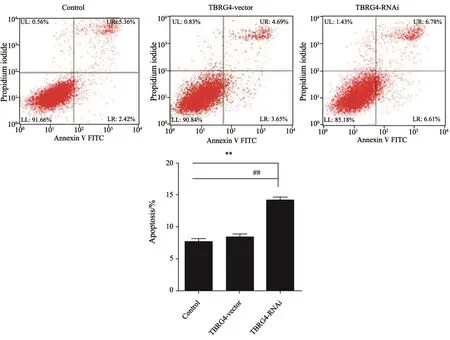
图 5 各组细胞凋亡率比较Fig. 5 Comparison of apoptosis rates in each group
表 3 各组细胞周期比较Tab. 3 Comparison of cell cycle of each group(±s,%)

表 3 各组细胞周期比较Tab. 3 Comparison of cell cycle of each group(±s,%)
**: P<0.01, compared with the Control group; ##: P<0.01, compared with the TBRG4-vector group; #: P<0.05, compared with the TBRG4-vector group
Group G0/G1 S G2 Control 40.31±0.67 39.02±0.78 20.67±0.55 TBRG4-vector 41.24±0.52 38.23±0.64 20.53±0.48 TBRG4-RNAi 51.58±0.58**,## 36.17±0.45**,# 12.25±0.42**,##
2.7 TBRG4敲低激活10号染色体上缺失的磷酸酶及张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)信号通路相关蛋白
Western blot实验结果表明,TBRG4敲低激活了PTEN蛋白,上调了RAP1A及IGF2等下游基因的表达,差异有统计学意义(P<0.05),提示TBRG4敲低后通过激活PTEN信号通路相关蛋白从而调控H1299细胞的生物学行为。
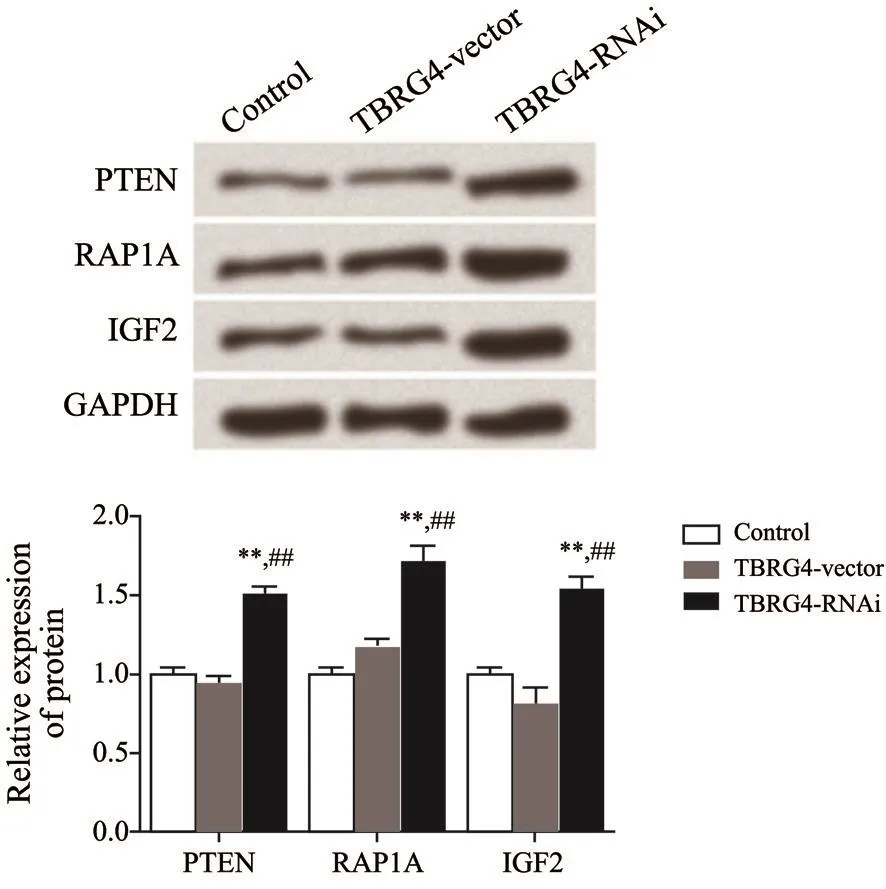
图 6 各组细胞信号通路蛋白表达情况比较Fig. 6 Comparison of protein expression in cell signaling pathways of each group
3 讨 论
在临床治疗肺癌的过程中,研究发现使用靶向药物治疗可延长部分患者的生存期[5],但由于耐药性及不良反应等问题,生存率仍低于15%[6]。因此,探究肺癌发生、发展过程中新的机制及关键分子,并开展靶向治疗对临床寻找有效的肺癌治疗方案具有重要意义。RNAi是一种可以使目的基因沉默的调控方式,主要通过外源性小分子干扰RNA或内源性小分子RNA而实现[7-9]。慢病毒载体免疫原性较低,可感染细胞将携带的外源基因片段整合进宿主基因组中,因此被广泛地应用于基因工程[10-14]。
TBRG4基因位于7p14-p13,编码TGF-β调节子。研究表明,TBRG4在参与细胞周期素CLN1和CLN2的调控及维持其稳定性方面发挥重要的作用[15]。本实验结果显示TBRG4在NSCLC患者的肺癌组织中高表达,表明其可能参与肺癌的发生、发展过程。同时,本实验采用带有GFP的慢病毒载体对TBRG4基因进行特异性干扰,从而探讨TBRG4基因敲减对肺癌细胞系H1299细胞生物学行为的影响。
TBRG4可调控细胞周期蛋白CLN1和CLN2的转录及维持其稳定性,抑制TBRG4基因会导致某些线粒体mRNA不稳定[16]。研究发现,TBRG4蛋白在多发性骨髓瘤患者髓外肿瘤组织[17]、原代乳腺癌细胞中[18]的表达显著升高,而在正常乳腺细胞系16N中表达降低,并且其表达与乳腺癌的恶性程度呈正相关[18]。本研究发现,在肺癌组织中TBRG4蛋白呈高表达,而在癌旁组织中低表达,因此该基因可能参与了肺癌的发生、发展过程。本实验构建了TBRG4敲低慢病毒载体,探究抑制TBRG4的表达对H1299细胞生物学行为的影响。实验结果表明,敲低TBRG4基因能够抑制H1299细胞的增殖及细胞克隆形成能力,促进其凋亡,同时导致细胞周期停滞于G0/G1期。
PTEN是继p53后新发现的肿瘤抑制基因,其是第一个具有脂质和蛋白的双重特异性磷酸酶活性的抑癌基因。PTEN的主要功能是通过调控多种信号通路从而抑制肿瘤细胞的增殖、转移、黏附以及促进细胞分化、凋亡、衰老,参与细胞周期的调节等[19]。同时,研究表明,PTEN表达下调促进NSCLC的发生和转移[20-22]。而本实验结果表明TBRG4基因敲低激活了PTEN,进一步上调了RAP1A及IGF2等下游基因,从而抑制H1299细胞的增殖及细胞克隆形成能力,并促进其凋亡。本研究共纳入63例肺腺癌患者样本,而小样本量所得结果可能存在偏差。本研究中有限的样本量提示TBRG4的表达与肺腺癌的临床病理学特征相关,下一步我们将增加样本量,同时引入其他类型的肺癌样本(如肺鳞状细胞癌样本),再检测TBRG4的表达,分析其与临床的相关性,以阐明TBRG4在肺癌中的作用及临床意义。
综上所述,TBRG4在肺癌细胞的增殖、调亡方面具有重要的生物学功能,其可能作为治疗肺癌的一个潜在靶点,但其相关机制有待进一步研究。

