CPI203抑制肾癌ACHN细胞增殖及其机制
梁琼仙,胡 波,张海红,谭晓军广东省开平市中心医院肾内科,广东 开平 59300;暨南大学附属第一医院//广州华侨医院肾内科,广东 广州 50000
肾细胞癌是众多恶性肿瘤中的一种,男性肾癌患者患病率约为女性患者的2倍,属于泌尿生殖系统中的高发恶性肿瘤[1-2]。近年来,肾癌的检出率逐年增加[3-4]。目前针对肾癌的治疗方案主要为外科手术治疗,但是术后肿瘤复发及转移是阻碍肾癌治疗进展的绊脚石,甚至20%的初诊肾癌患者已为肿瘤晚期,错失手术治疗的最佳良机[5]。化疗、放疗为恶性肿瘤的重要治疗方案,与外科手术切除疗法并驾齐驱,但肾癌对放疗及系统疗法(基于IL-2及IFN-γ的激素疗法、化学疗法及免疫疗法)不敏感甚至耐药,大大增加治疗难度[2,6]。BET超家族包括BRD1、BRD2、BRD4及BRDT 4种蛋白质,具有相似的空间结构,可通过结合染色体上乙酰化的赖氨酸介导染色体重排或调控转录活性[7-8]。研究发现BET超家族蛋白在肾癌细胞中表达量高,促进肾癌细胞增殖、侵袭及迁移,是治疗肾癌的一个潜在靶点[9]。CPI203是一种BET超家族的特异性小分子抑制剂,前期研究发现CPI203可在体内外抑制多种恶性肿瘤细胞增殖,其中包括淋巴瘤、急性白血病、多发性骨髓瘤、皮肤鳞癌及神经内分泌肿瘤等[10-14]。CPI203小分子抑制剂可通过调控多种癌基因表达水平进而影响恶性肿瘤细胞的增殖、生长及侵袭。至今,暂未发现有关于CPI203对肾癌细胞增殖影响的研究。本实验通过探索CPI203对肾细胞癌的杀伤作用,并针对其影响机制进一步深究,为探寻肾癌新药物治疗夯实一定的基础。
1 材料与方法
1.1 材料
ACHN细胞(ATCC),小分子抑制剂CPI203(Selleckchem),PBS缓冲液、DMEM培养基、胎牛血清、普通胰酶等试剂(BI),荧光定量PCR引物(上海生工生物工程公司合成提供),CCK-8检测试剂盒(Dojindo),逆转录及TBGreen试剂盒(Takara),免疫印迹实验抗体(ProteinTech)。
1.2 细胞培养
肾癌ACHN细胞以普通培养基(含10%FBS的DMEM)于37 ℃、5% CO2饱和湿度细胞培养箱中培养,严密注意细胞生长情况,当细胞增殖至密度达培养瓶80%左右时,传代培养。后续所有细胞实验均建立在对数生长期状态良好的细胞上进行实验。
1.3 小分子抑制剂CPI203药物溶液配制
CPI203用细胞级别的DMSO充分溶解,先配制成100 μmol/L浓度的母液并保存于-80 ℃冰箱中。细胞实验前用完全培养基将药物母液稀释成实验需要的工作液浓度。
1.4 肾癌ACHN细胞存活率检测
取生长状态良好的ACHN细胞,经胰酶消化后调整细胞密度为5×104/mL,以每孔100 μL的细胞悬液接种于96孔板中,将培养板置于细胞孵箱中培养过夜。根据实验计划需求,将培养板中的细胞培养基更换为CPI203药物溶液,浓度分别为0、0.1、0.5、1 μmol/L及5 μmol/L,设立空白组及对照组,每个浓度设立4个复孔。CPI203药物作用于肾癌ACHN细胞24、48 h后,96孔板中每个孔按照CCK8试剂盒说明书指示加入10 μL CCK8溶液,将96孔板放入细胞孵箱中继续培养4 h,酶标仪检测培养板吸光度A450nm并计算细胞存活率。
1.5 细胞划痕实验
取生长状态良好的ACHN细胞备用,将肾癌细胞悬液密度调整为1×106/mL,以1 mL/孔的细胞悬液接种于6孔板中,放回普通细胞孵箱中继续培养至细胞密度达培养板的90%~100%时,用高压灭菌过的200 μL中枪头迅速地在细胞中划痕,然后将细胞培养基更换为CPI203药物浓度为0、0.1、0.5、1 μmol/L及5 μmol/L的培养基。分别于药物作用0、48 h后于倒置显微镜下拍照,观察细胞迁移及侵袭能力。
1.6 细胞周期实验
取生长状态良好的ACHN细胞备用,将肾癌细胞悬液密度调整为1×106/mL,以1 mL/孔的细胞悬液接种于6孔板中,将培养板放回孵箱中继续培养24 h后将细胞培养基更换为小分子抑制剂CPI203药物浓度为0、0.1、0.5、1 μmol/L及5 μmol/L的培养基,将培养板放回细胞孵箱继续培养24 h后收集细胞,充分洗涤后加入75%乙醇固定液固定,放置于4 ℃冰箱过夜。PBS充分洗涤后加入500 μL PI重悬细胞,4 ℃避光孵育30 min,流式细胞仪检测细胞周期分布情况。
1.7 细胞凋亡实验
取生长状态良好的ACHN细胞备用,将肾癌细胞悬液密度调整为1×106/mL,以1 mL/孔的细胞悬液接种于6孔板中,将培养板放回孵箱中继续培养24 h后将细胞培养基更换为小分子抑制剂CPI203药物浓度为0、0.1、0.5、1 μmol/L及5 μmol/L的培养基,将培养板放回细胞孵箱继续培养24 h后收集细胞,用PBS充分清洗后加入100 μL bindingbuffer重悬细胞,然后分别加入APC和PI各5 μL,常温下避光孵育30 min,流式细胞仪检测细胞凋亡情况。
1.8 细胞克隆形成实验
取生长状态良好的ACHN细胞以500/孔接种于6孔板中,细胞继续于孵箱中培养24 h后将细胞培养基更换为小分子抑制剂CPI203药物浓度为0、0.1、0.5、1 μmol/L及5 μmol/L的培养基,将细胞放回孵箱中继续培养10 d后用PBS充分洗涤,细胞固定液固定1 h后充分清洗,倒置显微镜下计算克隆形成数目。
1.9 免疫印迹法检测MYC、GSK3β、ERK、AKT、CyclinD1和NOXA蛋白水平
收集不同CPI203药物浓度处理的肾癌ACHN细胞并充分洗涤,加入适量强效细胞裂解液,4 ℃条件下裂解20 min,提取全细胞蛋白并利用BCA法测定蛋白浓度。提前配制好适宜浓度的SDS-PAGE胶,每个泳道加入40 μg蛋白,80 V恒压电泳约30 min后转换为120 V恒压电泳约1 h;恒流200 mA湿转法转膜;将PVDF膜置于5% BSA溶液中封闭2 h;分别将PVDF膜置于4 ℃冰箱中中孵育相应一抗溶液,过夜;0.1%吐温的TBS-T洗涤一抗4次,10 min/次;室温下孵育二抗1 h;TBS-T漂洗二抗3次,6 min/次;将PVDF膜稍微沥干后加入ECL发光液,放置于WB成像系统中显影成像。
1.10 qRT-PCR
用TRIzol裂解细胞并按照试剂盒说明书指示提取细胞总RNA,严格按照TaKaRa逆转录试剂盒及TBGreen说明书将总RNA逆转录成cDNA并进行荧光定量检测。qRT-PCR引物序列见表1。内参基因选用GAPDH,利用2-ΔΔCt法分析结果。
1.11 统计方法
对计数资料及计量资料均采用双侧检验分析,采用SPSS20.0软件统计数据,参数检验及非参数检验分别采取t检验和χ2检验,以P<0.05为差异有统计学意义。

表1 qRT-PCR引物序列
2 结果
2.1 CPI203抑制肾癌ACHN细胞增殖
不同浓度CPI203药物作用于ACHN细胞48 h后,肾癌细胞增殖活性受到不同程度抑制(表2)。0.1~5 μmol/L浓度的CPI203作用于ACHN细胞24 h后细胞增殖活性从87.29%降至52.61%,相同浓度的CPI203药物作用于肾癌ACHN细胞的时间越长,细胞增殖活性下降(P<0.05,表2)。
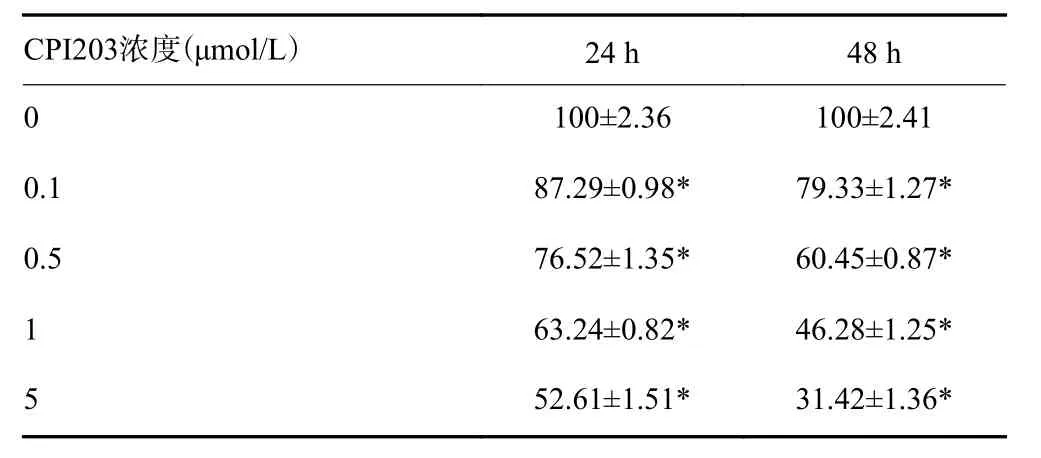
表2 CCK8法检测CPI203抑制ACHN细胞增殖效果(%,Mean±SD)
2.2 CPI203抑制肾癌ACHN细胞侵袭及迁移能力
ACHN细胞划痕实验结果表明,随着CPI203药物浓度的增大,细胞迁移距离明显变小(P<0.05,图1)。

图1 ACHN细胞划痕实验
2.3 CPI203药物抑制肾癌ACHN细胞生长周期并促进其凋亡
不同浓度小分子抑制剂CPI203作用于肾癌ACHN细胞24 h后其细胞周期及凋亡情况。实验结果显示,小分子抑制剂CPI203浓度越大,ACHN细胞G0/G1期比例增加,G2/M和S期占比均比对照组细胞小,细胞凋亡率也随着药物浓度增大而升高(P<0.05,图2)。
2.4 荧光定量PCR
CPI203作用于肾癌ACHN细胞后减弱MYC基因、NOXA基因、AKT基因、ERK基因、GSK3β基因及CyclinD1基因的表达量(P<0.05,图3)。
2.5 CPI203抑制肾癌ACHN细胞克隆形成能力
未加小分子抑制剂CPI203的ACHN细胞形成明显的细胞克隆集落,随着药物浓度的增大,肾癌ACHN细胞克隆集落形成能力逐渐减弱(P<0.05,图4)。
2.6 Western blotting结果
CPI203作用于肾癌ACHN细胞后降低MYC蛋白、NOXA蛋白、AKT蛋白、ERK蛋白、GSK3β蛋白及CyclinD1蛋白的表达量(P<0.05,图5)。
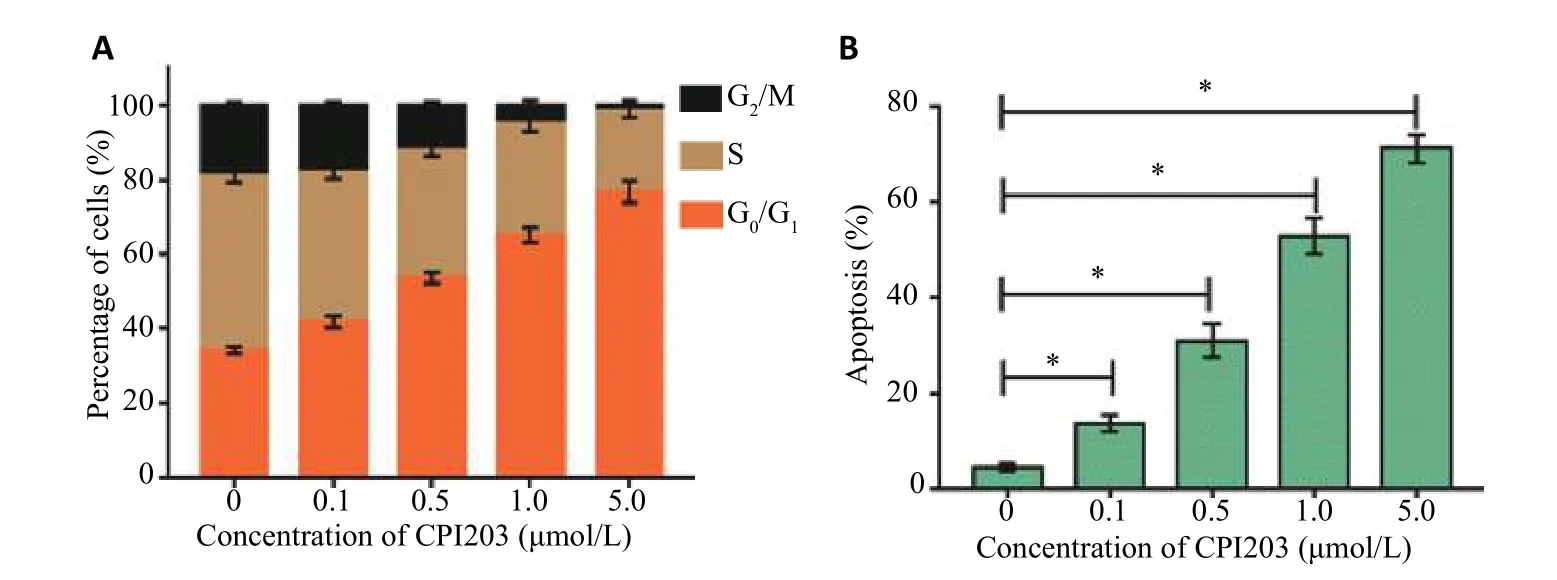
图2 不同浓度CPI203药物对肾癌ACHN细胞周期(A)及凋亡(B)的影响*P<0.05
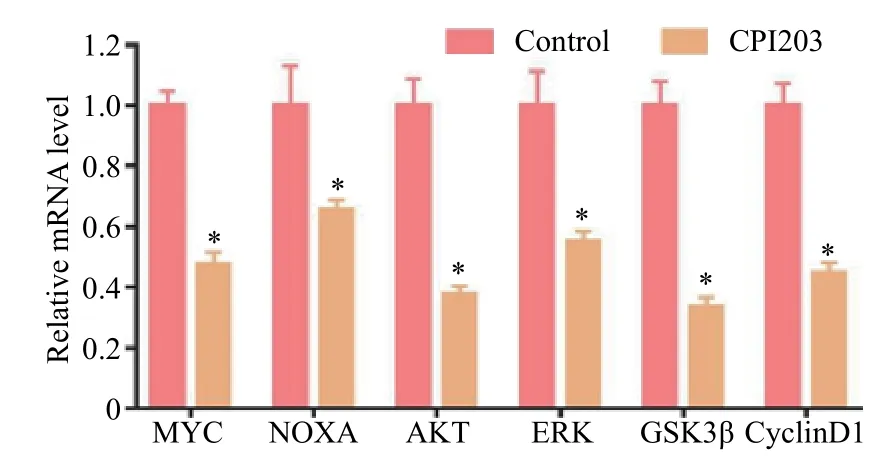
图3 小分子抑制剂CPI203作用于肾癌ACHN细胞后相关基因表达的影响
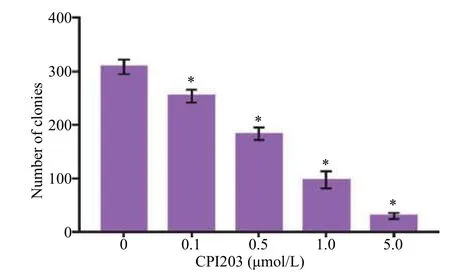
图4 不同浓度CPI203药物对肾癌ACHN细胞克隆形成能力的影响
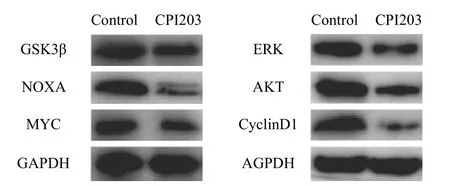
图5 小分子抑制剂CPI203作用于肾癌ACHN细胞后相关蛋白表达的影响
3 讨论
肾癌细胞对化疗和放疗敏感性弱,并且患者病情容易出现复发难治,众多科学家为了克服此困难一直致力于探索治疗肾癌的新药物[15-17]。文献报道CPI203具有抑制胰腺神经内分泌肿瘤增殖,促进其癌细胞凋亡并将肿瘤细胞抑制于细胞周期G1期,从而对肿瘤细胞发挥杀伤作用[15]。本研究同样发现小分子抑制剂CPI203具有抑制肾癌ACHN细胞生长增殖能力,并且其抑制效果与药物作用时间呈正相关性。CPI203小分子抑制剂具有抑制肾癌ACHN细胞侵袭、迁移的能力,表明该小分子抑制剂在体内具有抑制肾癌肿瘤发生转移的能力。流式细胞仪检测结果表明随着CPI203药物浓度的增加,肾癌ACHN细胞发生凋亡的比例增大,表明肿瘤细胞的凋亡率与CPI203药物呈浓度依赖性。细胞周期相关蛋白CyclinD1是一种重要的细胞周期素,严格地调控着细胞G1期的合成,主要作用于G1/S调定点并调控着细胞G1期向S期的进展。CyclinD1过多将缩短G1期,细胞将减弱对外源性有丝分裂的依赖并进入细胞分裂[18]。CyclinD1下降将把细胞周期抑制于G1期,有利于肿瘤的治疗。
本实验结果表明,小分子抑制剂CPI203可抑制肾癌ACHN细胞CyclinD1的表达,细胞S期及G2/M期比例降低,G0/G1期比例升高,表明CPI203可阻滞肾癌ACHN细胞周期进展,影响肿瘤细胞的生长、生存。有研究发现CPI203可通过降低MYC、NOXA、AKT及ERK等众多基因的表达从而抑制多发性骨髓瘤细胞及淋巴瘤细胞的增殖[19]。本研究发现小分子抑制剂CPI203通过抑制肾癌ACHN细胞GSK3β、CyclinD1、MYC、NOXA、AKT及ERK基因的转录活性,减少其mRNA的表达量,同时降低这些基因的翻译活性,进一步抑制GSK3β、CyclinD1、MYC、NOXA、AKT及ERK蛋白质的生成及功能。
综上所述,CPI203能够杀伤肾癌ACHN细胞,抑制肾癌细胞生长周期进展,其潜在涉及的机制可能通过影响MYC、NOXA、AKT、ERK、GSK3β、CyclinD1等基因的表达有关。所以,CPI203是治疗肾癌的潜在新药物,为肾癌治疗方案的选择开辟出新道路。

