益生菌VSL#3对DSS大鼠结肠炎TLR4-NF-κB通路的调节作用
张孟爽 牛敏 刘淑敏 杜娜 尧静 陈辞言 杜艳,*
(1 中国云南省检验医学重点实验室,云南省实验诊断研究所,昆明医科大学第一附属医院医学检验科,昆明 650032;2 菏泽市立医院,菏泽,274100;3 云南省中医医院检验科,昆明 650021)
溃疡性结肠炎(ulcerative colitis,UC),是一种慢性非特异性结肠炎症,属于炎症性肠病(Inflammatory bowel disease, IBD)的一种,在我国患病率逐年上升,其特点是反复发作,迁延不愈,导致患者生活质量较低。UC的病因及发病机制不清,肠道微生物与该病的发生发展密切相关[1-2]。UC发病机制可能为肠道菌群失调以及肠黏膜屏障功能缺陷,肠道致病菌侵入黏膜下层,激活机体免疫系统,从而导致细胞因子失衡,炎性细胞活化,使肠黏膜产生炎症。此过程可由TLRs介导,通过下游信号传递分子MyD88胞内信号转导,最终导致NF-κB激活和转位,产生致炎因子TNF-α、IL-1β等,进一步破坏肠道免疫稳态导致UC发生。
临床上在使用常规治疗方案的同时,可辅以使用益生菌制剂,从而使UC患者肠道菌群失调程度降低,以减轻患者的炎症反应[3]。VSL#3是一种益生菌混合物,含菌量较高,含有8种常见的人体肠道有益菌种(4种乳杆菌属、3种双歧杆菌属和1种链球菌属),2009年的两项临床试验的结果均显示VSL#3对UC的诱导缓解有效[4-5]。本课题组前期研究也发现益生菌VSL#3能修复DSS诱导的结肠炎大鼠受损的结肠组织,缓解炎症症状,并可有效降低结肠组织促炎因子IL-6,TNF-α的含量,提高抗炎因子TGF-β、IL-10的含量,阻断炎症反应,缩短炎症持续时间。益生菌VSL#3可以降低肠道菌群失调严重程度,一定程度降低菌群失调率,提高双歧杆菌、拟杆菌等益生菌的比例[6]。综上所述,益生菌VSL#3的治疗作用是否与TLR-4通路有关值得进一步探讨。
为了深入研究益生菌VSL#3对UC免疫信号通路TLR4-NF-κB的免疫调节机制,本研究使用DSS构建溃疡性结肠炎大鼠模型,然后采用real-time PCR、Western-Blot检测结肠组织中该通路上下游因子的表达情况,同时使用ELISA检测治疗前后大鼠血清中致炎因子TNF-α、IL-1β水平的变化。
1 材料和方法
1.1 动物
健康6~7周龄雄性Sprague-Dawley(SD)大鼠,体重180~220g。实验正式开始前7d适应环境。实验动物伦理审批号: SCXK(滇)k2015-0002。
1.2 分组
动物模型构建:称取DSS 50g,加入去离子水定容至1000mL,配制成5%DSS溶液,根据实际饮用量,每日新鲜配置,自由饮用一周。7d后,DSS造模组自由饮用去离子水1周,益生菌治疗组使用益生菌VSL#3(菌量为105cfu/天)灌胃一周,第8天处死大鼠,收集大鼠的血清和结肠组织。具体分组情况如下:33只大鼠随机分组,A:空白对照组(3只);B:DSS造模组(15只);C:益生菌VSL#3治疗组(15只)。
1.3 仪器与试剂
ABI7500型定量PCR仪(美国ABI公司),Biorad转膜槽(美国Bio-rad公司),紫外分光光度计(美国Thermoscientific公司),化学发光成像仪(美国Bio-rad公司),酶标仪(美国Bio-rad公司)。硫酸葡聚糖钠(美国MPBIO),益生菌VSL#3(美国Ferring Pharmaceuticals Inc),Eastep®Super总RNA提取试剂盒、GoScript反转录试剂盒以及GoTaq®qPCR Master Mix均为普洛麦格(北京)生物技术有限公司,TLR4 兔抗鼠抗体(SANTA),NF-κB p65兔抗鼠抗体(proteintech)。Rat IL-1beta ELISA Kit(联科生物),Rat TNF-α ELISA Kit(联科生物)。
1.4 方法
1.4.1 疾病活动指数及组织学评分
计算疾病活动指数(DAI评分)以及组织学评分,评分标准见表1~2。体重下降=(当日体重-造模结束时体重)/ 造模结束时体重
1.4.2 实时荧光定量PCR检测结肠组织MyD88、TNF-α、IL-1β、TLR4、NF-κBmRNA的表达
RNA的提取使用普洛麦格总RNA提取试剂盒,按照说明书进行操作。引物序列如下(表3)。
1.4.3 Western-Blot检测结肠组织中TLR4、NF-κB p65的表达
把组织剪切成细小的碎片,使用液氮将组织充分研磨,称取20mg组织于无菌EP管内,加入150μL RIPA裂解液(已加入PMSF),充分裂解后,14000g离心5min,取上清,分装,做好标记放于-80℃保存。使用BCA法测定蛋白浓度。然后制备SDS-PAGE凝胶,蛋白变性,电泳(压缩胶80V 30min,分离胶120V 1h),转膜(湿转,120V 1h, PVDF膜),封闭,抗体孵育等,经ECL发光后,于成像系统拍照。

表1 DAI评分表Tab.1 DAI score
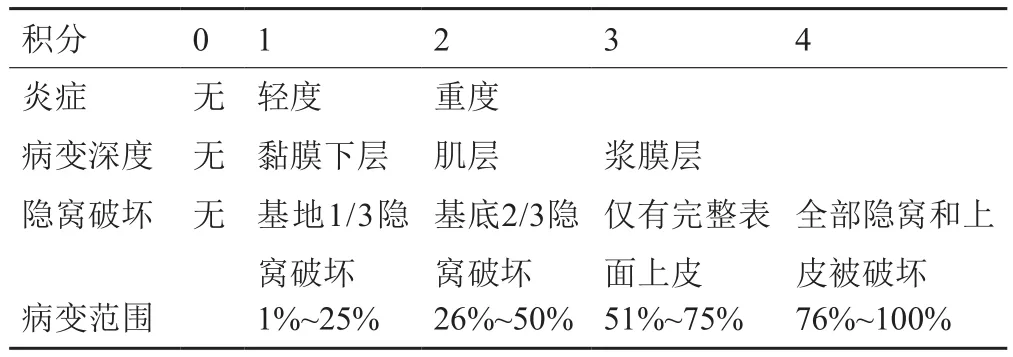
表2 组织学损伤评分标准Tab.2 Histology injury score

表3 引物序列Tab.3 Primer sequence
1.4.4 ELISA检测大鼠血清中TNF-α、IL-1β蛋白的表达
分离管分离血清,取血后使血样凝集30min,1000g离心10min。分装,储存于-20℃冰箱(减少冻融次数)。实验开始前取出冷冻样本,恢复至室温,缓慢混匀。具体操作步骤按照试剂盒说明书进行,计算OD值,利用软件进行回归拟合以生成标准曲线,使用回归分析确定最佳拟合曲线
1.4.5 统计学处理
使用IBM spss 24统计学软件包。实验数据采用均数±标准差(x±s)表示,组间差异比较用方差t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 疾病活动指数及组织学评分
2.1.1 一般情况
除空白对照组外,自由饮用5%DSS的第4天,几乎所有大鼠均出现肉眼血便,继续饮用5%DSS至7d。从8d开始,VSL#3治疗组使用益生菌VSL#3进行灌胃治疗。在益生菌治疗过程中,空白对照组大鼠毛色光滑,正常进食,大便成型;DSS造模组大鼠食量减少,毛色干枯无光泽,稀便,部分大鼠出现黏液脓血便或血便,肛门口可见血迹;VSL#3治疗组大鼠毛色欠光滑,反应欠灵活,腹泻或血便,但与DSS造模组相比,情况较好。经过益生菌VSL#3治疗一周后,益生菌治疗组DAI积分与DSS模型组相比,显著降低(t=1.8,P=0.001),差异具有统计学意义。
2.1.2 病理学评分
益生菌治疗一周后,取大鼠结肠组织,进行苏木素-伊红染色(HE染色)。HE染色部分图片如图1所示。空白对照组大鼠结肠黏膜上皮细胞连续性完整,隐窝未破坏,腺体排列整齐,固有层无炎症细胞浸润;DSS造模组结肠黏膜有多处糜烂及溃疡灶,腺体不同程度增生且排列紊乱,伴有隐窝脓肿或隐窝炎,固有层可见大量以淋巴细胞为主的炎症细胞浸润;VSL#3治疗组肠黏膜病理学损伤均有不同程度的缓解,结肠黏膜的糜烂溃疡灶及隐窝炎和隐窝脓肿明显减少,病变范围缩小,炎症细胞浸润亦显著减少。对大鼠结肠组织病理切片进行组织学评分:空白对照组大鼠大肠组织学损伤评分为零,DSS造模组评分最高,为7.8±1.04。益生菌治疗组评分为5.4±0.8,低于DSS造模组,差异具有统计学意义(P=0.001)。HE染色部分图片如图1所示。
2.2 Real-time PCR结果
与空白对照组相比,DSS造模组大鼠结肠组织TLR4、NF-κB、TNF-α、IL-1βmRNA的表达显著增强(P<0.01),经益生菌VSL#3治疗后,与DSS造模组相比益生菌治疗组大鼠结肠组织TLR4、NF-κB、TNF-α、IL-1βmRNA的表达降低(P<0.05)。各因子相对表达量见表4。
2.3 Western-Blot 结果

图1 大鼠结肠组织HE染色(×400)Fig.1 Histology were observed under the microscope graph(×400)
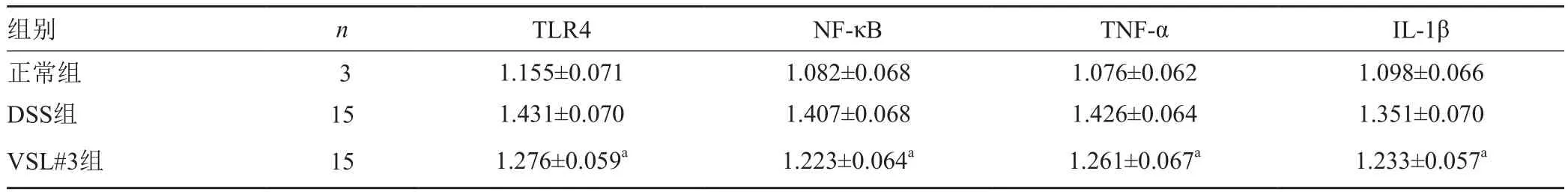
表4 各因子3组相对表达量差异比较(x±s)Tab.4 Relative expression of each factor (x±s)
Western-blot检测结肠组织中TLR4、NF-κB p65的表达,BCA定量,蛋白上样量为50μg, DSS造模组TLR4、NF-κBp65蛋白的相对表达量最高,分别为0.847±0.057,1.873±0.129,与正常组相比,差异具有统计学意义(P<0.05)。经过益生菌VSL#3治疗一周后,与造模组相比,TLR4、NF-κB蛋白的相对表达量降低,差异具有统计学意义(P<0.05)。蛋白表达情况见图2。
2.4 ELISA结果
使用ELISA检测大鼠血清IL-1β和TNF-α表达水平,DSS造模组血清IL-1β和TNF-α的表达最高,经益生菌VSL#3治疗一周后,与DSS造模组相比益生菌治疗组血清IL-1β和TNF-α的表达显著降低(P<0.001)。结果见表5。

图2 各组TLR4和NF-κB p65蛋白表达情况Fig.2 Protein expression of TLR4 and NF-κB p65
3 讨论
目前认为,肠道菌群的改变是诱发和维持结肠炎症的主要原因。Macfarlane等[7]应用16S rRNA探针荧光原位杂交法研究UC患者直肠活检标本中的菌群发现,双歧杆菌比正常对照减少约30倍,且UC患者与正常对照中双歧杆菌优势菌群亦有明显不同。本课题组前期研究也有类似发现:溃疡性结肠炎患者肠道菌群失调率和菌群失调程度明显高于健康对照组;益生菌优势生长率降低,需氧和厌氧的条件致病菌优势生长率增加[8]。从大量的临床和基础研究结果我们可以发现,益生菌可以通过调节失衡的肠道菌群,发挥其对溃疡性结肠炎的治疗作用。本研究中,经过益生菌VSL#3治疗一周后,治疗组大鼠腹泻、血便等症状减轻,体重下降幅度降低,DAI评分明显降低,肠黏膜缺失减少,固有层炎症细胞浸润减少等,说明益生菌VSL#3对DSS诱导的结肠炎大鼠有治疗效果。

表5 大鼠血清TNF-α、IL-1β的表达水平(pg/mL)Tab.5 Expression of TNF-α and IL-1β protein in rat serum (pg/mL)
TLR属于I型跨膜蛋白受体,目前发现的TLR有13种,其中TLR-4主要识别革兰阴性菌的脂多糖(LPS)[9]。NF-κB是一种核转录因子,与免疫和炎症反应、 细胞生长、病毒感染等密切相关。NF-κB在细胞质中与它的抑制因子I-κB结合,以不活动的状态存在,当细胞受到刺激时,NF-κB的抑制因子I-κB磷酸化,将NF-κB从I-κB复合物中释放出来,释放出来的NF-κB从细胞质进入细胞核中,与特异性的结合位点结合,调控其靶基因的转录。肠道菌群失调以及肠黏膜屏障功能缺陷,使肠道致病菌侵袭黏膜下层,在各种微生物抗原刺激下,激活体内免疫系统,细胞因子释放失衡,活化各种炎症细胞致肠黏膜组织产生炎症反应。该过程可由TLRs介导,通过下游信号传递分子MyD88胞内信号转导,最终导致NF-κB激活和转位,产生致炎因子TNF-α、IL-1β等,进一步破坏肠道免疫稳态导致UC发生。何斌等[10]研究发现,UC患者外周血中单核细胞中TLR4和NF-κB呈高表达状态,且TLR4的表达与NF-κB的表达密切相关。
空白对照组大鼠结肠组织TLR4 、NF-κB、TNF-α、IL-1β mRNA仅有少量表达,血清TNF-α、IL-1β水平较低,DSS造模成功后,大鼠结肠组织中TLR4、NF-κB等分子在mRNA水平的表达明显升高,同时ELISA结果显示血清中释放的TNF-α、IL-1β水平显著升高,证明DSS诱导结肠炎形成的过程中,TLR4信号通路被激活,从而引起该通路下游因子TNF-α、IL-1β和炎性介质大量释放,导致结肠组织损伤,结肠炎形成。经灌胃给予益生菌VSL#3治疗1周后,大鼠结肠组织TLR4、NF-κB、TNF-α、IL-1βmRNA的表达降低,同时血清中TNF-α、IL-1β的水平也显著降低。该结果提示益生菌VSL#3可抑制TLR4-NF-κB信号通路基因的激活,使其下游细胞因子和炎症介质释放减少,减轻结肠炎症损伤,从而发挥其对溃疡性结肠炎的治疗作用。

