ε-聚赖氨酸对白念珠菌抑菌活性及机制研究
余甜 时文静 谢跃 李可可 邹凤梅 刘刚 李军春 张兴旺 魏莲花,*
(1 甘肃中医药大学,兰州 730000;2 宁夏医科大学,银川 750004;3 甘肃省人民医院检验中心,兰州 730000)
白念珠菌(Candida albicans),又称白假丝酵母菌,广泛存在于自然界,多寄生于人体皮肤、黏膜、口腔,上呼吸道以及阴道等部位,正常情况下酵母相在显微镜下呈圆形或者椭圆形,与机体处于共生状态,属于机会性致病菌。近年来,随着艾滋病、恶性肿瘤患者的增多,导尿管或静脉置管及内镜微创技术的开展,高效广谱抗生素、器官移植术后免疫移植抑制剂、以及激素的应用等多种因素,真菌感染已经是临床不能忽视的重要问题,而白念珠菌为代表的念珠菌病是其中的热点问题[1]。生物膜是白念珠菌一个重要致病因子。研究表明,与浮游细胞相比,生物膜形成的基质-胞外多聚化合物(EPS)具有强大的屏障作用,因而对抗菌剂耐药性更强[2]。ε-聚赖氨酸(ε-poly-L-lysine, ε-PL)是天然抗菌物质,对许多细菌和真菌均有较好的抑制作用,但关于ε-PL对白念珠菌的抑制作用文献几乎没有报道[3]。本研究以白念珠菌为研究对象,测定ε-聚赖氨酸对白念珠菌的抑菌活性,以及对白念珠菌生物膜抑制作用,初步探究其抑菌机制,为临床抗真菌药物的研发提供新思路。
1 材料
1.1 菌株
标准菌株(ATCC64548和ATCC64550)由甘肃省人民医院检验中心微生物实验室保存,50株临床菌株由甘肃省人民医院检验中心从阴道、粪便、痰、肺泡灌洗液等标本中分纯,使用质谱仪鉴定为白念珠菌,纸片法-80℃保存。
1.2 试剂
ε-聚赖氨酸(郑州拜纳佛生物工程股份有限公司),沙保弱培养基(英国,Oxoid)、RPMI1640液体培养基(美国,Gibco),结晶紫染料(珠海迪尔生物工程有限公司),酵母菌提蛋白试剂盒(上海生工),活性氧(ROS)测定试剂盒(万类生物)、丙二醛(MDA)测定试剂盒(万类生物),BCA总蛋白测定试剂盒(索莱宝)。
1.3 设备
德国布鲁克(MALDI-TOF)飞行质谱仪,酶标仪(瑞士Sunrise),紫外分光光度计(上海菁华科技有限公司),荧光显微镜(日本,Olympus)。
2 方法
2.1 MIC和MFC测定
采用CLSI-M27文件中微量稀释法测定抗真菌药物的最小抑菌浓度(minimal inhibitory concentration,MIC),质控菌株为近平滑念珠菌(ACTT22019),使用酶标仪读取MIC值[4],以真菌抑制百分数为80%的最小浓度孔为真菌的MIC。将MIC实验中每株菌的不同孔培养混合物涂布在沙保弱培养基上,25℃培养48h后无菌落形成的最小药物浓度即为最小杀菌浓度(minimal bactericidal concentration, MFC)。
2.2 SMIC50测定
使用结晶紫染色法筛选白念珠菌标准菌株(ATCC64548和ATCC64550)和50株临床中具有生物膜形成能力的菌株。在筛选出具有生物膜能力菌株中随机抽取16株临床菌株以及1株标准菌株,进行SMC50测定实验。SMIC50测定方法参考冯凡等[5]实验方法制备生物膜模型后,分别在实验孔和空白对照孔加入药液和培养基,37℃,75r/min震荡培养48h后,干燥固定后结晶紫染色3h,蒸馏水冲洗直至无色,干燥2h后每孔150μL加入30%冰醋酸,待其完全溶解后测A590值。生物膜抑制百分数为50%的最小浓度孔为真菌的SMIC50。
2.3 浮游菌株时间生长曲线和生物膜时间生长曲线
浮游菌株时间生长曲线:将保存的白念珠菌标准菌株(ATCC64548和ATCC64550)活化后,使用RPMI1640将其稀释成2×106CFU/mL,然后稀释100倍使其浓度变成2×104CFU/mL,将菌悬液中加入不同浓度ε-PL,37℃,200r/min 震荡培养,分别在不同时间点吸取各体系中100μL液体,加入96孔板中测定吸光度A590值,并绘制时间生长曲线。
生物膜时间生长曲线:将保存的白念珠菌标准菌株(ATCC64548和ATCC64550)使用“2.2”项方法制备生物膜模型后,加入100μL的RPMI 1640培养基和100μL不同浓度的ε-PL,37℃,75r/min震荡培养,不同时间点测定生物膜形成情况(方法同“2.2”项),并绘制时间生物膜抑制-时间曲线[6]。
2.4 ε-PL对菌丝和芽管抑制作用
将保存的白念珠菌ATCC64548活化后,使用生理盐水配制为2×106CFU/mL,取菌液500μL加入到含4mL牛血清试管中,再加入不同的浓度药物500μL,37℃恒温中200r/min震荡培养,每隔2h取一接种环的培养物涂布在玻片上,显微镜下观察并测定菌丝的长度及平均值。芽管生长的判断标准:计数芽管形成百分率时,芽管生长的长度超过菌体直径2倍以上为正常生长芽管;芽管长度低于菌体直径2倍者,认为芽管受抑制。计数过程中使用OLYMPUS显微镜系统上测定有正常生长芽管长度,每次3个人同时测定芽管长度及计数[7]。
2.5 测定ε-PL诱导白念珠菌产生活性氧(ROS)含量
将活化后白念珠菌标准菌株ATCC64548配置成2×106CFU/mL后,取500μL加入到含4mL的RPMI1640培养基中,再加入不同的浓度药物500μL,37℃恒温中200r/min震荡培养12h后,取菌悬液3mL,3000r/min离心10min,收集菌体,用PBS洗涤3次后,将菌体重悬于PBS中,浓度为2×106CFU/mL,取500μL重悬好的菌液,在暗室中加入5μL浓度为1mmol/L的DCFH-DA使终浓度为10μmol/L,涡旋震荡均匀,于37℃培养孵育2h,每隔3~5min钟震荡混匀,使探针和菌体充分混匀。用5000g离心5min,收集菌体,用PBS洗涤1次,收集菌体沉淀后重悬于250μL PBS液中,混匀后取10μL置于玻片上,使用荧光显微镜观察[8]。
2.6 测定ε-PL对白念珠菌的脂质氧化程度
白念珠菌ATCC64548活化后,使用生理盐水配置成2×106CFU/mL,将菌株分成A组和B组,A组的处理方法与“2.6”项相同,B组在A组基础上加入10mmol/L N-乙酰半胱氨酸(NAC),将两组让37℃200r/min震荡培养12h后,10000r/min离心5min收集菌体,采用酵母菌提蛋白试剂盒提取总蛋白,然后使用BCA蛋白测定试剂盒测定总蛋白浓度。采用脂质氧化(丙二醛,MDA)检测试剂盒测定脂质氧化损伤情况,每组实验重复3次[8]。
3 实验结果
3.1 MIC和MFC以及SMIC50测定结果
ε-PL对白念珠菌标准菌株ATCC64548(氟康唑敏感株)、ATCC64550(氟康唑耐药株)和50株临床菌株的MIC80和MFC的浓度分别是512和1024μg/mL(表1和图1)。在筛选具有生物膜形成能力菌株后,对随机抽取的1株标准菌株和16株临床菌株的生物膜抑制浓度SMIC50也为512μg/mL,此浓度下ε-PL对生物膜抑制率平均为58%。
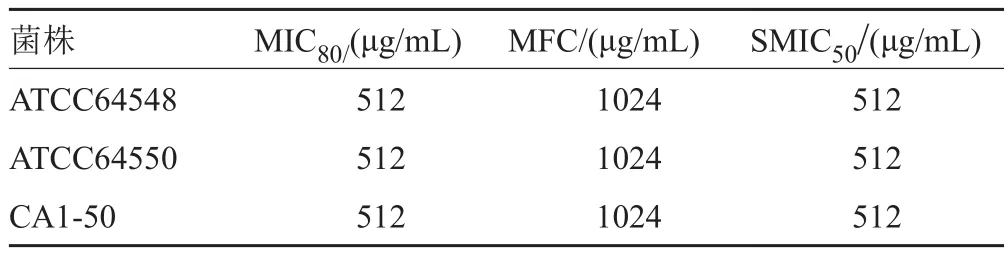
表1 ε-PL对白念珠菌抑菌作用Tab.1 Antibacterial effect of ε-PL on Candida albicans
3.2 时间生长曲线及生物膜抑制时间曲线
用不同浓度ε-PL处理白念珠菌浮游菌株及生物膜,分别测定浮游菌的A590值及结晶紫法测定生物膜厚度,以绘制不同时间下药物对浮游菌株和生物膜的抑制活性。结果显示48h的生长周期中,ε-PL的对白念珠菌浮游菌株及生物膜均具有明显抑制作用,抑制效果与药物浓度呈现正相关,并且在氟康唑敏感株和耐药株之间并无明显差异。从两组图中可以明显看出作用时间在12h前后,白念珠菌的浮游菌株及生物膜均表现出明显抑制作用(图2~3)。
3.3 ε-PL对菌丝和芽管抑制作用
白念珠菌的菌丝是其重要的毒力因子,在致病中发挥重要的作用。本实验通过白念珠菌的出芽率及4h内的芽管长度衡量ε-PL对白念珠菌菌丝的抑制作用,并通过显微镜记录了牛血清培养基中白念珠菌酵母相向菌丝相转变情况[7]。实验结果(图4)表明MIC和MFC浓度下白念珠菌的芽管出芽率及长度的具有明显的抑制作用,并且其抑制作用呈现剂量依赖(P<0.05);低浓度的ε-PL对菌丝没有明显抑制作用(P>0.05)。显微镜下4h内芽管图片结果(图5)表明,空白组芽管在2h后可见大量菌丝的缠绕,MIC和MFC浓度下出芽率较低,几乎均呈现酵母相;在4h时,低浓度组和空白组均出现菌丝,MIC和MFC芽管出芽率依旧保持低水平且芽管长度较小。
3.4 ε-PL对白念珠菌的氧胁迫作用
使用荧光探针DCFH-DA测定白念珠菌与不同浓度的ε-PL在37℃共培养12h后产生ROS的含量,研究ROS的氧化损伤与ε-PL浓度的关系。不带荧光的DCFH-DA探针可以自由的进入细胞膜内,进入细胞膜后被细胞内的脂酶氧化为DCFH。而DCFH探针不能穿透细胞膜,会被细胞内产生的ROS生成有荧光的DCF,通过测定荧光的强度衡量ROS含量。如图6所示,与空白组相比,不同浓度ε-PL作用于白念珠菌后产生的ROS的含量随着浓度的升高而升高。当ε-PL浓度达到MIC时,ROS的生成率约占93.7%。
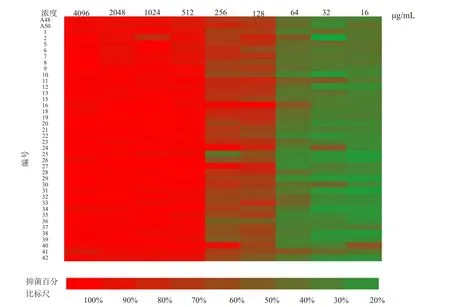
图1 ε-PL对白念珠菌抑菌作用热图Fig.1 Heat map of antimony effect of gallium-PL on Candida albicans

图2 不同浓度ε-PL对白念珠菌的生长的影响Fig.2 Effects of different concentrations of ε-PL on the growth of Candida albicans
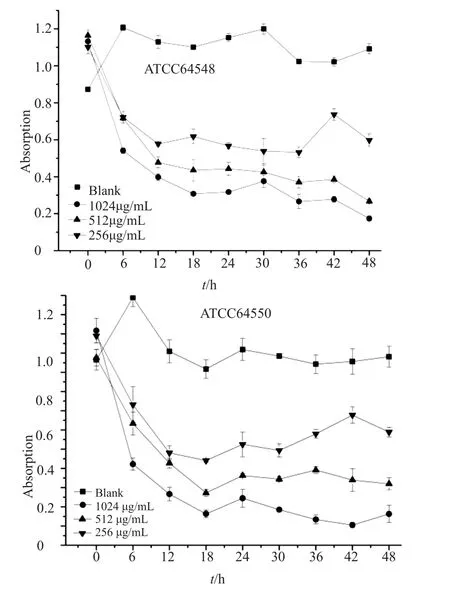
图3 不同浓度ε-PL对白念珠菌生物膜形成的影响Fig.3 Effects of different concentrations of ε-PL on biofilm formation of Candida albicans
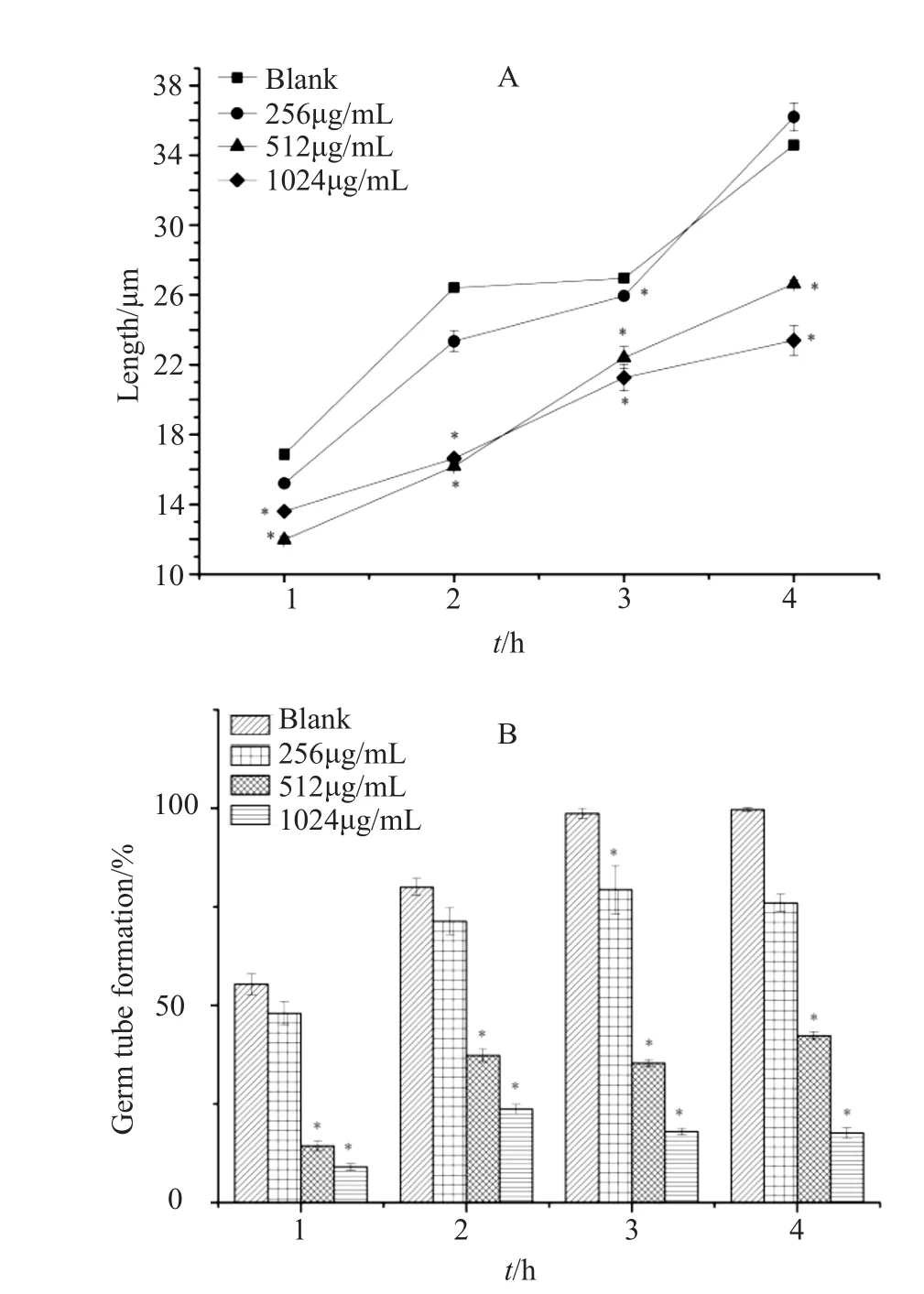
图4 不同浓度ε-PL对白念珠菌芽管长度(A)和芽管形成率(B)影响Fig.4 Effects of different concentrations of ε-PL on the tube formation rate (A) and tube length (B) of Candida albicans

图5 不同浓度ε-PL对白念珠菌酵母-菌丝转化影响Fig.5 Effects of different concentrations of ε-PL on the transformation of Candida albicans yeast-mycelium(×400)
3.5 ε-PL对白念珠菌脂质氧化损伤作用
为了进一步研究ROS和白念珠菌的膜氧化损伤的关系,分别测定“2.6”项实验处理后MDA含量,以及在“2.6”项实验基础上加入抗氧化剂NAC后MDA含量。MDA是膜脂质过氧化的主要产物,也是白念珠菌膜系统遭受压力重要标志之一。研究表明:不同浓度ε-PL均可引起白念珠菌膜出现脂质过氧化损伤(图7)。用512μg/mL的ε-PL作用后,MDA含量是对照组7倍左右。在加入抗氧化剂前,MDA的含量与ε-PL浓度呈正相关。在加入抗氧化剂后,MDA含量与之前相比明显下降。
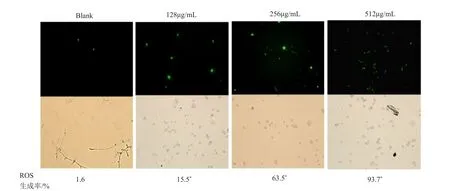
图6 不同浓度ε-PL作用白念珠菌后ROS含量(×200)Fig.6 ROS Content of Candida albicans after different concentrations of P-PL(×200)

图7 不同浓度ε-PL作用白念珠菌后MDA含量Fig.7 MDA content in Candida albicans after different concentrations of P-PL
4 讨论
近年来,随着艾滋病及恶性肿瘤患者的增多,导尿管或静脉置管及内镜微创技术的开展,高效广谱抗生素以及器官移植术后免疫移植抑制剂和激素的应用等多种因素,真菌感染已经是临床不能忽视的重要问题,而白念珠菌为代表的念珠菌病是其中的热点问题。从中国侵袭性真菌监测网(CHIF-NET)发布的数据来看(2009—2014年):白念珠菌(3965株,44.9%),近平滑念珠菌(1762, 20%)、热带假丝酵母(1515.17.2%)分列前3位。我国的真菌耐药率高于世界水平:伏立康唑耐药率显著上升,耐药率由19%上升至21.3%;伏立康唑交叉耐药率从5.8%上升至6%[9]。其中生物膜形成是白念珠菌重要的耐药原因,也是大部分白念珠菌深部感染出现慢性感染及复发的原因。ε-PL是一种天然抗菌肽,由于其广谱的抗菌活性、无毒无味以及稳定性高等特点现广泛应用于食品防腐中[10]。本研究通过实验进一步证实ε-PL对白色念珠具有明显抑菌作用,尤其是对其生物膜形成有显著抑制作用,通过ROS和MDA测定初步证实ε-PL对白念珠菌的抑菌活性是通过氧胁迫发挥作用。
本研究首先通过微量稀释法测定了白念珠菌MIC和MFC值,发现ε-PL在512μg/mL是可以抑制白念珠菌生长,菌悬液涂布法检测结果表明1024μg/mL可完全杀死白念珠菌,因此可以确定其MIC和MFC值分别为512和1024μg/mL。实验进一步绘制了ε-PL对白念珠菌作用下的时间生长曲线,结果表明ε-PL对白念珠菌的抑制作用呈现明显的剂量依赖,并且在ATCC64548(氟康唑敏感株)和ATCC64550(氟康唑耐药株)无明显差异。SMIC50测定实验结果表明ε-PL在512μg/mL ε-PL下可明显抑制生物膜的形成,这表明ε-PL对生物膜的抑制作用较为显著。曾贝妮[11]在舒洛地尔对白念珠菌生物膜抑制作用研究中表明SMIC50浓度通常在浮游菌株MIC浓度的3~4倍,相比之下ε-PL对生物膜的抑制作用具有明显优势。通过绘制生物膜时间-抑制曲线表明ε-PL对生物膜的抑制作在后12h即可发挥明显的抑制作用。菌丝是白念珠菌重要的毒力因子,不仅是白念珠菌生物膜的重要组成部分芽,也是其发挥致病作用的物质基础。本研究中,通过对其芽管形成率、芽管长度、以及酵母-菌丝相转化等方面的考量,结果表明ε-PL在MIC和MFC浓度下,对白念珠菌的芽管形成率有显著的抑制作用(P<0.05)。在液态培养基中,ε-PL白念珠菌的酵母-菌丝转化也具有明显抑制作用。
现阶段关于ε-PL机制研究中绝大多数研究者认为ε-PL对病原体的抑菌作用主要通过毡毯模型中所描述膜损伤机制导致菌体死亡[12]。本实验证实ε-PL作用于菌体后,白念珠菌内ROS含量增长,这种现象也出现ε-PL作用于大肠埃希菌中,这与文献中报道的其他抗真菌剂通过促进ROS的增多来发挥杀菌效果相一致[13-14]。ROS是一类高反应性的小分子,包含有氧衍生自由基等超氧阴离子(O2-)和羟基自由基(OH-),或非自由基分子,如过氧化氢(H2O2)。本实验结果表明ε-PL作用白念珠菌后,ROS和MDA含量均随着ε-PL浓度的增加而增加,在加入抗氧化剂后,MDA含量均出现了显著下降。推测ε-PL作用于菌体产生的ROS和菌体膜脂质氧化损伤有密切相关。换言之,ε-PL作用于白念珠菌后导致菌体内过量ROS,ROS对菌体的细胞膜胁迫出现丙二醛(MDA)含量的增加。丙二醛可以与白念珠菌内的核酸和蛋白质反应,从而改变他们的结构和生物学特征,Bo等[15]也支持这个观点。叶若松等[8]在研究ε-PL对大肠埃希菌机制研究中,表明-PL诱导大肠埃希菌ROS升高,以及氧胁迫基因oxyR、sodA等基因表达量上升。Liu等[16]推测ε-PL作用于白念珠菌产生的大量ROS有可能是诱导菌体凋亡的原因,但是具体的分子机制还没有进行研究。
ε-PL具有较高的水溶性、无毒性、以及稳定性等特点,现阶段成熟的生物工程制备模式让其也具有经济性的特点。本实验初步证实了ε-PL对白念珠菌具有良好的抑制作用,同时对菌丝及生物膜等重要毒力因子具有显著的抑制作用。同时初步证实了ε-PL作用于白念珠菌后增加ROS产生发挥抑菌作用。

