血流感染肺炎克雷伯菌中CRISPR-Cas系统的分布及其与毒力基因和耐药的关系
杜芳玲 黄先琪 魏丹丹 梅艳芳 刘盼盼 刘洋,* 万腊根
(1 南昌大学第一附属医院检验科,南昌 330006;2 南昌大学公共卫生学院,南昌 330006)
肺炎克雷伯菌是临床常见的条件致病菌之一,近年来呈现多耐药、高毒力特点,严重危害人类健康。在肠杆菌科中,肺炎克雷伯菌是仅次于大肠埃希菌的血流感染病原菌[1]。由成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats, CRISPR)及其相关序列(CRISPR-associated sequences, Cas)组成的CRISPR-Cas系统是新发现的原核生物获得性免疫系统,具有调控细菌耐药和毒力的重要作用[2],但具体的作用机制不清楚。本研究以血流感染非重复肺炎克雷伯菌248株为研究对象,阐述了血流感染肺炎克雷伯菌中CRISPRCas系统的分布及其与毒力基因和耐药的关系。
1 材料与方法
1.1 菌株来源及鉴定
收集南昌大学第一附属医院2015年1月—2017年12月分离248株血流感染的非重复肺炎克雷伯菌作为实验菌株,采用Vitek2-Compact全自动细菌鉴定仪进行生化鉴定并保存。
1.2 CRISPR/CAS系统检测
参考Lin等[3]文献,PCR扩增检测cas1、CRISPR1和CRISPR23个基因,引物、体系和条件参照文献进行。cas1阳性及至少1个CRISPR基因座(CRISPR1或CRISPR2)阳性说明CRISPR-Cas系统存在,定义为CRISPR/Cas+,其余为CRISPR/Cas-。
1.3 荚膜血清分型及毒力基因检测
热裂解法提取菌株DNA。对所有肺炎克雷伯菌用PCR方法筛选高毒力荚膜血清型基因(K1、K2、K5、K20、K54和K57)[4],并用PCR方法对其扩增12种常见毒力基因(rmpA,iutA,magA,wcaG,mrkD,,aerobactin,rmpA2,fimH,entB,kfu,ybtS,kpn),PCR的扩增引物、体系和条件参照相关文献进行[5-6]。
1.4 药敏试验和耐药基因检测
体外药物敏感性试验用Vitek2-Compact全自动微生物分析仪开展,参照美国临床实验室标准化研究所(M100-S27)规定的标准对耐药(R)、中介(I) 、敏感(S)的解释。PCR扩增检测13种耐药基因,其中4种碳青霉烯酶基因(blaNDM、blaKPC、blaVIM和blaOXA-48)、3种β-内酰胺酶基因(blaSHV、blaCTX-M-14和blaTEM)、2种16S rRNA甲基化酶基因(armA和rmtB),4种PMQR基因(acc(6')-Ib-cr、qnrA、qnrB和qnrS),PCR的扩增引物、体系和条件参照文献[7]进行。
1.5 统计分析
使用SPSS 21统计软件进行统计分析,根据是否携带CRISPR-Cas分为两组,对其荚膜血清分型、毒力基因、抗菌药物的耐药性、耐药基因、进行比较。由于是计量资料使用χ2检验进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 CRISPR-Cas系统检测、荚膜血清分型及毒力基因分布
248株血源性肺炎克雷伯菌中,携带有CRISPRCas系统菌株共74株,阳性率为 29.8%(74/248),高毒力荚膜血清型69株,阳性率为27.8 %(69/248),且主要为K1型(23株,33.3%)、K2型(21株,30.4%)和K54(11株,15.9%),其余为K5型(1株,1.4%)、K20(4株,5.8%)和K57(9株,13.0%),其中携带CRISPR-Cas与的高毒力血清型肺炎克雷伯菌29株,阳性率为11.7%(29/248)。此外,7种毒力基因中检出率最 高为fimH(94.8%),其次为mrkD(92.3 %)(表1)。
2.2 CRISPR-Cas系统与荚膜血清分型、毒力基因的关系
高毒力荚膜血清型菌株在CRISPR-Cas+与CRISPR-Cas-菌株中的阳性率分别为39.2%(29/74)和23.0%(40/174),两者比较差异有统计学意义(P<0.01),K1型是携带CRISPR-Cas系统肺炎克雷伯菌的主要荚膜血清分型,占 28.4%(21/74)。除kpn基因外,携带CRISPR-Cas系统菌株的毒力基因的检出率均大于不携带CRISPR-Cas系统菌株,其中7种(rmpA、iutA、magA、wcaG、aerobactin、rmpA2和kfu)差异有统计学意义(P值均小于0.05)(表1)。
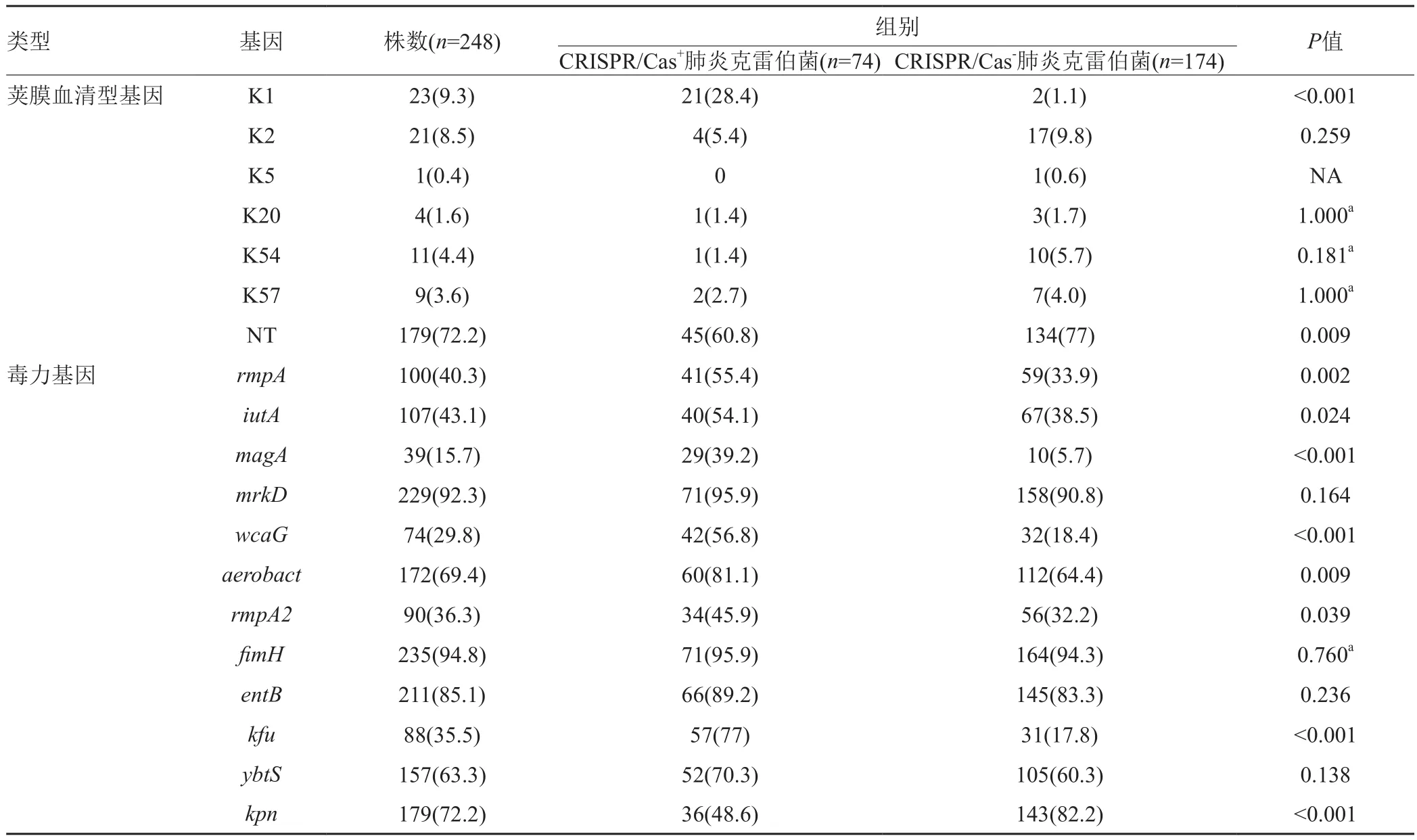
表1 CRISPR-CAS、K分型及毒力基因携带[n(%)]Tab.1 Detection of CRISPR-CAS, capsular serotypes and virulence genes [n(%)]
2.3 药敏结果及其与CRISPR-Cas系统的关系
药敏结果显示,除对氨苄西林耐药率达100%外,携带有CRISPR-Cas系统菌株对于其他抗菌药物的耐药率均小于不携带有CRISPR-Cas系统菌株,其中12种(头孢唑林、头孢曲松、头孢他啶、头孢吡肟、哌拉西林/三唑巴坦、氨曲南、阿米卡星、左氧氟沙星、复方磺胺甲噁唑、厄他培南、亚胺培南、美罗培南)差异有统计学意义(P值均小于 0.05)(表2)。
2.4 耐药基因分布及其与CRISPR-Cas系统的关系
PCR扩增耐药基因显示对于blaNDM、blaKPC、blaTEM、blaCTX-M-14、blaSHV、rmtB、qnrB、qnrS、acc(6')-Ib-cr阳性率,携带CRISPR-Cas系统的菌株小于不携带CRISPR-Cas系统的菌株,且blaKPC、blaSHV、qnrS差异有统计学意义(P值均小于0.05)(表3)。
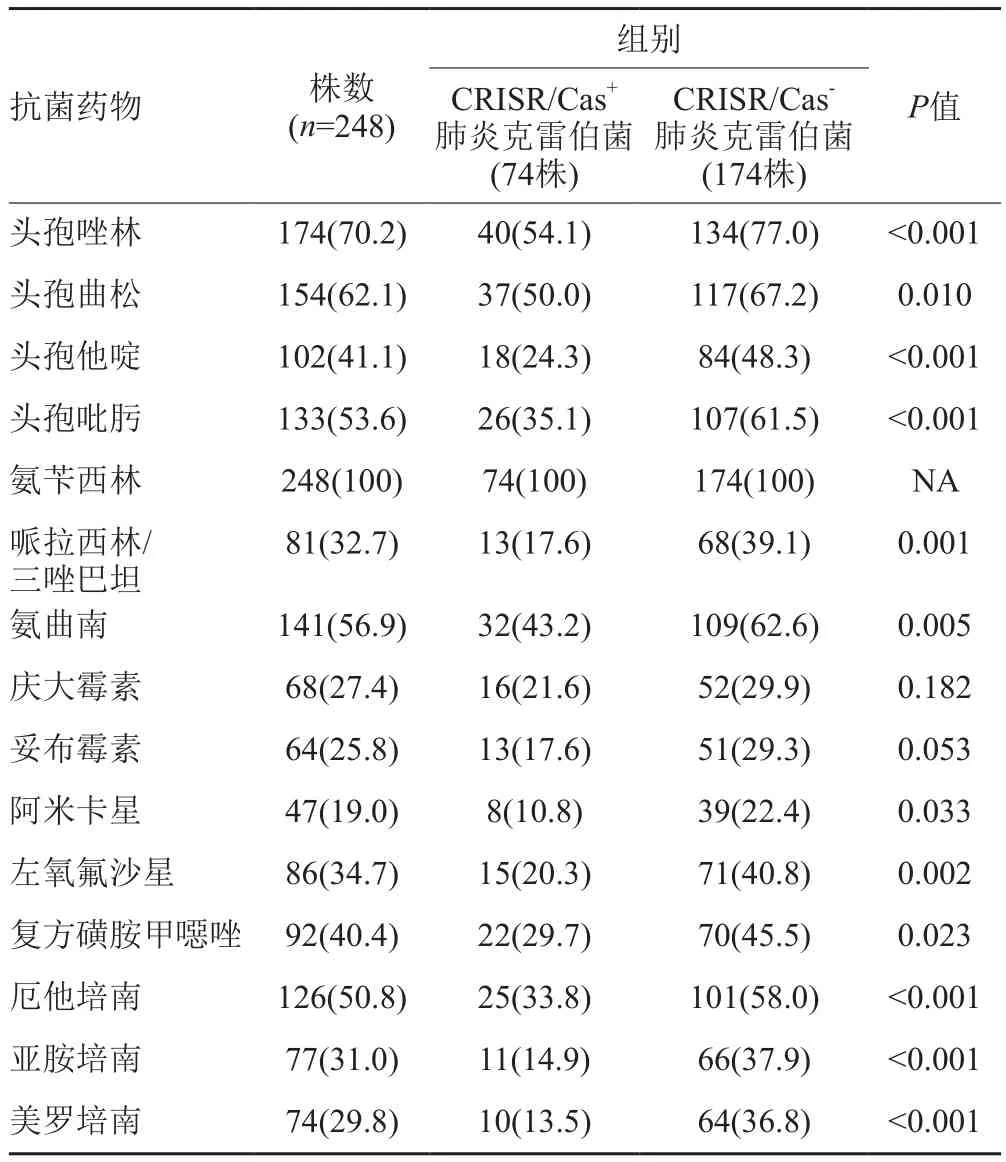
表2 抗菌药物耐药分布[n(%)]Tab.2 Distribution of antimicrobial drug resistance R[n(%

表3 耐药基因携带[n(%)]Tab.3 Detection of resistance gene[n(%)]
3 讨论
CRISPR-Cas系统是细菌在长期演化过程中形成的一种适应性免疫防御,可对抗噬菌体、质粒等外源性DNA[8]。本研究首次分析了血流感染肺炎克雷伯菌中CRISPR-Cas系统的分布情况,并初步探讨了该系统与毒力基因和耐药的关系。
本研究中CRISPR-Cas系统的检出率为29.8%(74/248),比Marth等[9]报道(11.5%)和Lin等[3]报道(12.4%)检出率高。荚膜血清分型结果表明大部分K1(91.3%)携带CRISPR-Cas系统,这与Lam等[10]报道相符:大多数CG23型(n93, 94.9%)肺炎克雷伯菌携带CRISPR/Cas系统。
毒力基因检测结果显示携带CRISPR-Cas系统菌株的毒力基因检出率均大于不携带CRISPR-Cas系统菌株, 其中7种差异有统计学意义,所以携带CRISPR-Cas系统的肺炎克雷伯菌毒力基因检出率更高。CRISPR-Cas系统对存在质粒上的毒力基因iutA、rmpA2等没有剪辑作用有待进一步研究。然而在志贺菌中活性CRISPR-Cas系统的存在与所检测毒力基因的分布无关[11];在肺炎链球菌中,含有荚膜基因的质粒的菌株可以通过CRISPR-Cas系统干扰阻断其质粒进入无毒菌株,从而抑制毒力株的出现[12]。
CRISPR-Cas系统通过Cas蛋白将外源性基因裂解,从而限制基因的水平转移,抵抗噬菌体感染及质粒接合转移等[13]。而肺炎克雷伯菌耐药的主要机制之一是耐药基因的水平转移,目前有关CRISPR与耐药关系的报道在不同的细菌中尚不一致,粪肠球菌中cas1或cas3与多重耐药的获得呈负相关[14];另一研究也发现粪肠球菌的CRISPR-Cas与获得性耐药关相反[15]。但王琳琳等[16]发现志贺菌中CRISPR-S4阳性菌株与阴性菌株之间多重耐药的分布差异无统计学意义;Touchon等[17]发现大肠埃希菌的CRISPER-cas I-E在敏感株和耐药株间无差异,并且耐药质粒仍可以在CRISPR阳性大肠埃希菌之间传播。本研究分析了CRISPR-Cas系统与耐药的分布,药敏结果发现除对氨苄西林天然耐药外,CRISPR-Cas系统与其他抗菌药物的耐药率呈负相关,与Lin等[3]报道相符。耐药基因结果显示携带CRISPR-Cas系统的肺炎克雷伯菌相对于不携带CRISPR-Cas系统菌株耐药基因阳性率低,且KPC、SHV和qnrS差异有统计学意义。
本研究只是初步地探讨了肺炎克雷伯菌中CRISPR-Cas系统与毒力基因和耐药的关系,发现了CRISPR-Cas系统可能能降低耐药基因在肺炎克雷伯菌中的水平传播,尤其是在K1型肺炎克雷伯菌,但其对毒力基因没有剪辑作用还待研究。另外CRISPR-Cas对毒力和耐药的影响机制也还待进一步研究探讨。