HPLC-ELSD法测定硫酸庆大霉素片的组分和有关物质
王立萍 姚永青 梅芊 李杨 刘英
(河南省食品药品检验所,郑州 450008)
庆大霉素为美国Schering公司Weinstein等[1]于1963年发现,1966年其硫酸盐应用于临床,1965年我国中科院福建微生物研究所分离得到产生菌,1969年经研制成功后并投入生产[2],早期剂型为注射剂。由于硫酸庆大霉素口服基本不吸收,但在肠道中能达高浓度,片剂和颗粒剂开始上市,临床应用于治疗细菌性痢疾或其他细菌性肠道感染,亦可用于结肠手术前准备。
硫酸庆大霉素片目前仅国内生产,包括素片、薄膜衣片及糖衣片。其口服吸收性差,在胃肠道中浓度较稳定而持久,主要以原型随粪便排出。庆大霉素主要由C1、C1a、C2和C2a4个活性成分组成,另外还有次要组分如西索米星、庆大霉素C2b等[3]。各组分的毒性和抗菌能力有一定的差异[4],各组分相对含量的变化关系着产品的疗效和毒副作用,为保证药物使用的安全性、有效性,应对硫酸庆大霉素组分和有关物质进行控制。硫酸庆大霉素注射液,伴随着药典标准的不断完善与提高,其严重不良反应明显降低[5]。
中国药典2015年版二部收载硫酸庆大霉素片[6],国外药典均未收载该剂型。中国药典2015年版二部收载的硫酸庆大霉素原料和注射液均采用HPLC-ELSD法控制其组分和有关物质[7],而未对片剂的组分和有关物质进行控制,这就存在使用劣质的原料进行片剂生产的风险。本文在中国药典2015年版二部硫酸庆大霉素注射液组分和有关物质测定方法的基础上,建立了硫酸庆大霉素片的组分和有关物质测定方法,该方法专属性好,可有效控制硫酸庆大霉素片的组分和有关物质,防止企业采用劣质原料生产片剂。
1 仪器与试药
1.1 仪器
Waters 2695液相色谱仪,Empower色谱工作站(美国Waters公司),Alltech 2000ES ELSD检测器(Alltech公司)。BP-211D分析天平(Mettler公司)。
1.2 试药
庆大霉素标准品,批号:130326-201015,C114.7%、C1a15.3%、C2a8.5%、C218.5%;小诺霉素标准品,批号:130342-201404,563u/mg(51.8%);西索米星对照品,批号:130635-201301,56.0%,标准物质均来源于中国食品药品检定研究院。三氟乙酸为色谱纯(J&K 99.9%,L130Q156,北京百灵威科技有限公司),甲醇为色谱纯(德国Merck),水为Mill-Q去离子水。
1.3 样品
156批样品来源于2017年国家评价性抽验样品,其中12批素片,27批薄膜衣片,117批糖衣片,规格均为40mg(4万单位)。涉及生产企业11个,分别以数字1~11表示。
2 方法
2.1 仪器方法
色谱柱为GRACE Apollo C18(250mm×4.6mm,5μm)。流动相为0.2mol/L三氟乙酸溶液:甲醇(96:4),流速0.6mL/min;柱温35℃;进样量25μL(庆大霉素C组分)和50μL(有关物质);ELSD漂移管温度110℃,载气流速2.5L/min,增益1。
2.2 测定方法
庆大霉素C组分:精密称取庆大霉素标准品适量,加水溶解稀释成约含庆大霉素总C组分0.4、1.0和2.0mg/mL的溶液,作为标准品溶液(1)、(2)、(3)。精密量取上述3种溶液各25μL,分别注入液相色谱仪,记录色谱图,计算标准品溶液各组分浓度对数值与相应峰面积对数值的线性回归方程,相关系数(r)应不小于0.99;另取本品10片,精密称定,研细,精密称取适量(约相当于庆大霉素0.1g);如为糖衣片,取5片,全部研细,加水溶解并定量稀释制成约含庆大霉素1.0mg/mL的溶液,同法测定,用庆大霉素各组分的线性回归方程分别计算供试品中对应组分的量(Ctcx),并按下面公式计算出各组分的含量(%, u/u):
Cx=(Ctcx×V×理论效价×平均片重)/(W×标示量)×100%(薄膜衣片与素片);Cx(%)=(Ctcx×V×理论效价)/(标示量×5)×100%(糖衣片)。
式中Cx为庆大霉素各组分的含量(%, u/u);Ctcx为由回归方程计算出的各组分的含量(mg/mL);V为供试品、溶液的体积(mL);W为供试品称重(g);标示量以u计。
理论效价:C1739.6u/mg、C1a1287.0u/mg、C2a1079.5u/mg和C21095.7u/mg。
有关物质:精密称取西索米星对照品和小诺米星标准品各适量,加水溶解并定量稀释制成约含西索米星和小诺米星各10、20和40μg/mL的溶液,作为标准品溶液(1)、(2)、(3)。按照庆大霉素C组分项下的色谱条件试验,精密量取标准品溶液(1)、(2)、(3)各50μL,分别注入液相色谱仪,记录色谱图,计算标准品溶液浓度对数值与相应峰面积对数值的线性回归方程,相关系数(r)应不小于0.99;另取本品10片,精密称定,研细,精密称取适量(约相当于庆大霉素0.1g);如为糖衣片,取5片,全部研细,加水溶解并定量稀释制成约含庆大霉素1.0mg/mL的溶液,同法测定,记录色谱图至庆大霉素C1峰保留时间的“1.2”倍,供试品溶液色谱图中如有西索米星峰、小诺米星峰,用相应的线性回归方程计算西索米星、小诺米星的含量。除硫酸峰和辅料峰外,其他杂质峰按西索米星线性回归方程计算,供试品溶液色谱图中小于0.1%的杂质峰忽略不计。
3 结果
3.1 专属性
精密量取空白溶液(水)50mL,注入液相色谱仪,记录色谱图。结果空白溶液对庆大霉素各C组分峰及有关物质峰均无干扰。
按处方比例分别称取硫酸庆大霉素素片、薄膜衣片、糖衣片辅料适量,按有关物质供试品溶液制备方法配制,得相当于庆大霉素浓度为1.0mg/mL的辅料溶液,量取50μL注入液相色谱仪,记录色谱图至庆大霉素C1峰保留时间的1.2倍,结果各辅料均在5.0min之前响应,只有糊精在约5.7和6.7min有响应,但与组分和有关物质能有效分离。扣除辅料峰计算,不干扰组分和有关物质测定,见图1。

图1 硫酸庆大霉素片空白辅料色谱图Fig.1 Blank chromatogram of gentamicin sulfate tablets
考察专属性所用辅料:玉米淀粉、明胶、硬脂酸镁、滑石粉、二氧化硅、糊精、糖粉(蔗糖)、虫白蜡、柠檬黄、预胶化淀粉、微晶纤维素、羟丙甲纤维素、聚丙烯酸树脂Ⅳ、聚乙二醇6000、川蜡、硫酸钙、聚山梨酯80、十二烷基硫酸钠、薄膜衣包衣辅料(混合)。
3.2 系统适用性
取庆大霉素标准品适量,精密称定,加水溶解稀释成约含庆大霉素1.0mg/mL的溶液,量取50μL注入液相色谱仪,记录色谱图至庆大霉素C1峰保留时间的1.2倍。结果系统适用性溶液色谱图与中国药典2015年版中庆大霉素标准图谱一致,西索米星、庆大霉素C1a、庆大霉素C2、小诺米星、庆大霉素C2a各峰之间分离度均不小于1.5(图2)。
3.3 线性与范围

图2 系统适用性试验色谱图Fig.2 Chromatograms in system suitability test
精密称取庆大霉素标准品43.98mg,置于10mL容量瓶中,用水溶解后稀释至刻度,精密量取适量,配制成浓度分别为0.352、0.880、1.759、2.639、3.518和4.398mg/mL的溶液,作为庆大霉素C组分的线性溶液。精密量取上述溶液各25mL,注入液相色谱仪,记录色谱图。根据庆大霉素标准品各C组分的绝对含量及上述线性溶液中庆大霉素的浓度,分别计算庆大霉素各C组分的绝对浓度C(mg/mL),计算各C组分的绝对浓度对数值与相应峰面积对数值的线性回归方程,结果庆大霉素4个C组分均线性关系良好(表1)。

表1 庆大霉素各C组分线性结果Tab.1 Linear results of the C components of gentamicin
3.4 检测限与定量限
精密称取西索米星对照品9.08mg、小诺米星标准品10.22mg,加水溶解并稀释至100mL,得溶液50μg/mL的溶液;精密量取该溶液2.5mL(50μg/mL),加水稀释至10mL,得溶液12.5μg/mL,作为检测限溶液。西索米星检出限以S/N=3计为88.98ng,定量限以S/N=10计为127.12ng。小诺米星检出限以S/N=3计为132.35ng,定量限以S/N=10计为264.70ng。
3.5 准确度
根据企业1提供的处方和辅料,按照处方比例和硫酸庆大霉素片量的80%、100%和120%精密称取庆大霉素标准品适量,配制准确性试验供试品溶液。各浓度平行配制3份。精密量取25μL注入液相色谱仪,记录色谱图。
精密称取庆大霉素标准品适量,加水溶解稀释成约含庆大霉素总C组分0.4、1.0和2.0mg/mL的溶液,作为标准品溶液(1)、(2)、(3)。精密量取上述3种溶液各25μL,分别注入液相色谱仪,记录色谱图。计算标准品溶液浓度各C组分浓度对数值与相应峰面积对数值的线性回归方程,相关系数(r)应不小于0.99。用庆大霉素各C组分的线性回归方程分别计算供试品中对应组分的量,计算出各C组分的回收率(%)。各C组分的平均回收率均良好(表2)。
3.6 精密度
仪器精密度:将有关物质测定项下小诺米星标准品溶液(约40μg/mL),连续进样5次,小诺米星峰面积的RSD为0.5%。表明该方法精密度良好。

表2 回收率试验结果Tab.2 Results of recovery test
中间精密度:取同一批号(批号为150901)供试品,分别由两名分析人员于3d按拟定的庆大霉素C组分和有关物质测定的方法测定,结果供试品溶液中庆大霉素C1a、庆大霉素C2、庆大霉素C2a、庆大霉素C1含量的RSD分别为1.7%、1.2%、1.9%和1.7%;西索米星、小诺米星、其他最大单个杂质、其他杂质总量的RSD分别为3.0%、1.7%、3.3%和3.2%,表明该方法中间精密度良好。
3.7 重复性
庆大霉素C组分:取同一批号(批号:2161020)供试品,按拟定的庆大霉素C组分测定的方法测定,结果供试品溶液中庆大霉素C1a、庆大霉素C2、庆大霉素C2a、庆大霉素C1含量的RSD分别为0.8%、1.2%、0.9%和0.9%,表明该方法重复性良好。
有关物质:取同一批号(批号:2161020)供试品,照拟定的有关物质测定方法测定,结果供试品溶液中西索米星、小诺米星、其他最大单个杂质、其他杂质总量的RSD分别为2.4%、2.5%、3.8%和5.8%,表明该方法重复性良好。
4 样品测定结果
采用拟定的方法测定156批次硫酸庆大霉素片的组分,148批次样品的测定结果为:C1a为26.2%~37.5%,C2+C2a为41.2%~50.9%,C1为17.1%~23.4%,4个组分总含量为93%~105%,结果良好。企业3和企业4的8批次样品,总组分含量均偏低。采用中国药典2015年版二部硫酸庆大霉素片含量测定方法-微生物检定法测定该两企业的8批次样品的效价含量,结果均高于HPLC-ELSD法测定的总组分含量(表3)。图3为供试品溶液庆大霉素C组分的典型色谱图。
148批次样品的有关物质测定结果:小诺米星为1.3%~2.6%,西索米星为0%~1.6%,最大单杂为0.3%~1.1%,总杂为1.2%~4.3%。另外企业3和企业4的8批次样品的西索米星、最大单杂、总杂均偏高(表4)。图4为供试品溶液有关物质的典型色谱图。
5 讨论
庆大霉素C组分测定方法的进样体积定为25μL,是因为进样体积50μL时,组分测定项下庆大霉素标准品溶液(约0.4mg/mL)色谱图中庆大霉素组分C1a峰将平顶,无法积分,故降低进样量。
本文建立的HPLC-ELSD法测定硫酸庆大霉素片的组分和有关物质,采用高比例水相,低pH值的流动相,其pH值约为0.9,需采用耐酸且适合高比例水相的色谱柱。
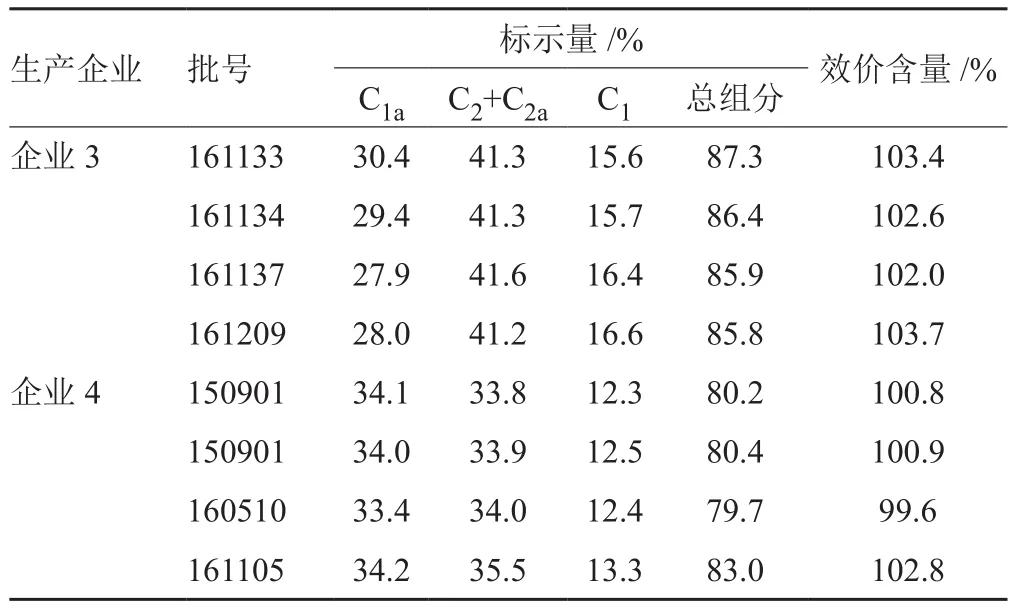
表3 企业3和企业4的样品测定结果Tab.3 Results of sample determination for enterprises 3 and 4

图3 供试品溶液C组分典型色谱图Fig.3 Chromatograms of C components for test solution

表4 有关物质测定结果Tab.4 Results of related substances

图4 供试品溶液有关物质典型色谱图Fig.4 Chromatography of related substances for test solution
中国药典2015年版二部采用抗生素微生物检定法测定硫酸庆大霉素片的含量,未对其庆大霉素C组分和有关物质进行控制。抗生素微生物检定法影响因素较多,由于其原理是量-反应平行线原理[8],要求标准品与供试品有同质性,即对多组分抗生素,标准品和供试品中各组分的相对比例要一致,而实际中标准品与各企业的样品的组分相对比例均不一致,测得的结果会存在误差。另外微生物检定法测得结果是主成分和有关物质的综合含量,不能真实反映主成分的含量。本文采用微生物检定法测定两企业的8批次样品的效价含量,结果均高于本文拟定方法测定的总组分含量,是由于拟定方法测定的是硫酸庆大霉素片4个C组分的总标示含量,而微生物检定法测定的是4个C组分及所有有关物质的综合活性。
如果参考中国药典2015年版二部硫酸庆大霉素注射液组分和有关物质的标准规定,该8批次样品的组分和有关物质测定结果是不符合标准规定的。因此如果不对片剂的组分和有关物质进行控制,则存在采用劣质原料生产出符合药典标准规定的片剂风险。

