粉煤灰改性及其吸附废水中Pb(Ⅱ)的研究
骆欣,敖燕环,徐东耀,路坦
(1.中国矿业大学(北京) 化学与环境工程学院,北京 100083;2.华北科技学院 环境工程学院,北京 101601;3.华北科技学院 安全工程学院,北京 101601)
Pb(Ⅱ)是一种典型的重金属污染物,主要来源于电镀、炼油、油漆生产、电池制造等工业过程。由于Pb(Ⅱ)的高毒性、致癌性和生物富集性[1],从水中去除Pb(Ⅱ)是必要的。粉煤灰(FA)是燃煤产生的固体废弃物,具有较好的吸附性、亲水性、无毒性等特点[2],可用于吸附重金属。郑曼迪等[3-5]研究了粉煤灰、酸或碱改性粉煤灰对Pb(Ⅱ)的吸附。考虑到酸、碱改性可能产生二次污染,本文采用高温焙烧法对粉煤灰进行改性,并考察其对水中Pb(Ⅱ)的吸附性能。
1 实验部分
1.1 试剂与仪器
粉煤灰,取自大唐国际陡河发电厂;硝酸铅、碳酸钠、硝酸、氢氧化钠均为分析纯;模拟废水由Pb(NO3)2溶于去离子水配制而成,除特殊说明外,模拟废水中Pb(Ⅱ)的浓度为 40 mg/L。
BS-110S电子天平;THZ-82A水浴恒温振荡器;101A-1ET电热鼓风干燥箱;MFL-3664智能马弗炉;Sartorius PP-25型酸度计;GGX-600原子吸收分光光度计;IS5傅里叶红外光谱仪。
1.2 实验方法
1.2.1 粉煤灰的改性 粉煤灰用去离子水反复清洗后,在105 ℃干燥至恒重。将5 g经预处理的粉煤灰与Na2CO3按质量比3∶1混合,800 ℃煅烧2 h。研碎,得到改性粉煤灰,记为MFA。
1.2.2 吸附实验 100 mL浓度40 mg/L的Pb(Ⅱ)溶液中,加入0.2 g MFA,30 ℃下以150 r/min振荡30 min,过滤,测定滤液中的Pb(Ⅱ)。实验均重复2次,结果取平均值。
1.3 分析方法
pH由离子酸度计测定;Pb(Ⅱ)由火焰原子吸收法测定,波长为283.3 nm[6]。
2 结果与讨论
2.1 FTIR分析
FA和MFA的FTIR分析见图1。
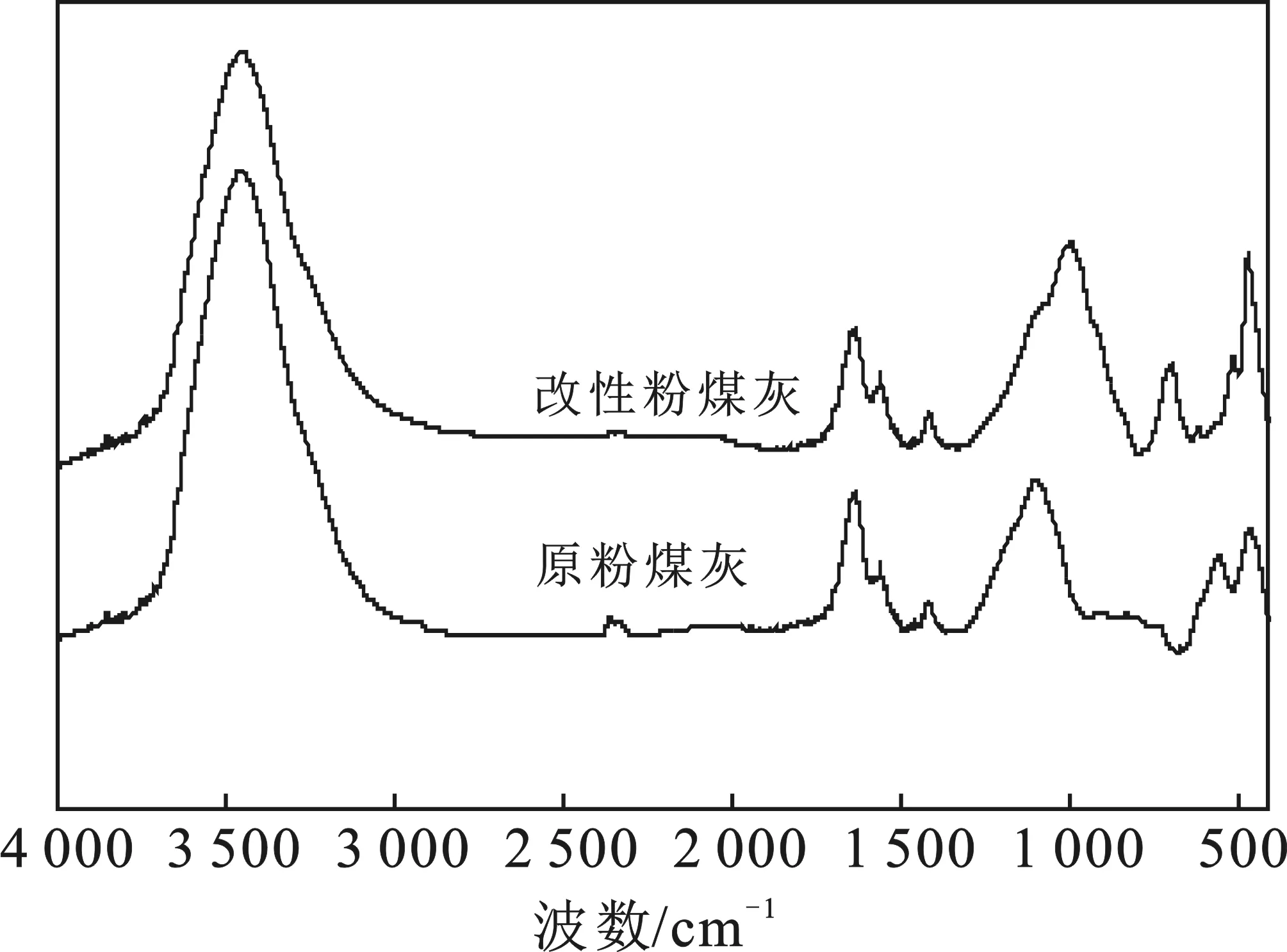
图1 原粉煤灰与改性粉煤灰的FTIR图

2.2 投加量对吸附的影响
由图2可知,随着MFA投加量的增加,Pb(Ⅱ)的去除率逐渐上升,MFA投加量为2 g/L时,Pb(Ⅱ)的吸附率达到99.15%。之后,继续增加MFA的投加量,Pb(Ⅱ)的吸附率维持稳定。因此,确定吸附40 mg/L 的Pb(Ⅱ)溶液时,MFA的投加量为2 g/L。此外,Pb(Ⅱ)的吸附量随着MFA投加量的增加呈现不断降低的趋势。MFA投量的增加使吸附活性点位增多,吸附率上升。然而溶液中Pb(Ⅱ)的量是有限的,因此单位MFA吸附量会逐渐下降。

图2 MFA投加量对吸附效果的影响
2.3 反应时间对吸附的影响
由图3可知,MFA对Pb(Ⅱ)的吸附率随时间的增加而上升,90 min后吸附率达到98.93%,并趋于稳定,吸附达到平衡。MFA对Pb(Ⅱ)的吸附较快,吸附30 min后,Pb(Ⅱ)的吸附率达到97.97%,溶液中Pb(Ⅱ)残留浓度降至0.81 mg/L,低于污水综合排放标准的限值(1.0 mg/L)[8]。

图3 吸附效果随时间的变化情况
2.4 pH对吸附的影响
在溶液初始pH值为 2~12的范围内研究了其对MFA吸附Pb(Ⅱ)的影响,结果见图4。
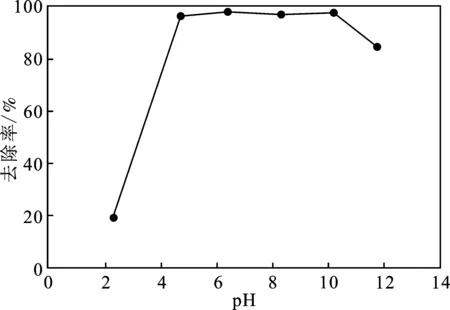
图4 pH对吸附效果的影响
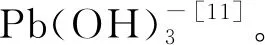
2.5 初始浓度对吸附的影响
由图5可知,随着Pb(Ⅱ)初始浓度的增加,Pb(Ⅱ)的吸附率逐渐降低,平衡吸附量逐渐增多。这主要因为,在低浓度时,相对于溶液中的Pb(Ⅱ),MFA的吸附点位较多,可以快速吸附Pb(Ⅱ)。而当Pb(Ⅱ)浓度升高时,由于MFA的吸附容量有限,导致吸附率降低。较高的Pb(Ⅱ)浓度增加了传质推动力,促使MFA对Pb(Ⅱ)的充分吸附,因而吸附量逐渐增加。
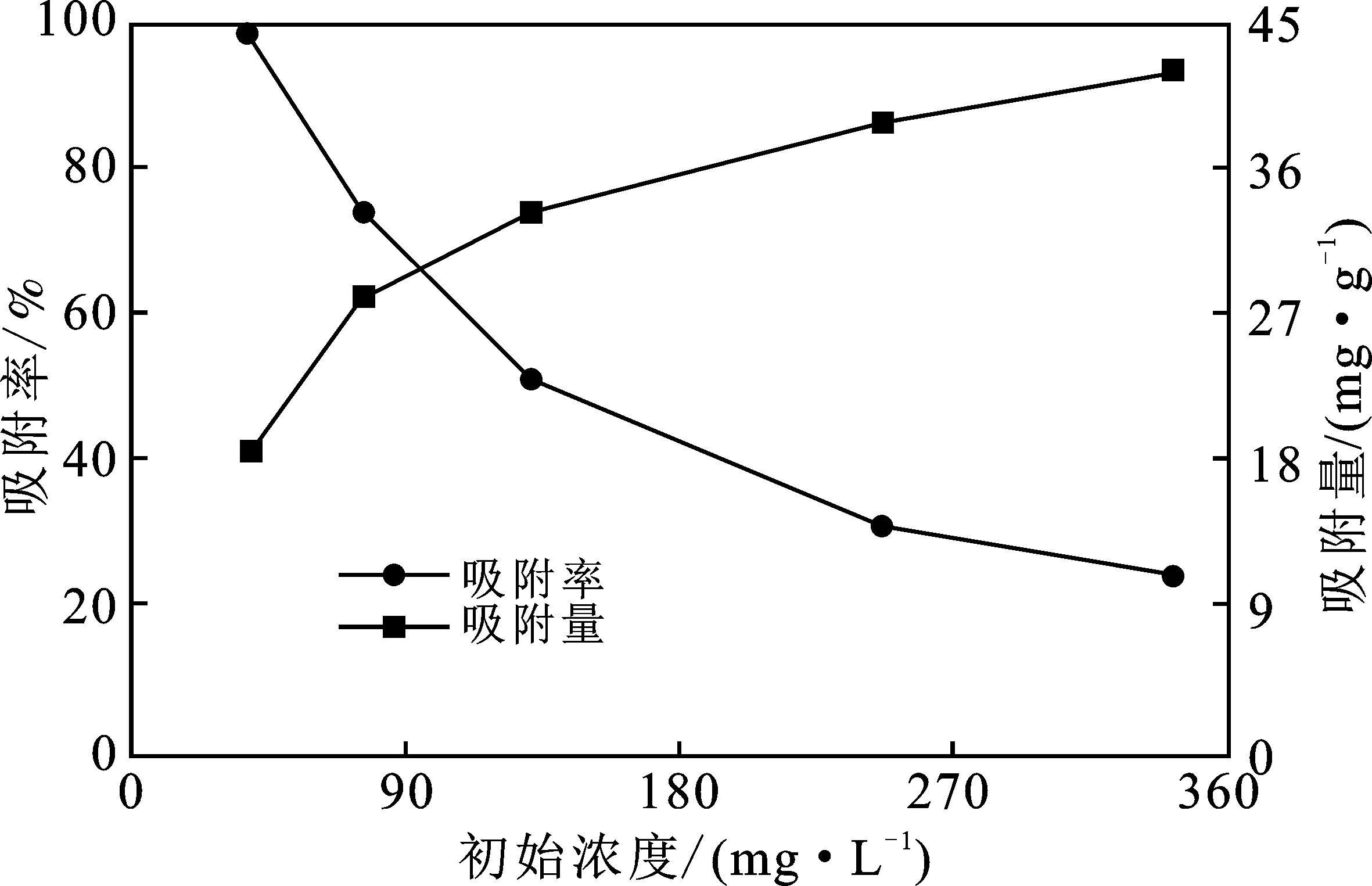
图5 初始浓度对吸附效果的影响
2.6 吸附动力学
MFA对Pb(Ⅱ)的吸附采用拟一级、拟二级、Elovich和颗粒内扩散动力学方程进行拟合,结果见表1。

表1 动力学方程及相关参数
由表1可知,拟一级吸附动力学方程的相关系数(R2)为0.958 6,计算的平衡吸附量与实测值差距较大,不能很好地描述吸附过程,因此液膜扩散并不是单一的速率控制步骤[12]。拟二阶动力学方程的R2为0.999 9,平衡吸附量的计算值与实测值吻合度高。这表明MFA对Pb(Ⅱ)的吸附遵循拟二级速率方程,吸附机制主要为化学吸附。吸附速率取决于吸附活性位,而不是吸附质在溶液中的浓度[13]。Elovich方程拟合后,R2为0.943 0,相关性较好,表明该过程是非均匀表面上的化学吸附[14]。颗粒内扩散方程的R2为0.848 5,在实验拟合模型中R2值最低,意味吸附不遵循该模型。该方程未通过原点,表明吸附过程涉及多个动力学阶段,吸附速率由多个过程共同控制。
2.7 吸附等温线
等温吸附线用 Langmuir、Freundlich和Dubinin-Radushkevich(D-R)方程拟合,结果见图6和表2。采用均方根误差(RMSE)评价拟合方程的有效性,计算式如下:
(1)
其中,qexp、qcal分别表示实验值和计算值,n是测量次数。
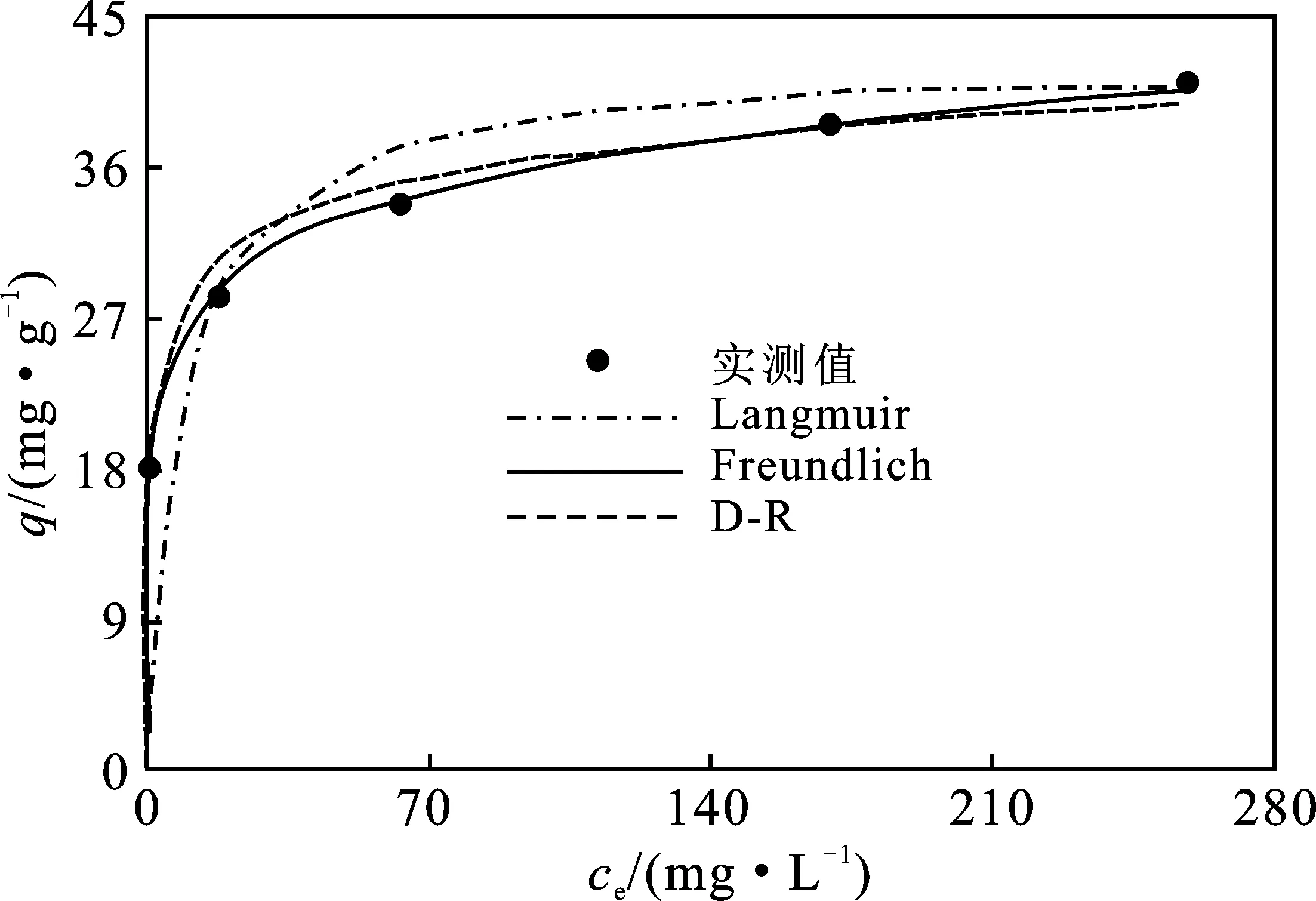
图6 等温吸附线的拟合
由表2可知,三种等温线方程的R2均>0.97,均可较好地描述MFA对Pb(Ⅱ)的吸附行为。由RMSE值可以看出,Freundlich方程的拟合效果优于Langmuir和D-R方程。这意味着Pb(Ⅱ)吸附是以多层方式吸附在MFA的非均匀表面上[13]。在Freundlich模型中,1/n为0.131 4,在0.1~0.5之间,表明吸附易于发生[15]。由D-R等温线可得到平均吸附自由能(E,kJ/mol),其可评估吸附的机制,计算式如下[16]。
(2)
E>16 kJ/mol,则该过程为化学吸附;E介于8~16 kJ/mol,吸附过程主要由离子交换机制控制;E<8 kJ/mol,吸附为物理吸附[17]。实验中E计算值为22.36 kJ/mol,表明Pb(Ⅱ)在MFA上的吸附为化学吸附过程。根据Langmuir等温线模型,MFA对Pb(Ⅱ)的吸附容量为42.55 mg/g,是未改性粉煤灰吸附容量(12.53 mg/g)的3.4倍[3]。由Langmuir等温线的kL可计算吸附过程吉布斯自由能的变化(ΔG),计算方法见式(3)[18]。经计算,ΔG为-11.70 kJ/mol,负值表明MFA对Pb(Ⅱ)的吸附是自发产生的。
ΔG=-RTlnkL
(3)
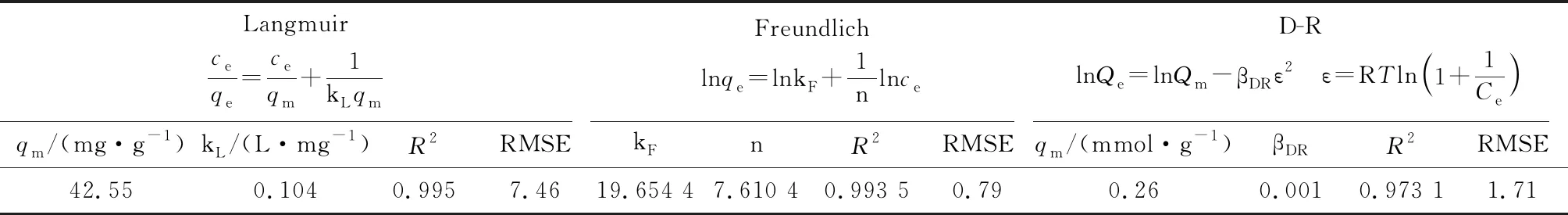
表2 吸附等温线方程及相关参数
3 结论
(1)采用高温焙烧法改性粉煤灰,使原粉煤灰的玻璃网络结构被破坏,粉煤灰的活性得到增强。
(2)最佳吸附条件为温度30 ℃、初始Pb(Ⅱ)浓度40 mg/L,MFA的投加量2 g/L,pH 5.5,吸附时间 30 min时,Pb(Ⅱ)的吸附率达到97.97%,水中残留浓度降至0.81 mg/L以下,达到排放标准的要求。
(3)MFA吸附Pb(Ⅱ)的过程符合拟二级动力学方程和Freundlich吸附等温方程,平均吸附自由能为22.36 kJ/mol,吸附过程为化学吸附。

