芪茵颗粒对非酒精性脂肪性肝病细胞模型中游离脂肪酸、瘦素及抵抗素水平的影响
杨 旋, 曾斌芳,2
(1新疆医科大学中医学院, 乌鲁木齐 830011; 2新疆名医名方与特色方剂学实验室, 乌鲁木齐 830000)
非酒精性脂肪肝(non-alcohol fatty liver disease, NAFLD)定义为排除其他肝脏脂肪变性原因(包括其他肝脏疾病原因、过度饮酒和其他可能导致肝脏脂肪变性的情况)后,仍存在肝脏脂肪堆积。NAFLD并非静止性病变,它可在较短时间内对肝脏造成不可逆的损伤,有很大机率将发展为肝硬化和终末期肝病,NAFLD的患病率普遍上升[1]。NAFLD的发病机制尚没有明确,其中以“二次打击学说”影响力最广、最为学者们所认同。胰岛素抵抗(IR)所导致的肝内脂肪沉积是NAFLD发病过程的第一次打击,同时IR也是NAFLD发病过程中的中心环节之一[2]。本研究依据“见肝之病,知肝传脾,当先实脾”和“肝肾同源”等传统之理论,自拟经验方芪茵颗粒治疗NAFLD,并经过多年的临床应用,疗效得到了广大患者的肯定。通过观察芪茵颗粒对NAFLD细胞模型(FFA)、LEP及RETN水平的影响,探讨其对NAFLD的IR途径的治疗作用机制。
1 材料与方法
1.1 实验细胞及动物LO2细胞株由新疆医科大学第一附属医院肝细胞实验室所提供。雄性SPF级SD大鼠 6只,体质量(200±20) g,由新疆医科大学医学实验动物中心提供,实验动物生产许可证号: SYXK(新)2018-0003。
1.2 实验药物芪茵颗粒免煎剂( 由黄芪、茵陈蒿、生山楂、补骨脂、泽泻、决明子、生大黄、三七组成) ,购于新疆维吾尔自治区中医医院(江阴天江药业有限公司生产)。硫普罗宁片( 河南省新宜药业有限公司,批号: P20150307-2)。
1.3 试剂与仪器RPMI1640培养基、胎牛血清、牛血清蛋白(BSA)、油酸钠、棕榈酸钠、噻唑盐(MTT)细胞增殖及细胞毒性检测试剂盒(江苏凯基生物技术股份有限公司),油红O染色液(Solarbio)游离脂肪酸检测试剂盒(南京建成生物工程研究所),人抵抗素酶联免疫吸附测定试剂盒(武汉伊莱瑞特生物科技股份有限公司),人瘦素酶联免疫吸附测定试剂盒(武汉伊莱瑞特生物科技股份有限公司)。二氧化碳恒温培养箱(上海一恒科学仪器有限公司),倒置显微镜(浙江赛德仪器设备有限公司)、酶标仪(Thermo)。
1.4 实验方法
1.4.1 含药血清制备 将体质量在180~200 g的36只雄性SD大鼠,适应性喂养1周后随机分为空白组、中药制剂芪茵颗粒组、阳性药物硫普罗宁组,每组12只。芪茵颗粒组以5 g/kg体质量的中药免煎剂灌胃给药、硫普罗宁组以20 mg/kg体质量的剂量灌胃给药,空白组予以20 mL/kg体质量的蒸馏水灌胃。每日分早晚2次,连续灌胃给药5次。处理动物12 h前,大鼠进食不禁水,次日末次给药1 h后测量体重并记录,用10%水合氯醛(3 mL/kg体质量)行腹腔注射麻醉术,沿腹正中线做“Y”切口,腹主动脉取血,室温静置1 h后,3 000 r/min离心10 min后取上清备用。将血液上清分装于5 mL冻存管,56℃水浴灭活30 min,0.22 μm滤膜过滤灭菌,-80℃冰箱保存。
1.4.2 NAFLD细胞模型造模方法取 L02 细胞株,用含 10%胎牛血清的1640培养基传代培养,取4~7代内细胞用于实验。将离体培养的L02细胞以合适密度接种于96孔板和(或)24孔板内,细胞培养24 h后,将适宜浓度的游离脂肪酸(OA∶PA=2∶1)接种板内,取对数生长期用于实验。
1.4.3 NAFLD细胞模型最佳造模条件的确定
1.4.3.1 游离脂肪酸(FFA)作用浓度及时间的确定 据“1.4.2”项实验方法,将细胞接种于96孔板,培养24 h后,将板内细胞分为对照组和4个实验组,对照组加入含1%BSA无血清培养基、实验组加入含不同浓度的FFA培养基(分别为0.25、0.5、0.75、1 mmol/L),每组5个复孔。干预12、24 h后,用MTT分析法测试细胞情况,以确定FFA的最佳作用浓度及时间。
1.4.3.2 细胞内脂滴观察 据“1.4.3.1”项实验的结果,将细胞接种于24孔板,培养24 h后,加入不同浓度的FFA培养基(浓度分别为0.25、0.5、0.75、1 mmol/L),每组3个复孔,干预24 h后,采用油红O染色法对细胞进行脂肪变性观察,染色结果:中性脂肪呈橙红色、磷脂呈粉红色、细胞核呈蓝色。
1.4.4 含药血清的作用浓度及时间的确定 将细胞以1×105密度接种于96孔板,培养24 h后,取细胞对数生长期,将细胞分为空白对照组、含药血清组、模型组。空白对照组正常换液,含药血清组及模型组根据“1.4.3.1”项实验结果在细胞内加入FFA培养基干预后,吸去培养基,PBS冲洗2遍,将含药血清组加入不同浓度的芪茵颗粒含药血清配制(含药血清浓度分别为5%、10%、15%、20%)的含药血清培养基,空白对照组和模型组加入含10%胎牛血清培养基,干预12、24 h后,用MTT分析法测试细胞抑制率,把抑制率达50%的值(IC50)设为芪茵颗粒中剂量浓度、将IC50值上调1倍设为芪茵颗粒高剂量浓度,将IC50值下调1倍设为芪茵颗粒低剂量浓度。阳性药物硫普罗宁含药血清测定方法同上。
1.5 分组与观察指标
1.5.1 对NAFLD细胞模型细胞分组 将细胞以1×105密度接种于96孔板,24 h后取其对数生长期,将细胞分为空白对照组、模型组、芪茵颗粒高剂量组、芪茵颗粒中剂量组、芪茵颗粒低剂量组、阳性对照组,除空白对照组外各组均加入FFA高脂培养基,空白组继续用10%胎牛血清培养基培养。24 h后吸去高脂培养基,对应含药血清的不同分组分别加入高剂量浓度芪茵颗粒含药血清、中剂量浓度芪茵颗粒含药血清、低剂量浓度芪茵颗粒含药血清、硫普罗宁含药血清,模型组加入含10%胎牛血清的培养基,空白组加入含10%的空白组含药血清,干预24 h后,依据实验要求进行实验。
1.5.2 分组后NAFLD细胞模型内游离脂肪酸(FFA)、人瘦素(LEP)、人抵抗素(RETN)浓度测定 将细胞以1×105密度接种于96孔板,取细胞上清液共接种3板,据“1.5.1”项的实验方法分组并干预后,分别依据FFA试剂盒、LEP酶联免疫吸附测定(ELISA Kit)试剂盒及RETN酶联免疫吸附测定(ELISA Kit)试剂盒要求进行实验。
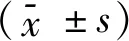
2 结果
2.1 不同浓度及时间点的的游离脂肪酸对L02细胞的诱导作用FFA的诱导作用随着浓度及时间的增加而增加,当FFA的作用浓度为1 mmol/L,作用时间为24 h时,FFA的作用效果最接近50%抑制率(IC50值),故用FFA诱导L02细胞造NAFLD细胞模型的最佳条件为以1 mmol/L的浓度作用24 h,见表1。

表1 不同浓度及时间点FAA作用比较
2.2 经不同浓度的游离脂肪酸诱导后的LO2细胞脂肪变性观察以1、0.75、0.5、0.25 mmol/L 4个不同浓度的游离脂肪酸对LO2细胞诱导24 h后的染色结果进行观察,结果按照试剂盒说明书的操作。浓度为1 mmol/L时,细胞内的橙红色脂滴最明显,随着浓度的降低染色后呈蓝色的细胞核愈加明显,见图1。




1 mmol/L FFA(100×) 0.75 mmol/L FFA(100×) 0.5 mmol/L FFA(100×) 0.25 mmol/L FFA(100×)
图1 油红O染色结果
2.3 芪茵颗粒含药血清对NAFLD细胞模型的抑制作用将细胞分为不同浓度的芪茵颗粒含药血清组、模型组、空白组,干预12、24 h后,确定芪茵颗粒含药血清的高、中、低剂量浓度,结果按照试剂盒说明书的操作。干预12 h后,含药血清对NAFLD的抑制作用随浓度上升而增加,干预24 h后,以含药血清浓度为10%时,抑制率最接近50%为IC50值,见表2。
表2 不同浓度及时间点芪茵颗粒含药血清的作用比较

浓度/%12 h波长490 nm抑制率/%24 h波长490 nm抑制率/%200.531±0.10132.70.375±0.04043.2150.585±0.15725.80.536±0.04861.7100.688±0.01812.80.425±0.04249.250.590±0.09225.20.562±0.18264.8模型组0.461±0.05741.60.336±0.03638.7正常对照组0.789±0.04800.868±0.1090
2.4 硫普罗宁含药血清对NAFLD细胞模型的抑制作用将细胞分为不同浓度的硫普罗宁含药血清组、模型组、空白组,干预12、24 h后,确定硫普罗宁含药血清的IC50值,结果按照MTT试剂盒说明书的操作。干预24 h后10%硫普罗宁含药血清抑制率最接近50%为IC50值,见表3。
表3 不同浓度及时间点硫普罗宁含药血清的作用比较

浓度/%12 h波长490 nm抑制率/%24 h波长490 nm抑制率/%200.402±0.08545.90.374±0.02356.1150.568±0.03123.60.500±0.02641.3100.506±0.06032.00.389±0.03754.350.488±0.04634.50.492±0.04542.3模型组0.407±0.05345.30.444±0.02547.8正常对照组0.744±0.05800.852±0.1640
2.5 含药血清对NAFLD细胞模型内游离脂肪酸(FFA)、人瘦素(LEP)、人抵抗素(RETN)浓度的作用比较与空白组比较,模型组FFA浓度明显升高,差异有统计学意义(P<0.05);与模型组比较,芪茵颗粒中剂量组、芪茵颗粒低剂量组、阳性对照组FFA浓度明显降低,差异有统计学意义(P<0.05)。与空白组比较,模型组LEP浓度明显升高,差异有统计学意义(P<0.05);与模型组比较,芪茵颗粒中剂量组、阳性对照组LEP浓度明显降低,差异有统计学意义(P<0.05)。与空白组比较,模型组RETN浓度明显升高,差异有统计学意义(P<0.05);与模型组比较,芪茵颗粒中剂量组、阳性对照组RETN浓度明显降低,差异有统计学意义(P<0.05), 见表4。
表4 NAFLD体外模型细胞中FFA、LEP、RETN浓度比较

组别FFALEPRETN芪茵颗粒高剂量组0.041±0.012178.613±129.065106.282±91.234芪茵颗粒中剂量组0.039±0.009▲177.182±77.582▲122.669±79.616▲芪茵颗粒低剂量组0.039±0.011▲239.658±191.194135.186±81.395阳性对照组0.037±0.021▲146.308±74.897▲122.669±79.616▲模型组0.055±0.019∗296.058±206.356∗198.912±71.121∗空白组0.032±0.01140.803±70.45582.840±60.883
注: 与空白组比较,*P<0.05, 与模型组比较,▲P<0.05。
3 讨论
NAFLD在传统医学学中症属"肝癖"范畴,病位在肝、脾,久则可累及肾脏,病性多虚实夹杂,以湿、痰、瘀、毒为实为标,以肝失疏泄、脾失健运、肾失固藏为虚为本[3]。本研究中的自拟经验方芪茵颗粒以中医药整体观念和中药多层次、多途径、多靶点的药理作用为出发点,方中以生黄芪、茵陈为君,益脾胃、清肝热祛湿浊;以决明子、三七粉为臣,泻浊祛湿,湿瘀同治;生大黄、泽泻、生山楂、补骨脂为佐,活血祛瘀兼补肾;以苦丁茶为使药,清热解毒、健脾消积。共奏抑肝扶脾、消导祛湿兼活血消积的功效。方中配伍体现了“虚湿瘀滞并治,肝脾肾同调,从虚论治”的特点,遵循 “健脾不如补肾”的思想,运用脏腑虚损理论,着重调节肾之气化、脾之运化、肝之舒化,虚实兼治。
在近年来的国外研究中,NAFLD所导致的肝功酶学异常已成为多种慢性肝病的最常见诱因之一,同时也是引起肝硬化的主要前期病变之一[4-5]。其巨大的经济负担和较差的药物疗效,使经济有效的治疗方法成为全球公共卫生问题,在我国NAFLD的危害也日趋严重,成人发病率已达到15%,成为最常见的慢性肝病之一[6-7]。胰岛素抵抗(IR)作为NAFLD 的关键发生环节之一,可以直接或间接促进肝脏内脂肪的沉积及肝损伤,进而发生纤维化等终末期病变。一些与IR相关的蛋白或细胞因子,参与IR的形成过程。相关研究已证实IR与NAFLD的发病关联密切,当IR发生时,血清中FFA含量增加,迫使肝细胞内FFA加速积累,肝细胞内脂肪变性,导致了NAFLD的发生[8-9]。抵抗素(RETN)通过影响肝脏的葡萄糖及脂质代谢,使得周围组织对胰岛素的敏感性降低,促使细胞炎性因子的产生,加快了NAFLD的发生与发展。同时抵抗素对糖脂代谢的影响,妨碍了其对机体正常的能量调节,引起IR的发生[10-12]。大多数肥胖患者存在瘦素(LEP)抵抗,瘦素抵抗通过影响肝脏脂肪代谢,引起高胰岛素血症和(或) 肝内胰岛素信号转导改变,使外周脂肪分解产生大量FFA,加重IR[13-15]。本研究从与IR有关的因素(FFA、LEP、RETN)作为切入点,研究芪茵颗粒对NAFLD体外模型中IR的作用,结果表明芪茵颗粒可以显著抑制NAFLD体外模型中LEP及RETN的含量,降低单纯性脂肪肝细胞中FFA的浓度,改善IR对NAFLD的影响,对NAFLD起到良好的治疗作用。

