右美托咪定对病理性神经痛坐骨神经卡压性模型大鼠镇痛作用的影响
韩 梅, 赵 昭, 冯 军
(深圳市第二人民医院麻醉科, 深圳 518035)
P38丝裂原活化蛋白激酶(P38MAPK)属于MAPKs(丝裂原活化蛋白激酶)家族一员,最新疼痛研究进展表明,P38MAPK参与了疼痛的发生发展,此外,还参与脊髓背胶神经元兴奋过程。有研究表明,坐骨神经分支卡压性模型建立后,其P38MAPK水平会明显降低[1]。目前,在病理性神经痛治疗中,常用的药物主要为抗癫痫类药、三环类抗抑郁药以及去甲状腺素再摄取抑制药。以往研究认为,疼痛是机体组织在一定程度上受损或存在潜在性损伤造成的,可提示患者出现健康问题[2]。随着对疼痛研究的深入,有学者提出,疼痛不仅仅是一类疾病,亦是神经功能紊乱的一种表现[3]。徐玉英等[4]实验发现,在疼痛发生的初始阶段,会有脊髓小胶质细胞激活现象,随着损伤的恢复,胶质细胞水平亦随之下降。基于此有学者提出,小胶质细胞ATP受体激活可能是通过P38MAPK通路实现的[5]。右美托咪定是一种新型的α2肾上腺素激动药,因其对中枢与周围神经系统具有较好的镇静、镇痛、抗焦虑作用而被广泛应用于临床。鞘内注射用药能够抑制去甲肾上腺素的生成以及分泌,缓解神经病理性疼痛。本研究旨在探究右美托咪定对病理性神经痛坐骨神经卡压性模型大鼠镇痛作用的影响,现报道如下。
1 材料与方法
1.1 实验动物SD雄性大鼠36只,体重220~265 g,按照随机数字表法将其分为3组(对照组、病理性神经痛模型组、右美托咪定组),每组各12只,均进行分笼饲养,且保持清洁干净,室温控制在25℃左右。36只大鼠自由饮食、饮水,每天进行垫料更换。
1.2 实验器材冰箱(购于海尔公司);显微镜(购于日本奥林巴斯公司);恒温水浴箱(购于日本三洋公司);离心机(购于Sigma公司);PCR仪(购于RAKARA公司);电泳仪(购于上海天能公司)。
1.3 主要试剂与药品PT-PCR引物(购于上海宝曼生物科技有限公司);两步法qRT-PCR试剂盒(购于Biomiga公司);组织RNA提取试剂盒(购于Biomiga公司);DEPC(购于Solarbio Life Science公司);5×TBE缓冲液(购于鹏博生物有限公司);多聚甲醛(购于武汉博士德有限公司);兔源性P38MAPK单克隆抗体(购于广州东盛科技有限公司)。
1.4 方法
1.4.1 造模方法 对照组大鼠进行假手术处理,切开肌层并进行坐骨神经分离。病理性神经痛模型组大鼠进行坐骨神经结扎,并建立病理性坐骨卡压性损伤模型,随后每天向鞘内注射2 μg/kg的生理盐水,共注射14 d。右美托咪定组大鼠进行坐骨神经结扎,建立病理性坐骨卡压性损伤模型,随后每天向鞘内注射2 μg/kg的右美托咪定,用5 mL注射器抽取5 mL生理盐水,注入1 mL然后回抽1 mL再注入, 如此反复待生理盐水变为红色混浊后重复操作, 直至置换液为淡红色。观察各组大鼠热缩足反射潜伏期、机械缩足反射潜伏期,并用免疫组织化学法测定脊髓背根神经节P38MAPK表达情况,采用反转录聚合酶链式反应检测P38MAPKA mRNA表达水平[6]。
1.4.2 热缩足与机械缩足测定方法 (1)热缩足测定方法:将所有大鼠放置于有机玻璃箱内,并将3 mm厚的玻璃板置于箱子底部。待其适应后,采用热痛仪对大鼠足底第2、3趾间皮肤进行照射,共照射3次,每2次间相隔6 min,且每次时间上限为15 s,照射光斑直径<8 mm[7]。记录每次大鼠回避时间,取3次平均值为最终结果。(2)机械缩足测定方法:将所有大鼠放置于有机玻璃箱中,将每格1 mm2的不锈钢丝置于箱底,待15 min大鼠适应后,使用不同折力对大鼠进行垂直刺激,力量应由小至大,每次刺激维持6~8 s,对大鼠刺激时状态进行观察[8]。若大鼠有明显缩足表现,或者表现为舔足,则认为其为阳性。连续2次刺激时间间隔12 s,连续刺激10次,若阳性反应为5次或5次以上,则记作50%反应率[9]。
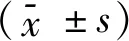
2 结果
2.1 3组大鼠一般行为变化实验过程中,所有大鼠饮水、饮食正常,无生病、死亡现象。所有大鼠在坐骨神经分离处理后,均出现损伤同侧脚趾并拢或内收,伴随或不伴随自发性甩腿、舔足、踮地行走等疼痛表现,说明造模成功。与对照组比较,病理性神经痛模型组与右美托咪定组上述表现均有所减少。
2.2 3组大鼠热缩足反射潜伏期比较术前,3组大鼠热缩足反射潜伏期差异无统计学意义(P>0.05);右美托咪定组术后1、3、7 d 热缩足反射潜伏期均高于病理性神经痛模型组(P<0.05),低于对照组(P<0.05);对照组术后1、3、7 d 热缩足反射潜伏期均高于病理性神经痛模型组(P<0.05)。结果见表1。
2.3 3组大鼠机械缩足反射潜伏期比较术前,3组大鼠机械缩足反射潜伏期差异无统计学意义(P>0.05)。右美托咪定组术后1、3、7 d机械缩足反射潜伏期均高于病理性神经痛模型组(P<0.05),低于对照组(P<0.05);病理性神经痛模型组术后1、3、7 d机械缩足反射潜伏期均低于对照组(P<0.05)。结果见表2。

表1 3组大鼠热缩足反射潜伏期比较(s, ±s)
注:与对照组相比,aP<0.05; 与病理性神经痛模型组相比,bP<0.05。

表2 3组大鼠机械缩足反射潜伏期比较(s, ±s)
注:与对照组相比,aP<0.05; 与病理性神经痛模型组相比,bP<0.05。
2.4 3组大鼠免疫组化结果比较术后14 d,对大鼠组织进行免疫组化分析,对照组P38MAPK平均光密度为(0.015±0.03),模型组为(0.163±0.39),右美托咪定组为(0.078±0.043);病理性神经痛模型组与右美托咪定组P38MAPK平均光密度明显高于对照组(P<0.05),而右美托咪定组明显低于病理性神经痛模型组(P<0.05),结果见图1~3。



图1 对照组大鼠免疫组化图(×200)
图2 病理性神经痛模型组免疫组化图(×200)
图3 右美托咪定组免疫组化图(×200)
2.5 3组大鼠RT-PCR结果比较右美托咪定组与病理性神经痛模型组、对照组术后1 d P38MAPK mRNA水平差异均无统计学意义(P>0.05);右美托咪定组术后7、14 d P38MAPK mRNA水平低于病理性神经痛模型组(P<0.05),高于对照组(P<0.05);对照组术后7、14 d P38MAPK mRNA水平低于病理性神经痛模型组(P<0.05),见表3。

表3 3组大鼠P38MAPK mRNA水平结果比较(±s)
注: 与对照组相比,aP<0.05; 与病理性神经痛模型组相比,bP<0.05。
3 讨论
神经病理性疼痛较为常见,是一种由神经系统的原发性疾病或者由受损直接引起的慢性疼痛,这种疼痛常表现为自发性疼痛、感觉异常、痛觉过敏等,目前尚无有效治疗方法[10]。为深入探究病理性神经痛的发生机制,本研究制作了病理性神经痛大鼠模型,该模型操作较为简单,成功率高,由于仅对坐骨神经干进行结扎,因而对大鼠损伤较小[11]。本研究中所有大鼠造模成功,实验结果表明,术后病理性神经痛模型组与右美托咪定组大鼠的疼痛表现(损伤同侧脚趾并拢或内收,伴随或不伴随自发性甩腿、舔足、踮地行走等)均有所减少,说明经右美托咪定治疗后,大鼠疼痛有所缓解。本实验结果表明,右美托咪定组术后1、3、7 d 热缩足反射潜伏期均高于病理性神经痛模型组,低于对照组,说明经右美托咪定治疗有效减轻了大鼠术后造模侧的热痛敏。右美托咪定组术后1、3、7 d 机械缩足反射潜伏期均高于病理性神经痛模型组,低于对照组,说明经右美托咪定治疗有效减轻了大鼠术后造模机械痛敏。
在病理性疼痛的发病过程当中 ,多种激酶通路汇聚到P38MAPK, P38MAPK在神经元可塑改变环节发挥重要作用[12]。在背根神经节以及脊髓背角神经元感受诱发的可塑性维持当中,P38MAPK信号通路激活有重要影响,一方面会加大基因转录,另一方面会诱发靶蛋白后调制[13]。有研究表明,使用右美托咪定不仅对患者呼吸系统的自主呼吸功能的影响较小,其血流动力学波动范围可控,同时亦能减少患者心肌的耗氧量[14-15]。本研究结果显示,术后14 d病理性神经痛模型组与右美托咪定组大鼠P38MAPK平均光密度明显高于对照组,而右美托咪定组明显低于模型组;术后7、14 d,右美托咪定组P38MAPK mRNA水平低于病理性神经痛模型组,高于对照组,提示右美托咪定对病理性神经痛坐骨神经卡压性模型大鼠镇痛作用是通过P38MARK信号通路发挥作用,这与Reade等[16]的研究结果相符。
综上所述,对病理性神经痛大鼠进行鞘内注射右美托咪定可提高大鼠热缩足反射潜伏期和机械足反射潜伏期,疼痛缓解作用的发挥可能是通过下调P38MAPK mRNA水平表达,从而抑制P38MAPK活化实现的。

