白细胞介素35、降钙素原及SOFA评分对脓毒症病情严重程度及预后的评判价值*
查君敬,方长太,白兆青,程高翔
(安徽医科大学附属安庆医院重症医学科,安徽安庆 246003)
脓毒症(sepsis)是由致病微生物感染引起的全身炎症反应综合征,其发病率高、病死率高,是重症医学科(ICU)内重症患者死亡的主要原因之一[1]。目前的研究认为,脓毒症发展的重要原因之一是机体的免疫功能紊乱,其过程涉及众多炎症因子[2]。降钙素原(procalcitonin,PCT)由于其高特异性与敏感性,目前已作为脓毒症诊断的重要生物标志物之一[3];序贯器官衰竭评估(sequential organ failure assessment,SOFA)评分可用于警示脓毒症患者的病情严重程度及预后,被广泛应用于ICU危重患者的预后评估中[4]。白细胞介素(interleukin,IL)-35是IL-12家族的新成员,主要由调节性T细胞(regulatory T cells,Treg)分泌[5]。相关研究显示,IL-35可能广泛参与了体内的免疫应答过程,如细胞内感染、炎症过程、自身免疫疾病和肿瘤等[6]。既然脓毒症的免疫特性是免疫反应障碍的复杂过程,那IL-35是否参与脓毒症的调节并起到调控作用呢?目前虽有PCT和SOFA评分在脓毒症患者病情及预后评估价值的研究报告,但有关IL-35、PCT及SOFA评分这三者间的相关性,且IL-35对脓毒症患者病情及预后评判的研究甚少;与此同时,鉴于脓毒症病理过程的复杂性,寻找有效的方法来评估脓毒症患者的病情及预后,将有助于医生尽早评估病情严重程度,并给予及时合理的治疗[7]。因此本研究通过测定脓毒症患者IL-35、PCT水平及SOFA评分,以揭示IL-35在脓毒症患者病情严重程度及预后中的价值。
1 资料与方法
1.1一般资料 选择2017年4月至2018年2月安徽医科大学附属安庆医院ICU收治的脓毒症患者共54例,其中男26例,女28例;平均年龄(60.91±13.71)岁;脓毒症原发疾病中肺部感染16例,血源性感染12例,泌尿系感染11例,肠道感染8例,急性重症胰腺炎3例,其他4例。严格按照2016年美国重症医学会(SCCM)与欧洲重症医学会(ESICM)脓毒症3.0定义及诊断标准[8]入选脓毒症患者及对患者病情严重程度进行分组。对年龄小于14岁的儿童、合并自身免疫性疾病、血液系统疾病、恶性肿瘤、妊娠、创伤、急性肾衰竭、急性心脑血管系统疾病、慢性肝肾疾病终末期、诊断脓毒症至转入ICU超过6 h的患者均不纳入研究。本研究符合医学伦理学的标准,并经医院伦理委员会批准,所有的治疗得到患者或家属的知情同意。
1.2方法
1.2.1分组与方法 (1)根据脓毒症患者病情严重程度分为两组:脓毒症组(n=36)与脓毒症休克组(n=18),比较不同严重程度患者血清IL-35、PCT水平及SOFA评分;(2)根据临床转归情况,分为存活组(n=36)和死亡组(n=18),比较两组间IL-35、PCT水平及SOFA评分间的差异;(3)分析IL-35、PCT水平及SOFA评分对脓毒症预后的评估价值。
1.2.2观察及检测指标 (1)对脓毒症患者在确诊后6~8 h采取静脉血:其中对血清IL-35水平的检测采用酶联免疫吸附试验(ELISA,试剂盒购自上海拜力科技有限公司),对血清PCT水平的检测应用罗氏E170全自动电化学发光分析仪器(试剂盒选用仪器公司提供的匹配试剂)。(2)对患者确诊后6~8 h的临床指标最差值进行SOFA评分。(3)脓毒症患者均按照指南要求接受脓毒症规范治疗,并收集脓毒症患者年龄、性别等一般资料及住院后28 d预后情况。

2 结 果
2.1不同严重程度脓毒症患者IL-35、PCT、SOFA评分及病死率比较 脓毒症组与脓毒症休克组性别、年龄比较差异均无统计学意义(P>0.05);脓毒症休克组血清IL-35、PCT水平及SOFA评分、病死率均明显高于脓毒症组(P<0.01),见表1。
2.2不同预后患者IL-35、PCT水平和SOFA评分比较 存活组与死亡组患者性别、年龄比较差异均无统计学意义(P>0.05),但死亡组血清IL-35、PCT水平及SOFA评分明显高于存活组(P<0.01),见表2。
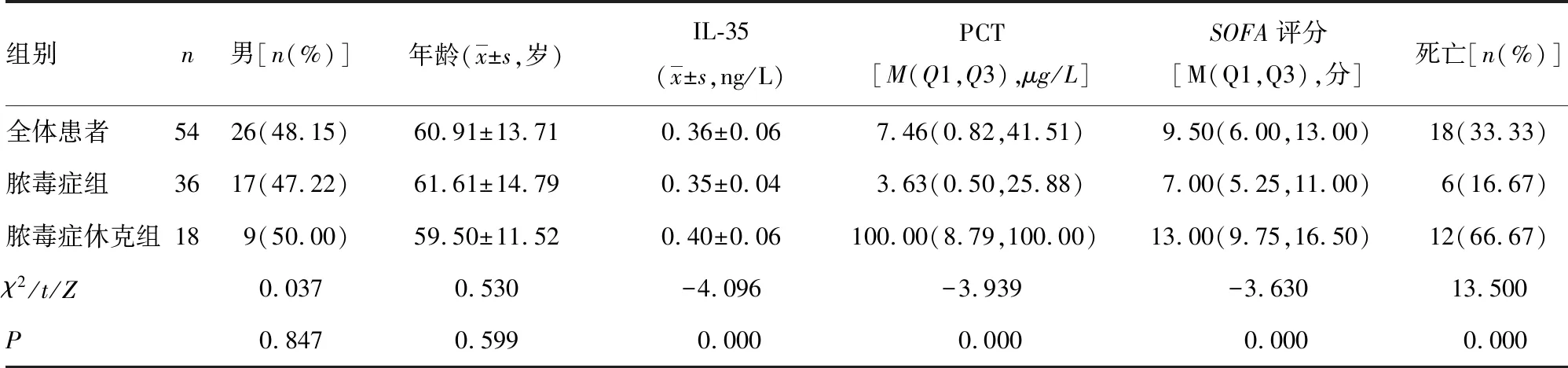
表1 脓毒症组与脓毒症休克组患者相关指标比较

表2 不同预后患者血清IL-35、PCT水平和SOFA评分比较
2.3血清IL-35、PCT及SOFA评分对脓毒症预后的评估价值 采用ROC曲线分析并计算曲线下面积(AUC)值,血清IL-35、PCT及SOFA评分均对脓毒症患者预后具有一定的评估价值(P<0.05)。IL-3、PCT和SOFA评分的AUC分别为0.873、0.823和0.902。当IL-35截断值为0.40 ng/L时的灵敏度为66.67%,特异度为91.67%;当PCT截断值为19.64 μg/L时的灵敏度为83.33%,特异度为77.78%;当SOFA评分截断值10.50分时,灵敏度为83.33%,特异度为80.56%,见表3、图1。

表3 各指标评价脓毒症患者预后的ROC AUC及截断值
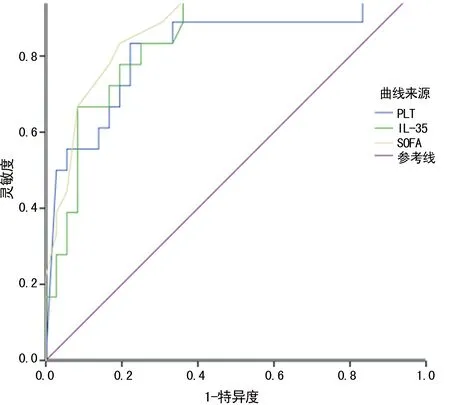
图1 入ICU时各指标预测脓毒症死亡的ROC曲线
3 讨 论
脓毒症是一种器官功能障碍,是由于机体对感染反应失控,严重时可危及生命[8]。目前的研究证实,脓毒症发生的机制之一是大量微生物与天然免疫细胞(如巨噬细胞)上模式识别受体结合,从而引起这些细胞的过度活化,释放大量促炎因子和趋化因子。美国一项大规模的研究发现机体在对脓毒症的基因组反应中不仅使大量参与炎症反应的基因表达激活,还使参与抗原识别、T细胞增殖和凋亡、T细胞受体功能和NK细胞功能的基因表达得到抑制[9]。因此一些炎性生物标志物被提出来以评估脓毒症的诊断及预后,以期对脓毒症患者进行早期识别和及时干预[3,10]。
IL-35是一种新发现的免疫抑制细胞因子,主要由Treg细胞产生,具有维持外周免疫耐受,抑制效应T细胞增殖、Th17细胞分化和IL-47合成方面的重要作用[11]。目前的研究认为IL-35在不同疾病中呈现差异性表达,在类风湿性关节炎、支气管哮喘等自身免疫性疾病中是炎症抑制因子,随着疾病的控制,其水平呈上升趋势,可能与保护因子存在有关;而在慢性乙型肝炎等感染性疾病患者中重型感染患者IL-35水平明显高于普通患者[6]。其中关于IL-35在脓毒症病情发生、发展过程中所起到作用研究甚少,因此本研究旨在探讨IL-35在脓毒症病情严重程度及对预后的价值。本研究结果提示,脓毒症休克组及死亡组血清IL-35水平均明显上升,因此IL-35水平同脓毒症患者病情严重程度及预后相关。随着IL-35水平的升高,提示脓毒症患者的病情越严重,预后也越差。既往有研究显示IL-35水平变化会对外周血淋巴亚群CD4+及CD8+水平有所影响,而CD4+及CD8+水平的变化可进一步加剧IL-35的异常表达[12-13]。因此提示IL-35可预测脓毒症患者的感染程度,而且在脓毒症病情发展过程中可能参与其中的免疫调节。相关研究发现重症脓毒症患者炎症介质较脓毒症患者下降,抗炎介质会进行性升高[14],原因可能为在脓毒症休克期,机体处于“免疫麻痹”状态,抗炎介质的表达占主要优势,机体通过分泌IL-35发挥自我保护作用。但是也有研究得出相反的结果,即血清IL-35水平随着脓毒症病情的加重会逐渐降低,原因可能为随着脓毒症病情的加重,机体对炎性反应的抵抗能力下降,与机体呈现过度自身免疫反应状态有关[12]。
PCT因其较高的特异性,且SOFA评分作为一种经典的评分系统,二者被临床广泛应用于评估脓毒症患者的疾病严重程度及预后[10,15]。在本研究中PCT水平和SOFA评分越高,患者病情越严重,预后也越差。本研究通过ROC曲线分析,IL-35区分生存组和死亡组的能力弱于SOFA评分,优于PCT,其中 SOFA评分预测死亡的AUC、灵敏度和特异度均较高,这进一步证实SOFA评分为评估脓毒症预后的有效手段。IL-35为0.40 ng/mL时是区分生存组和死亡组的最佳截断值,并具有较高的特异度,这提示IL-35在预测脓毒症患者预后方面具有良好的应用前景,可以利用IL-35及其他监测指标可以对脓毒症患者进行危险分层,对脓毒症患者尽早开展个体化治疗,以改善预后。
本研究结果表明,IL-35在脓毒症病情严重程度的判断及预后的评估方面均具有较高的价值,并且提出了IL-35在脓毒症患者预后中的最佳截断值,为患者的免疫调理和治疗提供新方向和新选择。无论是提高IL-35的表达或者抑制IL-35的降解,可能为炎性疾病的治疗提供新的方法[16]。对于重症脓毒症患者可以进行适当的免疫调节治疗,以改善患者的预后。但是本课题仍然存在一些不足:(1)本研究只检测了脓毒症患者入ICU 24 h内的血清IL-35水平,未对入ICU后不同时间段的炎症因子水平进行动态监测;(2)本组纳入病例数相对较少,且只是一家医院收治的患者,因此均需在今后的工作中进一步实践,去验证IL-35截断值的评估效果。

