乌司他丁对人卵巢癌HO-8910PM细胞转移和侵袭的影响*
李 燕,李贵妃
(1.成都市妇女儿童中心医院妇产科,成都 610031;2.湖南师范大学医学院,长沙 410006)
卵巢癌是发病率位居第三而死亡率最高的妇科肿瘤,由于其早期症状不明显,早期诊断方法不成熟,因而早期即可发生广泛转移,发现时超过70%的患者已属晚期,由于广泛的腹腔转移而无法手术根治[1]。肿瘤细胞的迁移、侵袭和对基质的降解是卵巢癌发生转移的三大步骤[2]。其中,在肿瘤细胞穿透基底膜并降解细胞外基质的这个关键步骤中,多种蛋白酶发挥着至关重要的作用,尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator,uPA)就是其中之一[3]。
乌司他丁(ulinastatin,UTI)作为尿激酶抑制剂,是一种从人类尿液中提取纯化的糖蛋白,能有效抑制多种蛋白酶的活性,因而被广泛应用于弥散性血管内凝血、休克和胰腺炎等疾病的治疗[4]。UTI还具有抗肿瘤的作用,已有研究证实其对乳腺癌、人口腔表皮样癌、结肠癌等多种肿瘤细胞具有明显的抑制迁移和侵袭的能力,且其机制与UTI抑制肿瘤细胞中uPA的表达有关。目前国内对于UTI在人卵巢癌治疗方面的研究鲜有报道,为了研究证实UTI是否对人卵巢癌细胞的迁移和侵袭有抑制作用及其机制是否与uPA有关,本实验探讨了UTI对人卵巢癌细胞迁移和侵袭能力的影响,以及对 uPA表达水平的影响,为进一步研究UTI对人卵巢癌的临床辅助治疗提供理论基础。
1 材料与方法
1.1材料
1.1.1细胞及主要试剂 人卵巢癌细胞系HO-8910PM购买于中科院上海细胞库;胎牛血清和RPIM-1640购自杭州四季青生物工程材料有限公司;0.25%的胰酶购于美国GBICO公司;Matrigel购自美国BD公司;UTI购于广东天普生化医药股份有限公司;AMV Reverse Transcriptase 购自美国Promega公司;DreamTaqTMGreen PCR Master Mix购自Fermentas公司;DNA MarkerⅠ购自日本TaKaRa公司;β-actin 单克隆抗体购自美国Sigma公司;HaltTMProtease Inhibitor Cocktail蛋白酶抑制剂、M-PER®Mammalian Protein Extraction Reagent和uPA抗体购自美国Thermo公司,HRP偶联二抗购自美国Millipore公司;BCA Assay Reagent Kit、化学发光(ECL)试剂盒购自美国Pierce Chemical公司;其他常用试剂均为国产分析纯试剂。
1.1.2引物 引物用Primer Premier 5.0软件设计并经BLAST比对以后委托北京华大公司合成。uPA上游引物:5′-ACT CCA AAG GCAGCA ATG AA-3′,下游引物为:5′- AGA GTC TTT TGG CCA CAC TG-3′,产物长度469 bp。GAPDH上游引物为:5′- TAT AAA TTG AGC CCG CAG CC-3′,下游引物为:5′- ACA TGT AAA CCA TGT AGT TGA GGT-3′,产物长度244 bp。
1.2方法
1.2.1细胞培养 HO-8910PM细胞接种于含10%胎牛血清的RPIM-1640细胞培养液中,37 ℃恒温、5% CO2、饱和湿度的培养箱中培养,每2~3天换液。 实验所用的细胞均为处于对数生长期的细胞。
1.2.2实验分组及给药 将处于对数生长期的HO-8910PM细胞分为对照组和UTI 低、中、高剂量组,对照组加入100 μL磷酸盐缓冲液(PBS),UTI 低、中、高剂量组分别加入终浓度为400、800、1 600 U/mL UTI进行处理,处理后培养48 h再进行后续实验。
1.2.3划痕实验 细胞按照前述分组及各组处理方式处理48 h后经0.25%胰酶消化,制成5×105个/mL的细胞悬液,向6孔板每孔中加入2 mL细胞后放置于 37 ℃含5%CO2、饱和湿度培养箱中过夜,次日取出后用200 μL的黄色枪头于6孔板中划痕,用无血清的RPIM-1640培养液冲洗后,于显微镜下观察并拍照。培养48 h后,再次于显微镜下观察并拍照,用Image J 软件来测量划痕区域的细胞迁移距离。
1.2.4Transwell侵袭实验 Matrigel先用冰预冷的RPIM-1640培养基稀释成为2.5 mg/mL,按每孔25 μL加入24孔板的Transwell小室上腔,置于4 ℃冰箱过夜,使Matrigel聚合成胶。次日取对数生长期的对照组及各处理组细胞,经0.25%胰酶消化后,离心并用RPIM-1640培养基调整细胞密度至2×106个/mL。上室接种100 μL不含血清的细胞悬液,下室加入500 μL含10%胎牛血清的1640完全培养基起趋化作用。每组设3个复孔,放置37 ℃恒温、5% CO2、饱和湿度的培养箱中培养 24 h后,弃上室液体,擦净膜上未侵袭的细胞及Matrigel,经4%甲醛固定并用含 2%结晶紫的 2%乙醇染色,200倍光学显微镜下选择滤膜上下左右中5个不同视野,计数每个视野侵袭细胞数。
1.2.5反转录PCR(RT-PCR)检测细胞中uPA mRNA的表达 HO-8910PM细胞按照前述分组及各组处理方式加药处理48 h后,按照TrizolTMReagent说明书进行总RNA抽提,-20 ℃保存备用。1%琼脂糖凝胶(含溴化乙锭)100 V电泳15 min后凝胶成像系统检测RNA质量,紫外分光光度计测定RNA浓度和纯度。根据Promega公司反转录试剂盒说明书反转录合成cDNA,PCR反应体系为 20 μL,包括2×DreamTaqTMGreen PCR Master Mix 10 μL,cDNA 1.0 μL,上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L)0.5 μL,添加去离子水使总体积达到20 μL。反应条件:95 ℃预变性10 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,32个循环;72 ℃最终延伸10 min。GAPDH作为内参。取适量PCR产物在1.5%琼脂糖凝胶中电泳,凝胶成像系统扫描拍照,Image J 软件分析并计算目的基因uPA/GAPDH的灰度比值。
1.2.6Western blot检测细胞uPA的表达 HO-8910PM细胞按照前述分组及各组处理方式加药处理48 h后,迅速吸去培养液,并用冰预冷的PBS洗4次,每孔加入100 μL已加入HaltTMProtease Inhibitor Cocktail蛋白酶抑制剂的M-PER®Mammalian Protein Extraction Reagent,冰上放置30 min,间隔摇晃几次;用乙醇处理过的细胞刮子将裂解的细胞刮下来,转移至1.5 mL离心管。冰上超声裂解细胞60 s,冰上放置15 min;1 300 r/min、4 ℃离心30 min,吸取上清至另一洁净离心管中,分装后保存于-80 ℃。提取的蛋白采用Pierce公司的BCA Protein Assay Reagent Kit进行定量。蛋白变性后取40 μg于12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上先80 V电泳1 h,再120 V电泳4 h,电泳结束后,用湿转法将蛋白质转移到以聚偏氟乙烯(PVDF)膜上;取下PVDF膜用丽春红S染色,观察转膜效率。用含5%脱脂牛奶的-三乙醇胺缓冲盐水(TBST)室温封闭2 h;加入稀释的一抗,4 ℃冷室中轻摇过夜,次日TBST洗3次,每次10 min;加入TBST稀释的二抗,室温孵育2 h,TBST洗3次,每次10 min;增强型ECL试剂盒进行ECL检测,X光片压片、显影、定影。

A:显微镜下各组HO-8910PM细胞转移能力(×100);B:4组细胞迁移能力柱形图a:P<0.05,与对照组比较;b:P<0.05,与低剂量组比较;c:P<0.05,与中剂量组比较
图1各组HO-8910PM细胞转移能力比较
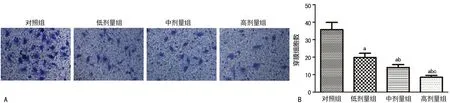
A:显微镜下各组HO-8910PM细胞侵袭能力(×200);B:4组细胞侵袭能力柱形图;a:P<0.05,与对照组比较;b:P<0.05,与低剂量组比较;c:P<0.05,与中剂量组比较
图2各组HO-8910PM细胞侵袭能力比较

2 结 果
2.1UTI对人卵巢癌细胞HO-8910PM转移能力的影响 划痕实验结果显示:与对照组相比,随着UTI浓度增加,细胞迁移能力呈明显减弱趋势,各组间比较差异有统计学意义(P<0.05),见图1。
2.2UTI对人卵巢癌细胞HO-8910PM侵袭能力的影响 HO-8910PM细胞经不同浓度UTI处理后行Transwell实验,结果显示:细胞经UTI处理后,穿过人工基底膜的细胞数明显减少,侵袭能力受到明显抑制,且呈浓度依赖,各组间比较差异有统计学意义(P<0.05),见图2。
2.3UTI对uPA mRNA表达水平的影响 RT-PCR结果显示:随着UTI浓度的升高,uPA mRNA的相对表达水平逐渐降低,各组间比较差异均有统计学意义(P<0.05),见图3。
2.4UTI对uPA蛋白表达水平的影响 各处理组细胞uPA的蛋白表达水平较对照组明显降低,随着UTI浓度的升高,表达水平逐渐降低,差异均有统计学意义(P<0.05),见图4。

1:对照组;2:低剂量组;3:中剂量组;4:高剂量组;A:PCR产物琼脂糖电泳条带;B:各组细胞uPA灰度值与GAPDH灰度值的比值柱形图;a:P<0.05,与对照组比较;b:P<0.05,与低剂量组比较;c:P<0.05,与中剂量组比较
图3各组HO-8910PM细胞uPA mRNA表达水平比较
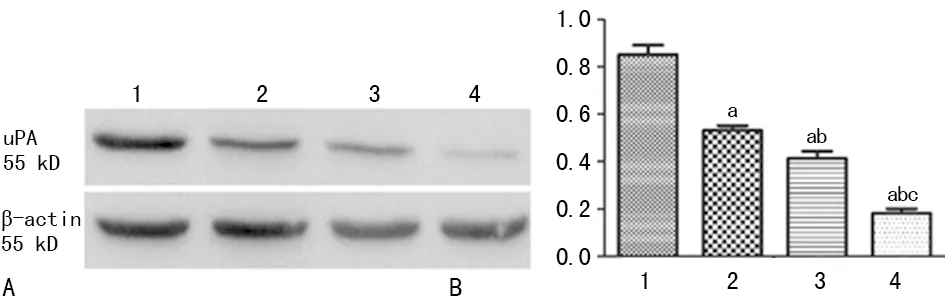
1:对照组;2:低剂量组;3:中剂量组;4:高剂量组;A:Western blot蛋白条带;B:各组细胞uPA灰度值与β-actin灰度值的比值柱形图;a:P<0.05,与对照组比较;b:P<0.05,与低剂量组比较;c:P<0.05,与中剂量组比较
图4各组HO-8910PM细胞uPA蛋白表达水平比较
3 讨 论
卵巢癌之所以是死亡率最高的妇科肿瘤,其最主要的原因就是其转移和复发率高。目前,传统的根治性手术联合辅助性化疗仍是临床上治疗卵巢癌的基本方法[5]。但由于高转移率及化疗的毒副反应,患者的生存率并没有提高。因此,探索卵巢癌侵袭转移的机制,从而有效地控制卵巢癌细胞转移,找到一种既能抑制卵巢癌细胞转移,又安全有效的药物,对改善卵巢癌患者的预后,提高其生存率具有重要的临床意义[6]。
近年来,uPA系统在肿瘤转移中的作用成为科学家们研究的热点,已有大量实验证实在乳腺癌、宫颈癌、卵巢癌、肺癌、口腔癌、结肠癌和前列腺癌等恶性肿瘤及其转移瘤中uPA的表达水平均比正常组织和良性肿瘤细胞要高[7]。uPA在卵巢癌的转移中也发挥着至关重要的作用,邹存华等[8]对卵巢癌HO-8910PM细胞的研究结果显示uPA所激活的纤溶系统在卵巢癌发生、发展过程中起重要作用。ZHANG等[9]的研究结果发现,卵巢癌中uPA的阳性率和血清学浓度均明显高于卵巢良性肿瘤和正常卵巢组织,uPA的表达和卵巢癌的病理分期和远处转移具有相关性。KONECNY等[10]对卵巢癌的研究表明,uPA的表达水平可以作为判断卵巢癌预后的独立因子,uPA低表达患者的肿瘤无进展生存期和5年生存率高于高表达患者。本研究中检测到HO-8910PM细胞侵袭能力与细胞中uPA mRNA表达水平和uPA蛋白表达水平呈正相关,通过抑制细胞中uPA mRNA和uPA蛋白表达水平可以明显抑制细胞的侵袭转移能力,这进一步证实uPA在卵巢癌的侵袭转移中发挥着重要作用。
在深入探讨uPA对卵巢癌侵袭转移作用的同时,课题组也在思考能否通过抑制uPA表达从而达到抑制卵巢癌转移的目的。本实验中用到的UTI就是一种新型的uPA抑制剂。UTI一种从人类尿液中分离纯化的尿胰蛋白酶抑制剂,能有效地抑制多种蛋白酶的活化,已被广泛应用于弥散性血管内凝血、休克和和胰腺炎等炎症性疾病的治疗。UTI还具有抗肿瘤的作用,已有研究证实其对乳腺癌、人口腔表皮样癌、结肠癌等多种肿瘤细胞具有明显的抑制迁移和侵袭的能力。目前国内外多个课题组认为其机制与UTI抑制肿瘤细胞中uPA的表达有关。杨超文等[11]对体外肝癌细胞的研究中发现,当UTI的浓度达到600 U/mL时,肝癌细胞SK-HEP-1细胞中uPA的mRNA和蛋白表达均减少,且随UTI浓度增加到900 U/mL时,uPA可能即是UTI作用的直接靶点或其下游靶点,从而发挥抑制肝癌细胞迁移和转移的作用。本文作者曾对高转移性绒毛膜癌细胞体外研究也显示uPA的表达水平与绒毛膜癌细胞的体外侵袭转移密切相关,且UTI 可以通过降低uPA的表达水平从而有效抑制绒毛膜癌细胞的转移[12]。KOBAYASHI等[13]对卵巢癌的研究中发现UTI的N-末端是UTI与肿瘤细胞结合位点,其C-末端则是抑制肿瘤转移的部位。然而,UTI抑制肿瘤细胞转移和侵袭的机制及UTI作用的靶点却仍不明确。鉴于国内对于UTI在人卵巢癌治疗方面的研究鲜有报道,本实验以高转移人卵巢癌细胞HO-8910PM为研究对象,以证实UTI是否对人卵巢癌细胞的侵袭转移有抑制作用及其机制是否与uPA有关。
本实验中,划痕实验结果显示UTI能够有效地抑制 HO-8910PM细胞的转移,且与UTI的浓度相关;预铺Matrigel的Transwell小室充分模拟了天然基底膜结构,侵袭实验结果显示UTI能明显抑制HO-8910PM细胞的侵袭性,且抑制作用与UTI的浓度相关。为了进一步探讨其转移和侵袭的机制,本研究用RT-PCR和Western blot方法检测了uPA的表达情况,随着UTI浓度的逐渐增加,uPA的mRNA和蛋白表达水平均逐渐降低,呈剂量依赖性,说明UTI 抑制卵巢癌细胞侵袭转移可能是通过抑制细胞中uPA的mRNA和蛋白表达来实现的。
由于UTI来源于人体,抗原性小,对机体毒副反应小,不同于常规化疗药物,有开发为安全有效的抗肿瘤药物的潜力,UTI有望通过下调卵巢癌细胞uPA的表达抑制卵巢癌的转移,减少常规化疗药物的用量,缓解化疗的毒副反应,改善预后。SONG等[14]对肝癌细胞的研究已经表明抗肿瘤药物表柔比星联合UTI应用可以明显改善肝癌预后。而本研究应用UTI干预HO-8910PM细胞后,细胞中uPA的表达水平下降,且与UTI 剂量负相关,同时其迁移和侵袭能力也呈下降趋势,由此推测其作用机制可能与UTI下调了与卵巢癌侵袭转移密切相关的 uPA基因表达有关,为UTI用于卵巢癌辅助治疗用药提供了理论依据和可能性,但具体作用机制还需进一步研究。

