多灶和多中心性乳腺癌与单灶乳腺癌的临床特征差异分析
张汉臣,林卓琛,王红莉,刘海晴,程子亮,吴 卓
(中山大学1.孙逸仙纪念医院放射科,广东 广州510120;2.公共卫生学院医学统计与流行病学系,广东 广州510080;3.孙逸仙纪念医院乳腺肿瘤中心,广东 广州510120)
在中国,乳腺癌是导致45岁以下的女性因癌症死亡的主要原因,仅次于肺癌[1]。乳腺核磁共振(magnetic resonance imaging,MRI)是检出乳腺癌最敏感的方法[2-3],能检出乳腺X线和超声影像检查无法检出的早期乳腺癌和小乳腺癌,有重要的临床应用价值。多灶性、多中心性乳腺癌(multifocal and multicentric breast cancer,MMBC)的确切定义在国际上尚未达成共识,目前认为多灶性乳腺癌是指单侧乳腺同一象限内2个或以上相互分离的恶性肿瘤,而多中心性乳腺癌是指单侧乳腺2个或以上恶性肿瘤位于不同象限内[4]。由于MMBC存在切缘不净、局部复发等潜在弊端,被列为保乳手术的相对禁忌证,乳腺MRI对发现多中心病灶,制定个体化手术方案有一定优势。但应用MRI评估MMBC也存在假阳性率较高并导致外科手术范围扩大等许多问题,未来越发需依据复杂的分子生物学检测结果为病人做出治疗方案的选择[5]。本研究通过对比MMBC与单灶乳腺癌(unifocal breast cancer,UBC)的MRI表现和病理特点,分析两者差异,并探讨MMBC和UBC不同分子亚型与临床治疗方式的对应规律,为更好地开展临床诊治工作提供依据。
1 材料与方法
1.1 研究对象
回顾性收集中山大学孙逸仙纪念医院2016年4月至2018年2月乳腺外科收治的55例MMBC患者以及随机选取的68例UBC患者。MMBC纳入标准:①经手术等治疗并且病理证实为乳腺恶性肿瘤,且病灶分布符合多灶、多中心性乳腺癌定义。②手术前行乳腺MRI检查。UBC纳入标准:①经手术等治疗并且病理证实为乳腺恶性肿瘤,且仅有单个病灶。②手术前行乳腺MRI检查。MMBC患者年龄范围27~75(46±11)岁;UBC 患者年龄范围32~74(51±11)岁。本研究经医学伦理委员会认可并且符合临床诊疗常规,患者均知情同意。
1.2 观察指标
参照美国癌症联合委员会(American join committee on cancer,AJCC)颁布的第8版乳腺癌分期系统,多灶性乳腺癌的T分期以最大肿瘤的最长径为分期依据[6],故本研究的MMBC均选取最大病灶进行评价。MMBC患者的病理学检查:最大病灶常规病理类型、免疫组织化学;MRI检查:最大病灶最长径、最大病灶强化表现。UBC患者的病理学检查:病灶常规病理类型、免疫组织化学;MRI检查:病灶最长径、病灶强化表现。乳腺癌患者临床治疗方法:乳腺癌手术方法、新辅助治疗和辅助治疗情况、远处转移情况。
1.3 MRI检查方法
采用西门子公司MagnetomAvanto l.5T超导磁共振仪磁共振扫描仪。参照ACR BI-RADS MRI标准[7],将乳腺异常强化病灶根据形态分为肿块样强化(masses enhancement,ME)与非肿块样强化(non-mass enhancement,NME),肿块样强化根据形状分为:卵圆形(oval)、圆形(round)、不规则形(irregular),非肿块样强化根据分布分为:局灶性(focal)、线样(linear)、节段样(segmental)、区域性(regional)、多区域性(multipleregions)、弥漫性(diffuse),根据时间信号曲线(timeintensity curve,TIC)分为:流入型(Ⅰ型)、平台型(Ⅱ型)、流出型(Ⅲ型)。
1.4 免疫组织化学诊断
免疫组织化学指标包括ER、PR、HER-2及Ki-67,其中HER-2-/+视为HER-2基因无扩增,HER-2++行FISH检测确定HER-2基因是否扩增,HER-2+++视为基因扩增。分子亚型分类参照2013年St.Gallen国际乳腺癌会议专家共识[8]:Luminal A型;Luminal B型,包括HER-2阳性和HER-2阴性2个亚型;HER-2阳性型;三阴(Triple-negative)型。
1.5 统计学方法
采用SPSS21.0软件进行统计学分析。计量资料中若符合正态分布的数据采用x±SD表示,若符合非正态分布的数据采用P50(P25~P75)表示。组间总体率或构成比的比较采用χ2检验。组间均数比较,不符合正态分布及方差齐性,采用非参数秩和检验。临床治疗方式与免疫组织化学间的关系采用对应分析(correspondence analysis,CA)。显著性水准采用0.05(双侧),P<0.05为差异具有统计学意义。
2 结果
2.1 MMBC与UBC患者病理特征比较
MMBC与UBC患者的常规病理类型及免疫组织化学分子亚型见表1。
2.2 MMBC与UBC患者MRI特征比较
MMBC与UBC患者的MRI最大病灶最长径见表2,MMBC、UBC组数据均不符合正态分布。MRI肿块样强化方式见表3。非肿块样强化方式见表4。分子亚型与病灶MRI强化方式比较结果见表5。MMBC与UBC的ME与NME见图1。
2.3 MMBC与UBC患者治疗方式比较
MMBC与UBC患者年龄相比具有统计学差异(P=0.016),MMBC患者年龄中位数44岁,UBC患者年龄中位数49岁,MMBC患者年龄较UBC患者小。MMBC出现转移远处13例,UBC出现远处转移4例。MMBC与UBC的临床治疗方式见表6。MMBC及UBC的CA计算结果表格见表7~9及表10~12。
CA是分析列联表中行、列因素对应关系的一种多元统计方法,将各因素的比例以点的形式表现出来,由高维空间的向量向低维空间投影,可以非常直观地看出变量之间的关系,近年来被广泛应用于疾病诊断、转归及预测等医学研究[9],投影图中的点位于同一象限且距离接近,代表其具有较强的关联性。根据分子亚型与治疗方式的分布特征,可将MMBC分为4组(图2),该图可解释79.8%的原始信息;将UBC分为3组(图3),该图可解释79.0%的原始信息。在图2中,Luminal B HER-2(+)型对应乳房切除术或保乳术后行辅助治疗;HER-2(+)对应新辅助治疗后行保乳术;Luminal B HER-2(-)型对应新辅助治疗后行乳房切除术;Luminal A型对应乳房切除术或保乳术。在图3中,Luminal B HER-2(+)型对应乳房切除术或保乳术后行辅助治疗;HER-2(+)对应新辅助治疗后行保乳术;Luminal B HER-2(-)型对应新辅助治疗后行乳房切除术。
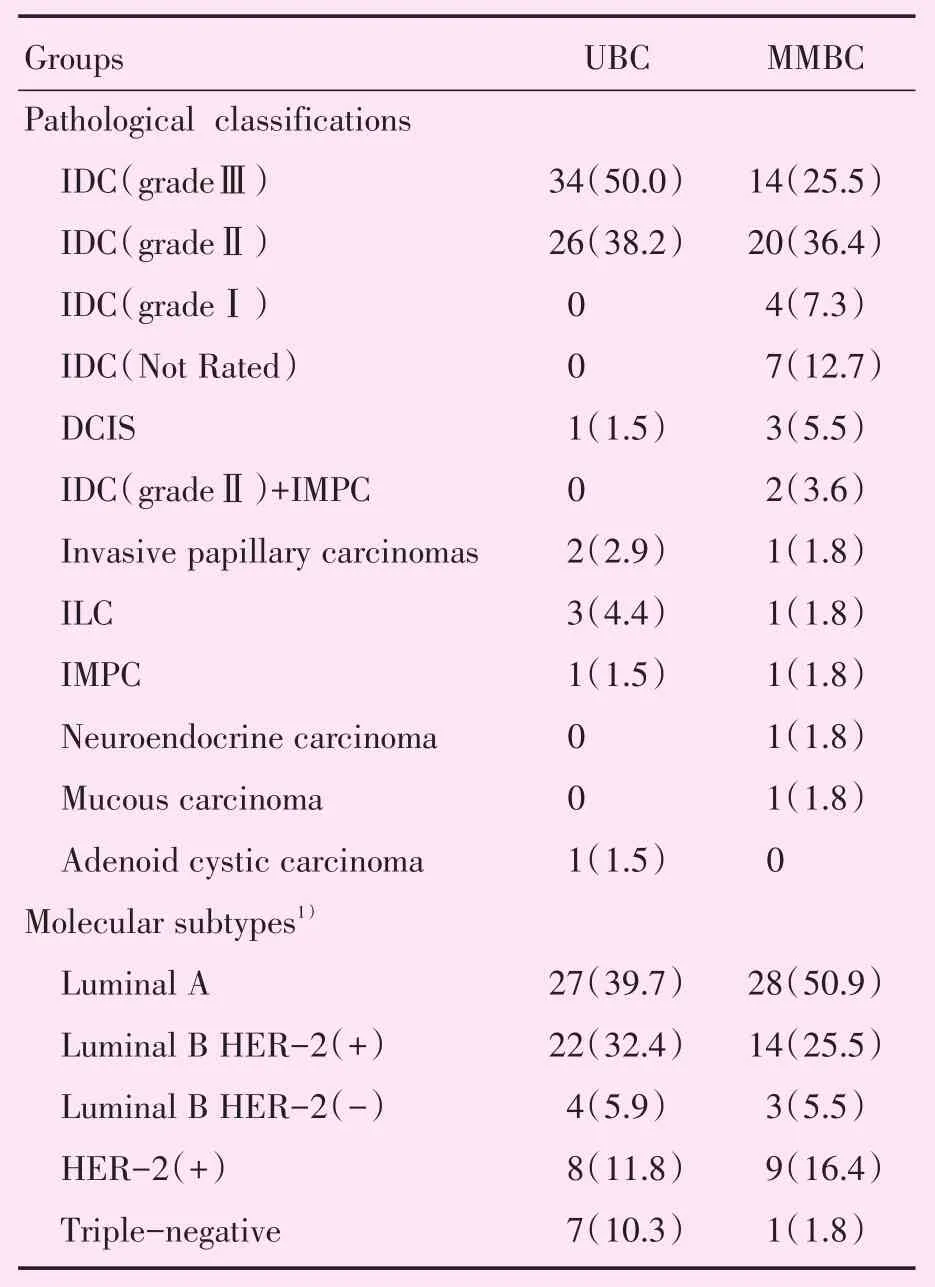
表1 常规病理类型及分子亚型Table 1 Routine pathological types and molecular subtypes [cases(%)]
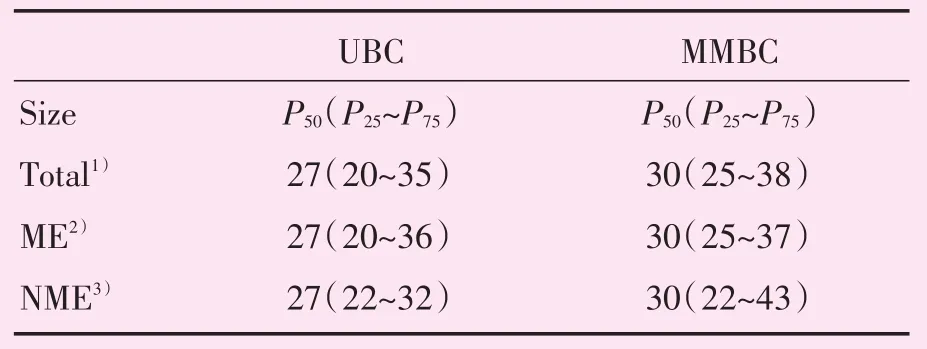
表2 MRI肿瘤最长径Table 2 MRI maximal tumorsize (mm)
3 讨论
MMBC的起源与发展机制尚未完全清楚,MMBC与UBC两者比较的研究较少,其特征可能存在较大的差异。乳腺动态增强(dynamic contrast-enhanced)MRI是诊断乳腺癌的重要手段,可通过增强后病变强化特征来反映病变的血供特性。本研究通过对比同期MMBC与UBC的临床、MRI与病理的差异,发现MMBC最大病灶病理类型中高级别浸润性导管癌比例明显低于UBC,但远处转移比例高于UBC,分子亚型及MRI强化方式两者无统计学差异,采用CA表明MMBC及UBC的分子亚型影响治疗方式,其中HER-2(+)、Luminal B型乳腺癌治疗方式关联性较高,三阴性乳腺癌治疗方式关联性较低。
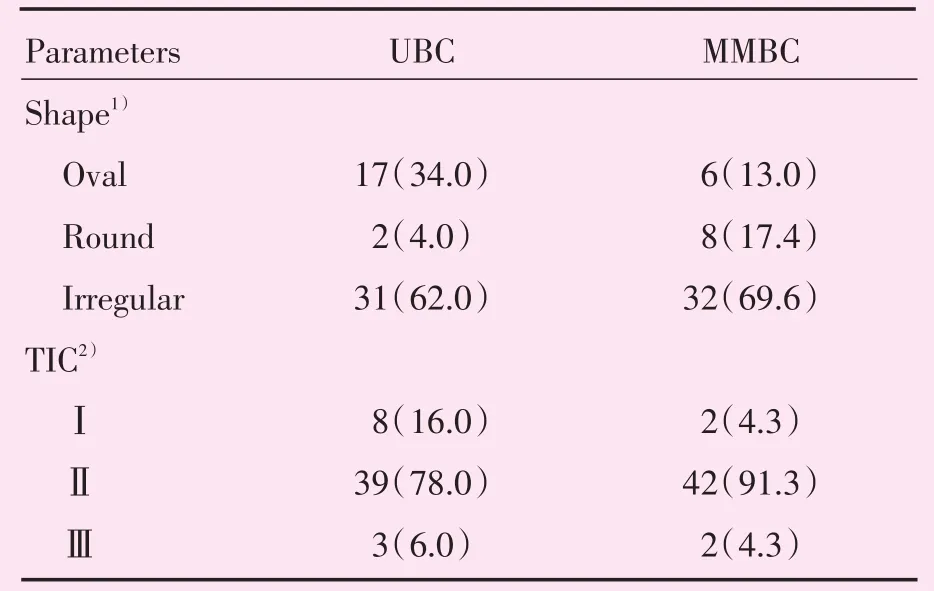
表3 MRI肿块样强化方式Table 3 Masses enhancement of MRI [cases(%)]
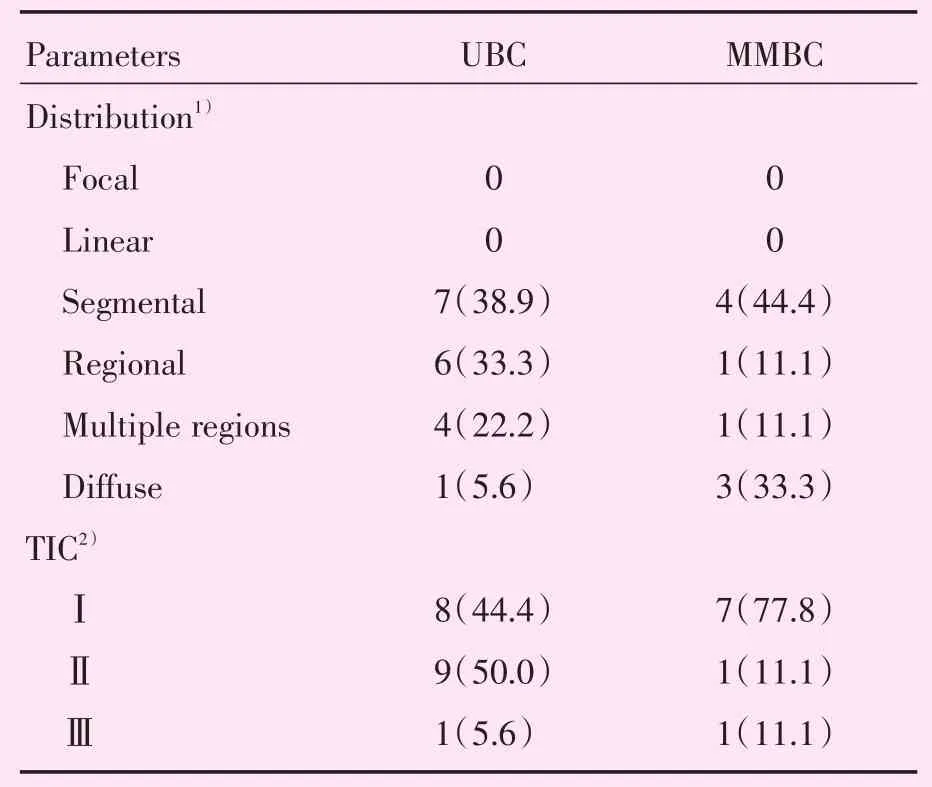
表4 MRI非肿块样强化方式Table 4 Non-mass enhancement of MRI [cases(%)]
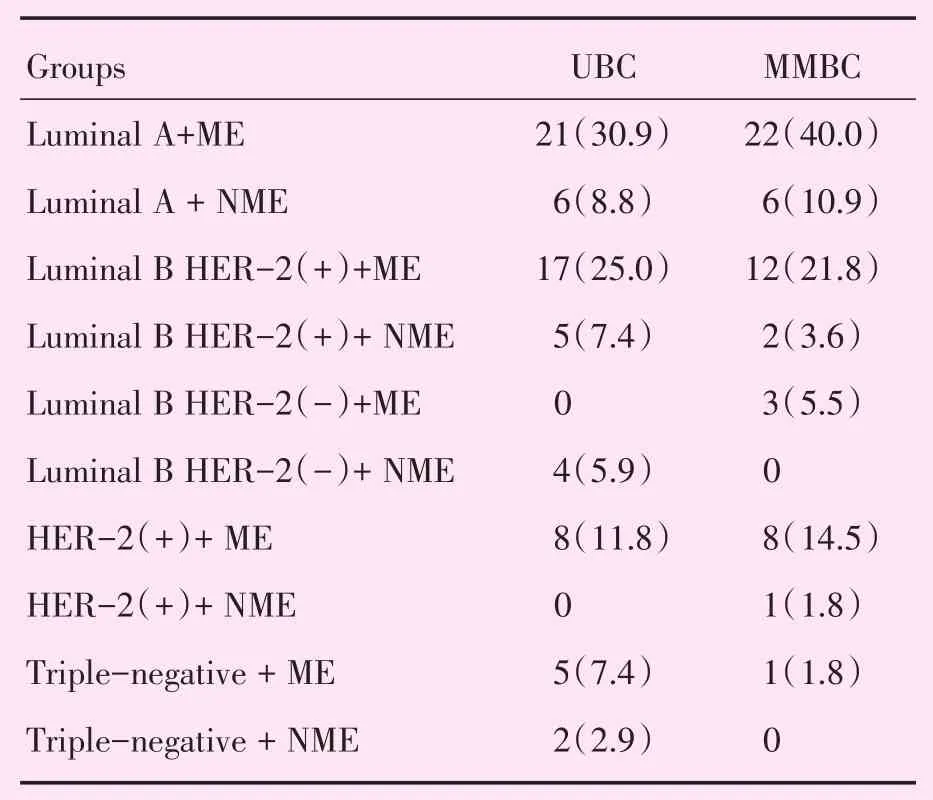
表5 分子亚型与MRI强化方式Table 5 Molecular subtypes and MRI enhancement[cases(%)]
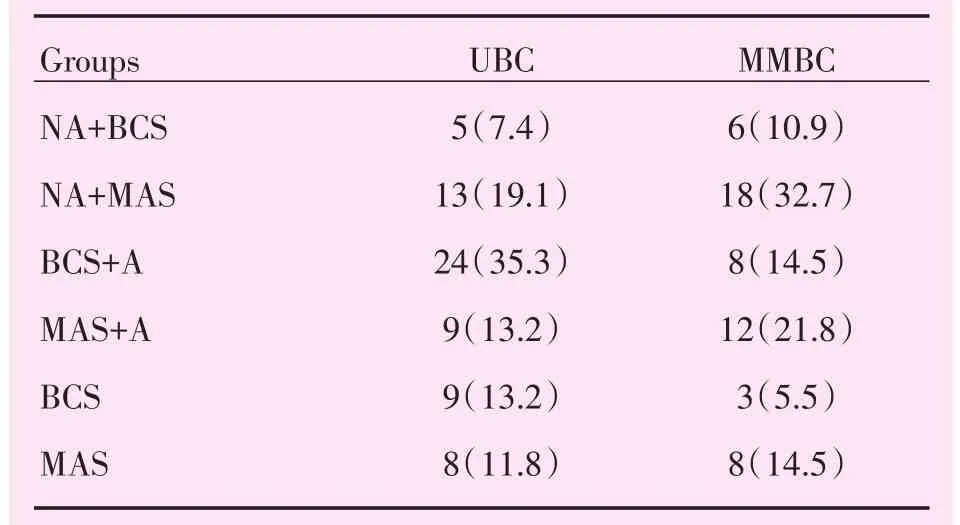
表6 临床治疗方式Table 6 Clinical treatment [cases(%)]
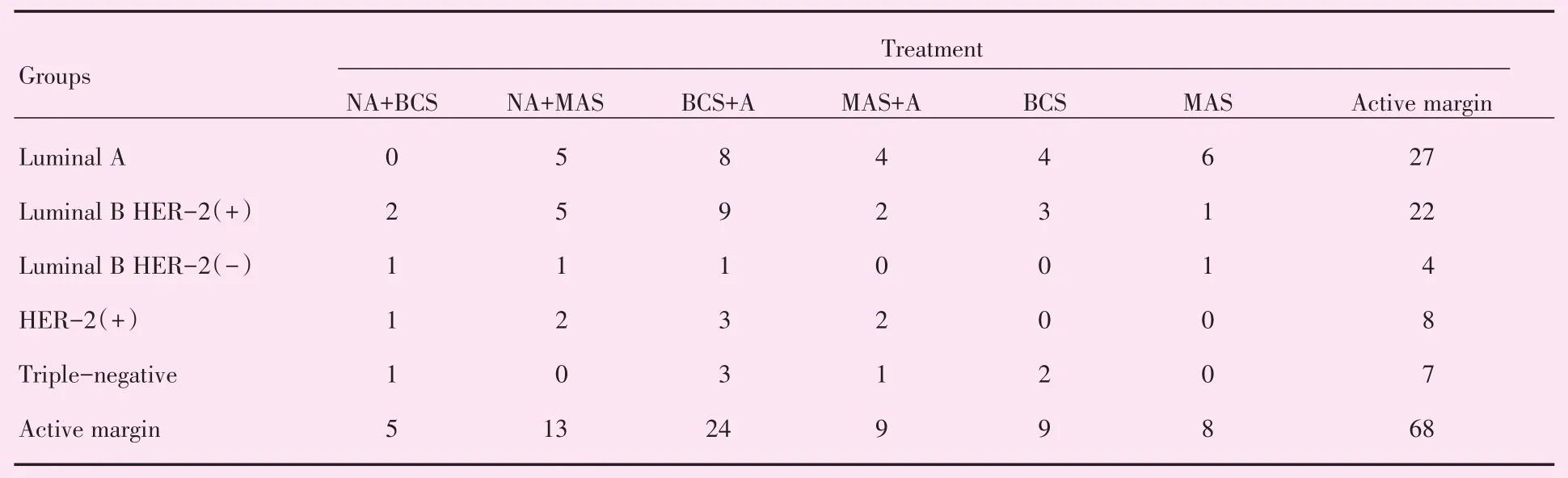
表7UBC对应表Table 7 Corresponding table of UBC (cases)
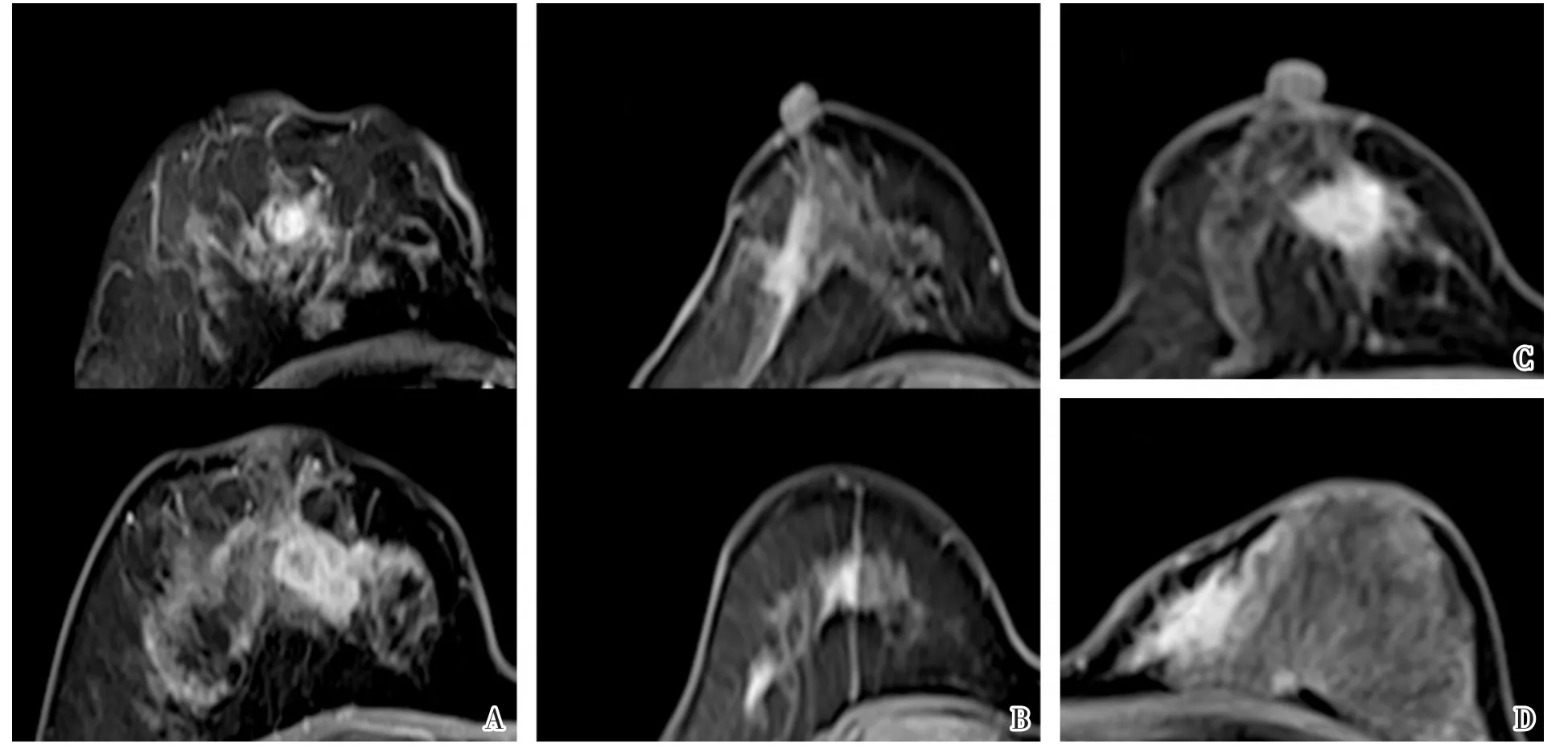
图1MMBC与UBC的ME与NME表现Fig.1 Presentation of MMBC and UBC as ME or NME
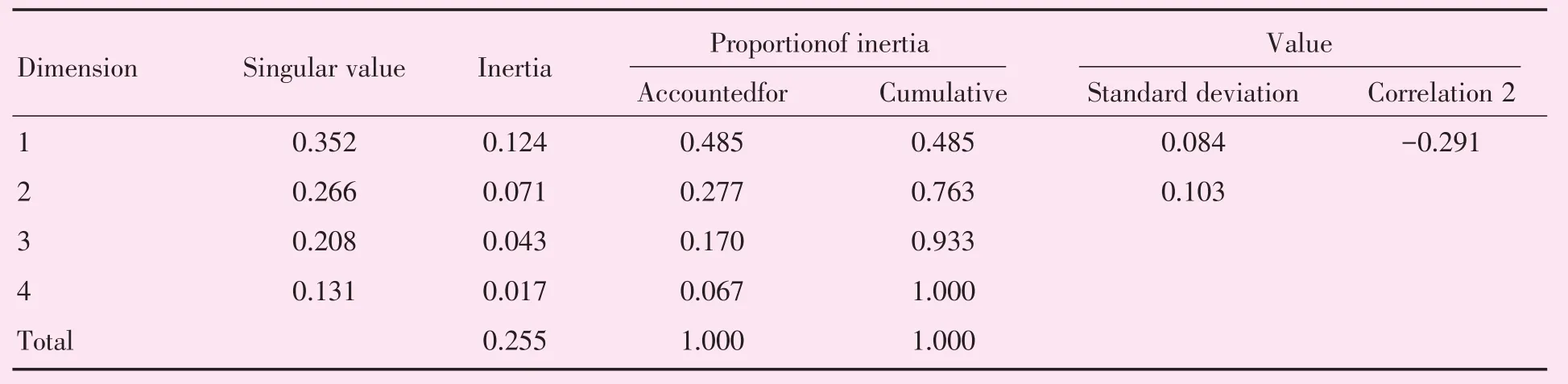
表8UBC摘要Table 8 Summary of UBC
MMBC患者的年龄小于UBC患者,提示年龄可能是影响MMBC的重要因素之一,这与Nutter等[10]的研究结果相似。在常规病理分型,MMBC的IDC占四分之三以上(81.9%),DCIS及Ⅰ~Ⅱ级IDC较UBC多(49.2%比39.1%),所以MMBC最大病灶的低级别浸润性导管癌的比例大于UBC。虽然MMBC最大病灶的高级别浸润性导管癌比例低于UBC,且MMBC最大病灶的长径与UBC无统计学差异,但MMBC出现远处转移例数明显多于UBC(13例比4例),说明MMBC的远处转移和多个病灶总的肿瘤负荷关系更密切,Fushimi等[11]对134例MMBC患者研究发现,多灶性与多中心性可能不是预后不良的预测因素,但所有浸润癌灶的直径总和与预后密切相关,Karakas等[12]的研究也提出MMBC所有病灶大小的总和相对于最大病灶长径,是一种更好的预测分类,虽然AJCC指南的T分期是以最大肿瘤长径为依据,临床工作中仍需注意MMBC在T分期有低估的可能。另外,由于肿瘤的异质性,各个病灶的组织学及分子分型可能存在差异,均可影响预后的不同。Grimm等[13]对441例MMBC患者的研究发现,在Luminal B型和HER-2(+)型中呈多灶性、多中心性表现者更为常见,但本研究中两者在MMBC和UBC中的比例没有明显差异,这可能与本研究样本量偏小有关,有待进一步研究。
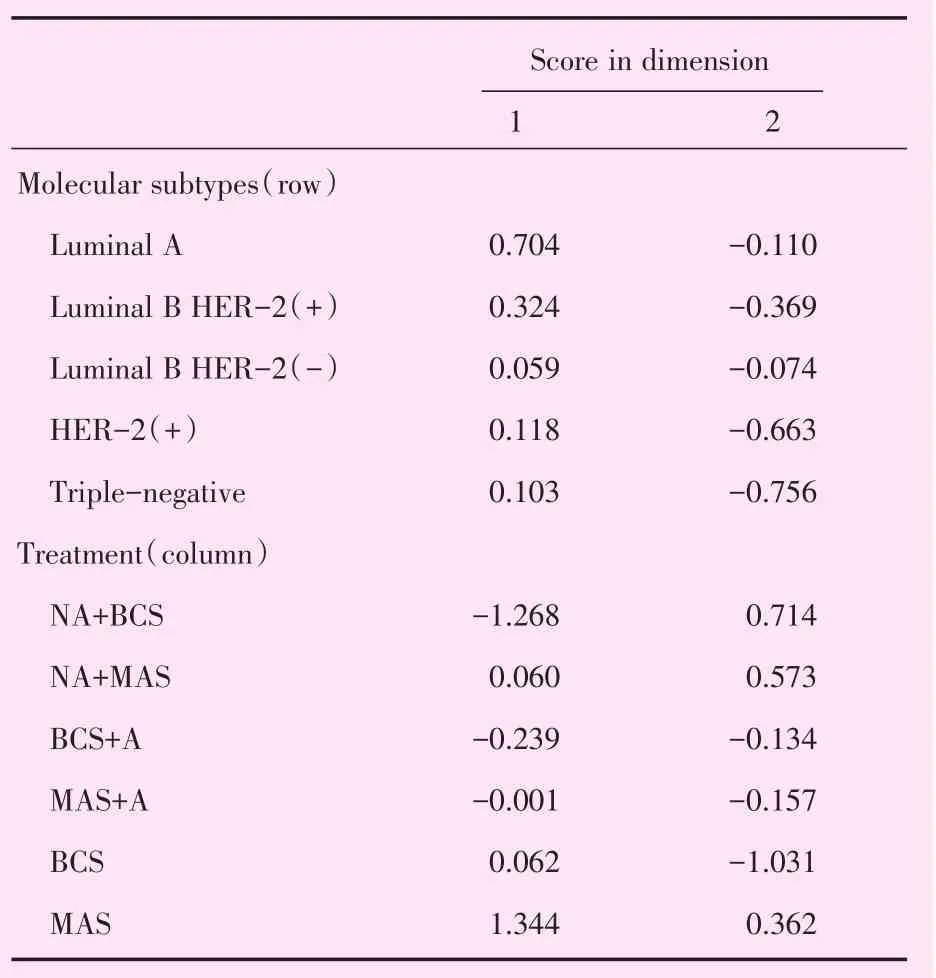
表9 UBC概述行和列点Table 9 Overview row and column points of UBC
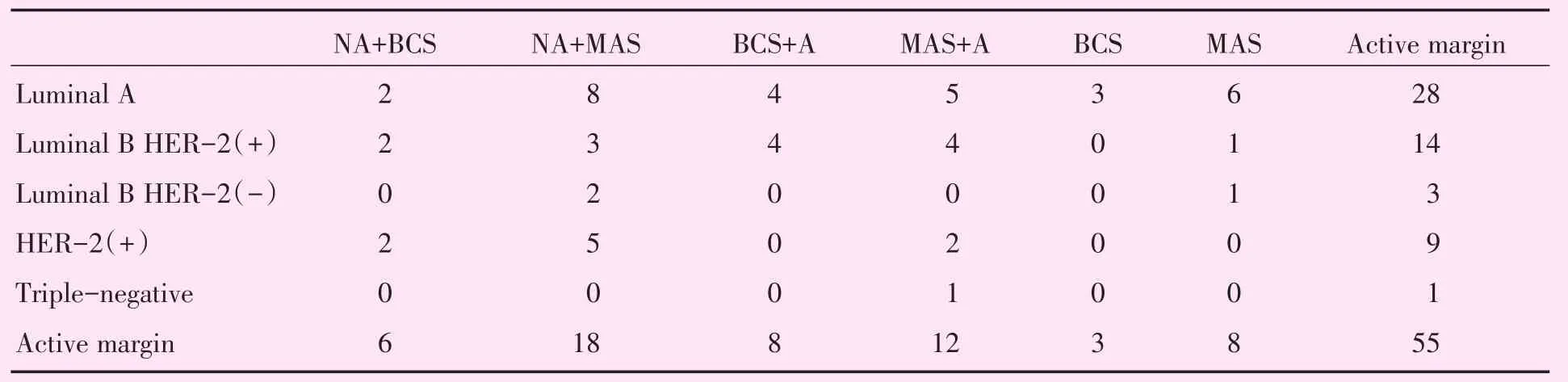
表10MMBC对应表Table 10 Corresponding table of MMBC (cases)
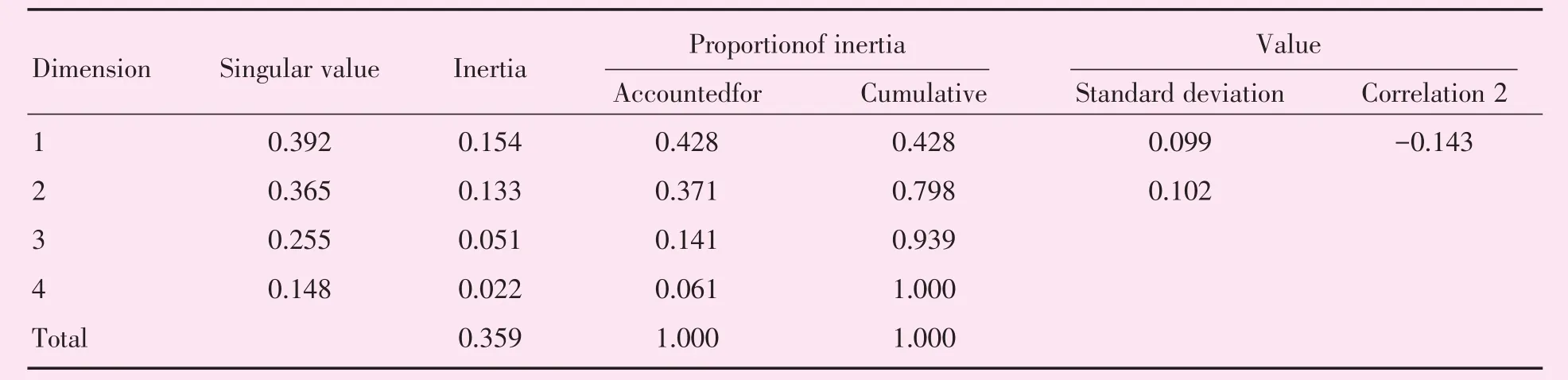
表11MMBC摘要Table 11Summary of MMBC
MMBC与UBC的肿块样强化比较,UBC中的卵圆形较MMBC多,MMBC中的圆形较UBC多,而不规则形在两者中都占大多数,乳腺癌的典型表现多为边缘不规则,这与Rabasco等[14]的研究结果相似,病灶不规则与恶性肿瘤向周围浸润生长及各个方向生长速度不一致相关;MMBC与UBC的非肿块样强化的分布方式无统计学差异。TIC作为半自动定量参数比传统而主观的评估方法更加精确、效率更高[15]。研究中MMBC与UBC的TICⅡ型都占绝大多数,二者的TIC类型无统计学差异。术前MRI有助于多灶多中心乳腺癌的检出,虽然MMBC的最大病灶病理类型与UBC有显著差异,MMBC最大病灶的高级别浸润性导管癌比例低于UBC,但MR强化表现与UBC相比无统计学差异,无论是MR形态学还是血流动力学的评估,MMBC的最大病灶和UBC具有相似的MR表现。
在CA图中,聚集在亚型附近的治疗方式与该亚型关系密切。MMBC患者中,Luminal B HER-2(+)型患者常倾向于乳房切除术或保乳术后行辅助治疗,且更倾向于乳房切除术后行辅助治疗;Luminal A型患者倾向于单纯行手术而不需行辅助治疗,这与Luminal A型预后较好相符;HER-2(+)型患者倾向于新辅助治疗后行保乳术,曲妥珠单抗在HER-2(+)乳腺癌新辅助治疗的标准地位已被广泛认可;Luminal B HER-2(-)型患者倾向于新辅助治疗后行乳房切除术,但两点距离较远。UBC患者中,Luminal B HER-2(+)型患者与MMBC患者相似,倾向于手术后行辅助治疗;HER-2(+)型患者倾向于新辅助治疗后行保乳术;Luminal B HER-2(-)型患者倾向于新辅助治疗后行乳房切除术,但与MMBC相似,两点距离较远;而UBC中的Luminal A型患者相对MMBC中的患者,其与单行手术方式点距离较远,而更接近于手术后行辅助治疗方式,这提示UBC中的Luminal A型患者乳腺癌检出时恶性度更高。在图2、3中Luminal B HER-2(+)型患者都接近于原点,关联性较低;相反,三阴性患者都距离原点较远,说明其治疗方式关联性较强,HER-2(+)型患者及三阴性乳腺癌患者保乳术后复发率较高、治疗效果差[16-17]。
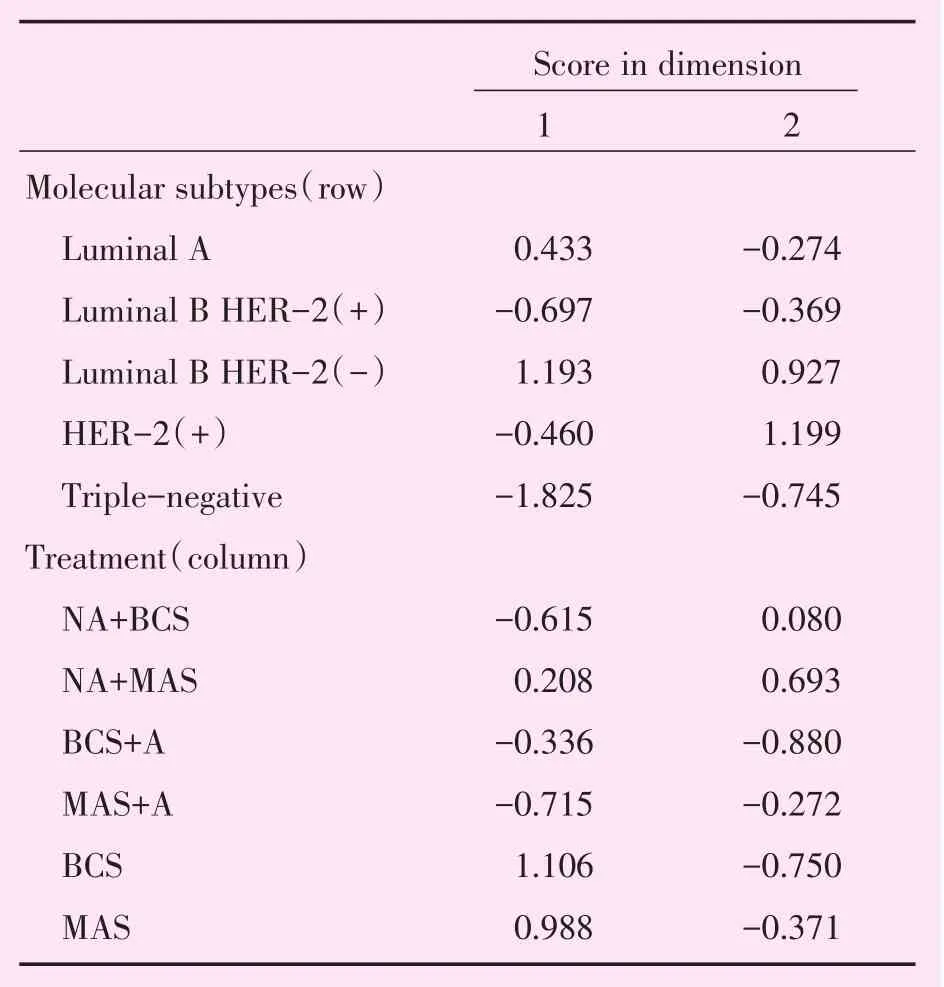
表12MMBC概述行和列点Table 12 Overview row and column points of MMBC
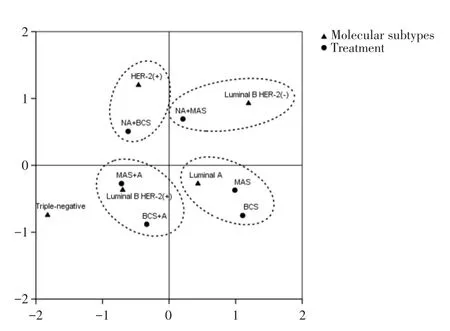
图2 MMBC的分子亚型与治疗方式的对应分析Fig.2 CA of molecular subtypes and treatment of MMBC
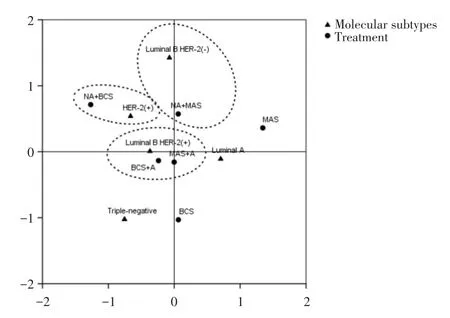
图3 UBC的分子亚型与治疗方式的对应分析Fig.3 CA of molecular subtypes and treatment of UBC
本研究存在以下不足:①样本量偏小;②研究的参数偏少;③多灶性、多中心乳腺癌大部分只有最大病灶的病理结果,未对每个病灶评价组织类型及分子分型,将在以后进一步研究。
综上所述,本研究通过回顾性分析我院收治并治疗的MMBC和UBC乳腺癌病例,对其MRI与临床、病理特征进行比较,无论MMBC还是UBC,MR强化表现无明显差异,分子亚型是影响治疗的主要因素,MMBC最大病灶的病理类型较UBC侵袭性低,但远处转移比例高于UBC,临床需基于乳腺癌肿瘤生物学特性,并全面考虑多个病灶总的肿瘤负荷拟定个体治疗方案。

