间充质干细胞通过诱导M2型巨噬细胞治疗急性肺损伤
孙 瑶,吕海金,易小猛,郭 俊,易慧敏
(中山大学附属第三医院外科ICU,广东 广州 510630)
急性肺损伤(acute lung injury,ALI)和/或急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是由多种病因导致的一种危重性呼吸衰竭,是常见的危重症之一[1-2],缺乏有效的治疗手段,病死率高达30%~40%[3-4]。因此,寻找一种新的有效的治疗手段十分有必要。间充质干细胞(mesenchymal stem cell,MSC)具有自我更新及多向分化能力[5],免疫原性低,有着强大的免疫抑制功能及抗炎能力,被应用到各种疾病的治疗研究中。目前已经有许多研究证明在各种急性肺损伤动物模型中,MSC可以提高存活率,增强细菌清除能力,能有效减轻肺部炎症,缓解急性肺损伤[6-7]。但其治疗及保护的具体机制目前仍不是很清楚。急性肺损伤时肺泡巨噬细胞是呼吸道的重要防线,也是损伤时的主要效应细胞,巨噬细胞的极化一般分为M1型和M2型。M1型巨噬细胞具有促炎作用,一般在急性炎症期占主要部分,可以由脂多糖(LPS)和γ-干扰素(IFN-γ)单独或联合诱导极化,能产生促炎因子如肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)等。M2型巨噬细胞具有抑炎作用,可以由白介素4(IL-4)诱导极化,能产生抑炎因子白介素10(IL-10)和转化生长因子(TGF-β),一般在炎症消散期占主要部分[8-9]。当小鼠巨噬细胞向M1型极化时,可以使其诱导型一氧化氮合酶(iNOS)和CD86的表达上调,向M2型极化时可以使CD206和Arg1的表达上调。从富含M1的巨噬细胞向富含M2的巨噬细胞转移可减轻炎症过程,促进组织修复和再生。控制肺部的过度炎症反应,维持促炎反应和抑炎反应平衡在急性肺损伤的治疗中起关键作用[10]。那么在MSC治疗过程中对肺泡巨噬细胞的状态是否有影响呢,是否可以通过调控肺泡巨噬细胞的极化发挥治疗效果呢。本研究探究MSC在治疗急性肺损伤时对肺泡巨噬细胞的影响,为治疗方向提供新的靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周龄,SPF级balb/c雄性小鼠,由广东省医学实验动物中心提供,许可证号:SCXK(粤)2013-0002。实验动物的管理及处置遵循广东省动物管理委员会准则及动物福利准则。
1.1.2 仪器 多维高清流式细胞分析仪(BD,LSRFortessa);荧光定量PCR仪(罗氏 LightCycler96);Transwell小室(Millipore,0.4 μm);显微手术器械(广州医药公司医疗器械批发中心);动静脉穿刺针(德国贝朗,18~20 g)。
1.1.3 试剂 脂多糖(Lipopolysaccharide,LPS)(Sigma,L4524);anti-mouse流式抗体 F4/80 APC(BioLegend,123116)、CD86 PE(BioLegend,105007)、CD206 FITC(BioLegend,141704)、INOS(BioLegend);anti-human 流式抗体 CD29、CD73、CD90、CD105、CD34、CD45、CD166、CD44(BD);qPCR 引物(北京擎科新业生物技术有限公司);吲哚美辛[前列腺素E2(PGE2)抑制剂]、LY2157299[转化生长因子β(TGF-β)抑制剂]、NLG-8189[2,3双加氧酶(IDO)抑制剂)(Sigma);mouse ELISA KIT,TNF-α(eBioscience/BMS607)。
1.2 人脐带MSC的分离、培养及鉴定
1.2.1 人脐带MSC的分离、培养 在产妇及其家属知情同意下及医院伦理委员会批准下,无菌条件下获取健康足月剖宫产脐带5~8 cm。冲洗干净,剔除脐静脉及脐动脉后,剪碎成约1 mm3的小块。取适量组织小块到10 cm的细胞培养皿中,加入10 mL MSC完全培养基,放入培养箱中培养,待有细胞爬出贴壁时,更换培养基,1周后取出组织块,继续培养,待细胞融合到80%~90%,按1∶3比例进行传代接种。第3~6代用于体内外实验。
1.2.2 脐带MSC的鉴定 ①表型鉴定:第4代MSC,吸去培养基,PBS洗两遍,用2.5 g/L胰酶消化下来,300×g离心5 min,弃上清,用PBS重悬并计数。每管细胞约106个,用100 μL PBS重悬,分别标记 anti-human CD29、CD73、CD90、CD105、CD34、CD45、CD166、CD44等抗体,涡旋,4 ℃孵育30 min,后每管加2 mL PBS洗两遍,洗去未结合的抗体,最后用250 μL PBS重悬,涡旋后上机进行流式检测。②成骨诱导分化:将第4代脐带MSC接种于6孔板中,待细胞融合达到90%,吸掉旧培养,加入成骨诱导完全培养基,每3 d换液,诱导14 d后用茜红素染色观察钙结节形成情况。③成脂诱导分化:同上,加入成脂诱导A液,诱导3 d后换液加入成脂诱导B液诱导1 d,反复7个循环后,进行油红染红观察脂滴形成情况。
1.3 建立小鼠急性肺损伤(ALI)模型
参考 Danchuk[11]和 Mei[12]的方法,采用 LPS 滴鼻法进行ALI造模。具体为:采用氯胺酮/甲苯噻嗪(Ketamin/Xylazine)混合麻醉剂90/7.5 mg/kg腹腔注射麻醉小鼠,将麻醉好的小鼠以上面两颗门牙为勾悬挂于4号线上,将小鼠舌头轻轻向一侧拉出,保持气道开放。根据体质量滴入相应的LPS(5 mg/kg)或等量的PBS。滴完后静止3~5 min,观察呼吸无异常后,将小鼠置于双手掌心,左右翻转使滴入液体在小鼠肺内分布均匀。
1.4 肺组织病理评分
取完整肺组织用40 g/L多聚甲醛固定,固定后取左肺叶行病理切片和苏木素-伊红(hematoxylineosin staining,HE)染色。光学显微镜下观察肺组织的病理改变,并进行肺损伤评分[13]。在光学显微镜下,每张片随机选5个高倍镜视野,对以下4个项目进行评分:①肺泡充血,②出血,③肺泡和肺间质炎症(肺间隙中性粒细胞集聚或浸润),④肺水肿程度(肺泡壁增厚或透明膜形成)。评分标准0分:最轻微损害,1分:轻度损害,2分:中度损害,3分:重度损害,4分:最严重损害,总分相加即为病理评分。
1.5 肺泡灌洗液的获取
经尾静脉注射MSC及PBS后48 h,采用10%水合氯醛深度麻醉小鼠,取仰卧位并固定四肢,使用动静脉置管进行气管穿刺,用1 mL注射器连接动静脉置管口,每次1 mL PBS,反复灌洗3次,回收的液体即为肺泡灌洗液(bronchoalveolar lavage fluid,BALF)。300×g,5 min离心后上清冻于-80 ℃度冰箱进行ELISA检测,离心得到的细胞,若红细胞较多可裂红,裂红后用PBS重悬计数。计数完后,剩下的细胞离心,用于流式检测及提取RNA。
1.6 肺泡灌洗液细胞和MH-S细胞流式检测
分别从体内及体外获得肺泡灌洗液细胞和MH-S细胞的单细胞悬液,细胞总数在(0.5~1)×106个细胞之间。将细胞重悬在100 μL PBS中,分别标记 anti-mouse F4/80 APC、CD86 PE、CD206 FITC流式抗体,方法同上MSC流式检测。
1.7 荧光定量PCR(qPCR)检测巨噬细胞CD86、TNF-α、CD206、IL-10、Arg-1的mRNA表达水平
根据Trizol使用说明书提取细胞总RNA,测浓度,取1 μg RNA用Takara逆转录试剂盒按照说明书操作,将RNA逆转录为cDNA。进行荧光定量PCR时,以GAPDH作为内参。采用SYBR Green Master(Rox)(Roche)在罗氏 LightCycler96仪器上完成操作。实验中所用的引物序列如表1所示。每组实验重复3次。
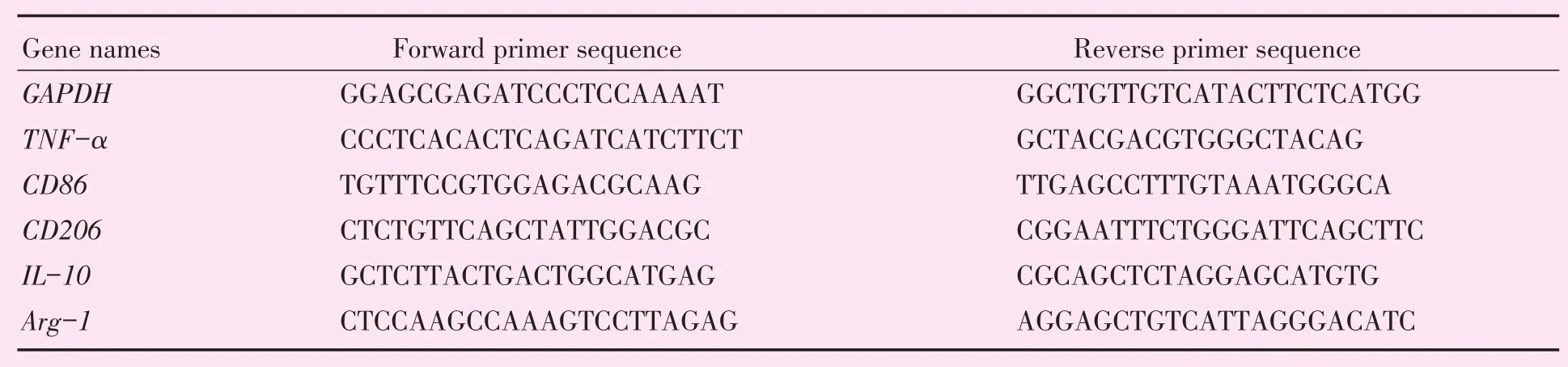
表1 用于定量RT-PCR的基因名称和引物序列Table 1 Gene names and primer sequence used for quantitative RT-PCR
1.8 ELISA检测
小鼠肺泡灌洗液300×g,5 min离心后得到上清,根据ELISA试剂盒说明书操作,检测小鼠TNF-α因子的浓度,每组重复3次。
1.9 统计学方法
采用SPSS 20软件分析数据,呈正态分布的计量资料以均数±标准差()表示,两组间的比较采用两独立样本t检验或t′检验或秩和检验,多个样本均数采用ANOVA分析或Kruskal-Wallis H检验,以Bonferroni法检验进行均数间多重比较;检验水准α=0.05,当P<0.05时,认为差异有统计学意义。
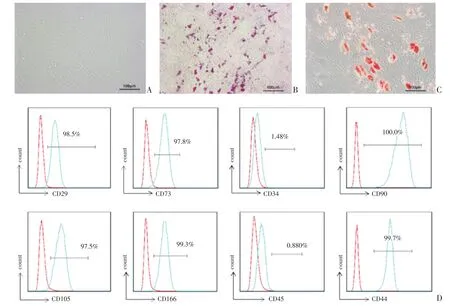
图1 脐带MSC的形态、成骨和成脂分化能力鉴定及表面标记鉴定Fig.1 Identification of morphological,osteogenic and adipogenic differentiation capacity and surface markers of umbilical cord MSC
2 结果
2.1 脐带间充质干细胞形态、成骨成脂分化能力鉴定及表型鉴定
MSC细胞呈贴壁生长,倒置显微镜下可见细胞呈长梭形,平行排列或旋涡状(图1A)。第4代MSC成骨诱导14 d后进行茜素红染色,可见细胞爬片上出现红色钙结节(图1B);成脂诱导28 d后行油红染红可见红色的脂滴(图1C)。用第4代的MSC进行表面markers标记,流式结果显示为CD29、CD90、CD73、CD105、CD166、CD44呈强阳性表达,CD45、CD34呈阴性表达(图1D)。
2.2 MSC在体外诱导小鼠肺泡巨噬细胞系(MH-S细胞)向M2型极化,该作用可以被PGE2抑制剂能逆转
将巨噬细胞和MSC共培养后,检测M2型巨噬细胞marker CD206、IL-10、Arg1。发现MSC可以诱导MH-S细胞向M2型极化,LPS+MSC组(n=3)CD206阳性细胞的比例较LPS组(n=3)明显升高(图2A;19.7%±0.6%vs 11.4%±0.7%,t=8.936,P <0.001),差异具有统计学意义(图2B)。在mRNA水平上,LPS+MSC组IL-10和Arg1水平也较LPS组明显升高,差异具有统计学意义(表2,图2C、D)。我们在MSC和巨噬细胞共培养体系中加入了MSC可溶性因子的抑制剂,发现加入PGE2 inhibitor(n=3)时CD206阳性细胞比例明显低于LPS+MSC组(n=3;8.4%±0.9%vs 18.5%±1.4%,t=6.137,P<0.01)。加入TGF-β抑制剂、IDO抑制剂,CD206阳性细胞比例差异没有统计学意义(图2E)。
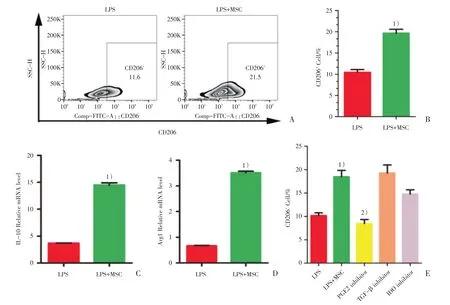
图2 MSC在体外诱导MH-S细胞向M2型极化,前列腺素E 2抑制剂能逆转该作用Fig.2 MSC induce MH-S cells to polarize to M2 phenotype in vitroand prostaglandin E2 inhibitor can reverse the effect
2.3 MSC有效改善小鼠ALI模型
接下来,我们利用LPS成功诱导了急性肺损伤模型;光镜下观察可见control组肺组织结构基本正常,病理评分低;ALI组有较多肺泡结构破坏,肺泡破裂、融合,肺泡有较明显的充血及出血,间质增宽,肺泡腔及间质有大量炎性细胞浸润,肺组织病理评分高;ALI+MSC组肺损伤程度明显减轻,炎性细胞浸润明显减少(图3A)。ALI组病理评分较高,ALI+MSC组(n=5)病理评分较ALI组(n=5)明显降低(4.2±0.4 vs 13.4±0.5,t=14.55,P < 0.001;图3B)。
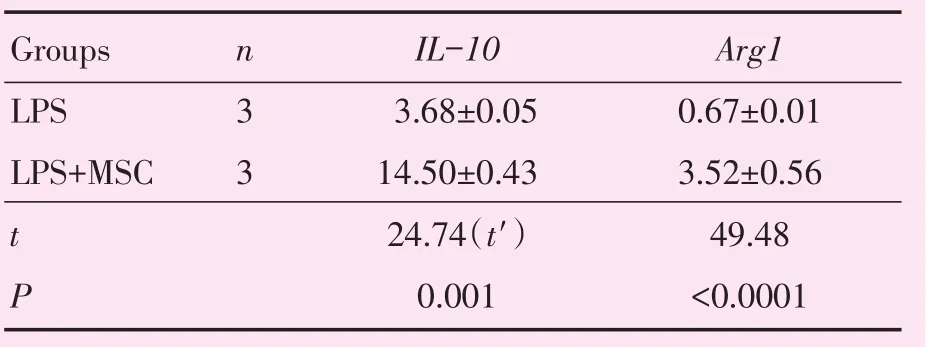
表2MH-S细胞的IL-10和Arg1 mRNA相对表达水平Table 2 Relative expression levels of IL-10 and Arg1 mRNA in MH-S cells
2.4 MSC治疗急性肺损伤模型伴随巨噬细胞向M2型极化
进一步为了研究MSC在体内对肺泡巨噬细胞的影响,通过对肺泡灌洗液流式检测发现,ALI+MSC组(n=3)CD206阳性细胞比例明显高于ALI组(n=3;37.6%±1.4%vs 8.5%±0.4%,t=20.09,P<0.001;图4A、B),ALI+MSC组(n=3)中INOS阳性细胞比例较ALI组(n=3)明显降低(5.90%±0.16%vs 40.27%±5.87%,t′=5.86,P=0.028;图4C、D)。肺泡灌洗液细胞中的TNF-α和CD86的mRNA表达水平较ALI组明显降低,CD206和IL-10的mRNA表达水平ALI+MSC组较ALI组明显升高(表3,图4E)。ELISA结果显示ALI组(n=3)TNF-α明显升高,ALI+MSC组(n=3)TNF-α浓度明显降低(412.3±6.5 vs 527.4±5.6,t=13.4,P <0.001;图4F)。
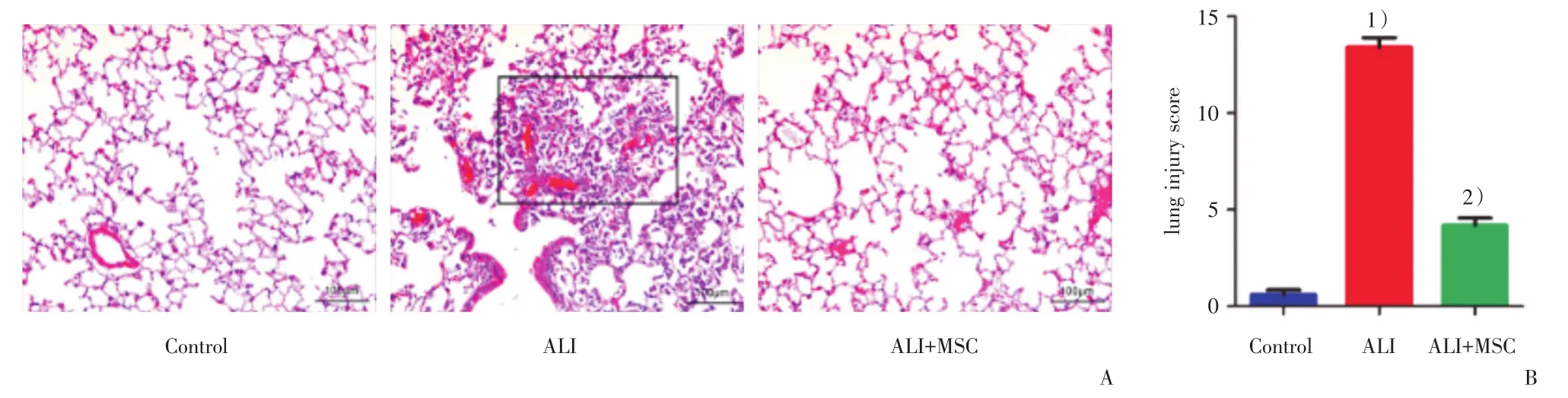
图3 MSC对LPS诱导的小鼠急性肺损伤病理学改变的影响Fig.3 The effects of MSC on histopathological changes in LPS-induced ALI in mouse
3 讨论
急性肺损伤发病诱因复杂,发病机制不明确,缺乏有效的治疗手段。在急性肺损伤病程中,肺泡巨噬细胞可以抵御呼吸道病原体,并在远端支气管及肺泡中参与炎症反应[14],是主要的效应细胞[15]。但因其根据所处微环境的改变具有向不同表型极化的特性,使其在急性肺损伤病程中成为一把双刃剑[16]。
表3BALF中细胞CD86、TNF-α、CD206和IL-10 mRNA相对表达水平Table 3 Relative expression levels of CD86,TNF-α,CD206 and IL-10 mRNA in BALF cells
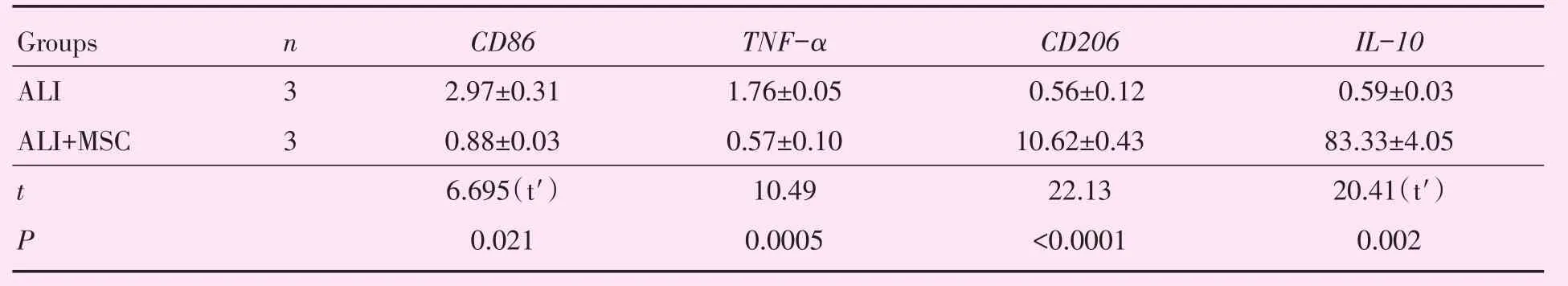
表3BALF中细胞CD86、TNF-α、CD206和IL-10 mRNA相对表达水平Table 3 Relative expression levels of CD86,TNF-α,CD206 and IL-10 mRNA in BALF cells
ALI:acute lung injury;MSC:mesenchymal stem cell.
?
已有研究证实,输注MSC治疗后可以减少促炎因子的产生,并能与巨噬细胞相互作用诱导产生IL-10[16]。并且MSC可以增强巨噬细胞的吞噬功能及杀菌功能[14],但是MSC与巨噬细胞之间的相互作用目前并不明确。我们用MSC在体外和小鼠肺泡巨噬细胞系(MH-S细胞)隔离共培养时,发现MSC可以诱导CD206阳性的细胞增多,并且IL-10的表达水平也比LPS刺激组明显增加。说明MSC发挥作用并不通过与巨噬细胞直接接触,而是通过旁分泌途径。许多研究已经证明MSC可以分泌多种可溶性因子,PGE2是其中的一种强效的免疫调节作用的因子。有文献报道,创伤时,PGE2能促进伤口处的巨噬细胞向M2极化从而促进伤口的修复[17],也有研究指出在小鼠过敏气道炎症模型中,当血液中PGE2浓度升高时,肺中的巨噬细胞向M2极化增多,并且这种增多可以被PGE2的抑制剂阻止。我们在MH-S和MSC共培养培养体系中加入PGE2、TGF-β、IDO的抑制剂,发现只有PGE2抑制剂可以明显逆转MSC对M2型巨噬细胞的诱导。有研究证明PGE2部分通过激活cAMP途径增强巨噬细胞细胞向M2极化,但潜在的机制尚不清,是否还通过其他途径来诱导M2极化,仍需我们进一步深入研究。
在本研究中,我们成功建立了小鼠急性肺损伤模型,输注脐带MSC后的确能缓解LPS诱导的小鼠急性肺损伤症状。MSC治疗组肺泡巨噬细胞CD206阳性的细胞比例明显升高,并且IL-10和Arg1的表达也是明显升高的。我们从体内体外均证明MSC能抑制炎症反应,促进抑炎因子的产生,在体外可以通过旁分泌途径诱导巨噬细胞向M2型极化。并且MSC发挥这种治疗作用是通过PGE2途径诱导巨噬细胞向M2型极化途径,但巨噬细胞发生这种表型改变的具体机制仍需要进一步研究。由此可以为MSC用于临床治疗ALI提供新的靶点和理论基础。
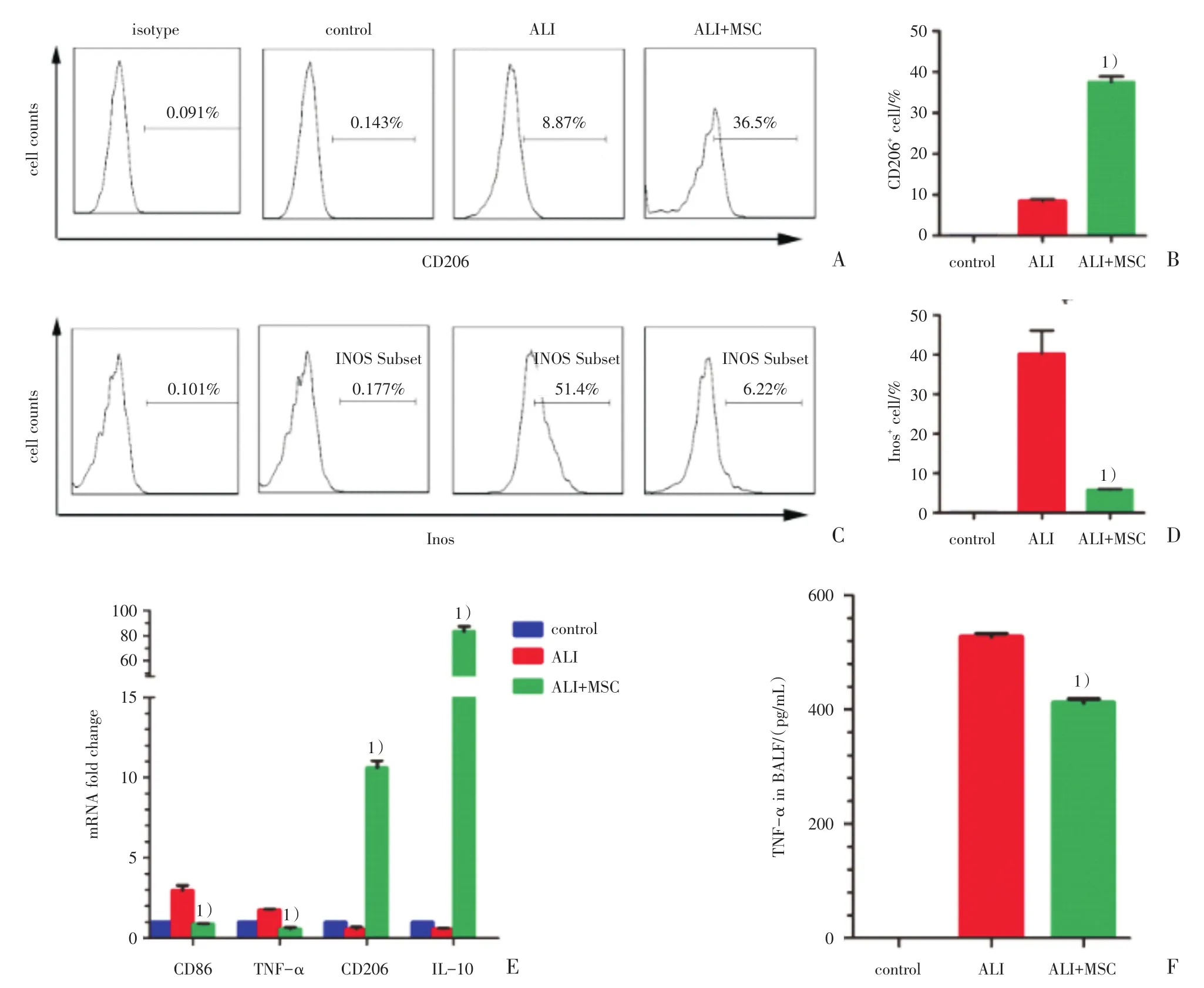
图4 MSC能诱导急性肺损伤小鼠肺泡灌洗液中的M2型巨噬细胞增多Fig.4 MSC can induce M2 macrophage increase in bronchoalveolar lavage fluid of mice with ALI

