应用流式细胞术鉴定死活结核分枝杆菌的实验研究
王伟亮,谢 贝,孟繁荣,王 楠,杨 瑜,刘志辉,谭守勇,张言斌
(1.广州医科大学,广东广州511436;广州市胸科医院2.结核内科,3.肺部疾病研究所,广东广州510095)
据WHO估计,2017年全球有约1 000万例结核病患者,其中利福平耐病例约56万、耐多药结核病例约46万,结核病为目前单因致死率最高的十大感染性疾病之一(其于HIV/AIDS),是全球的重大公共卫生问题[1]。利福平耐药病例和耐多药结核病例的流行与蔓延[2]对实现WHO提出的2035年全球终结结核病的宏伟目标构成了严重威胁[3]。挑战主要来自两个方面:一是没有较为理想的早期诊断方法[4],二是没有较多可供选择的抗结核新药[5]。就早期诊断而言,目前主要依据结核分枝杆菌药物敏感性试验和耐药基因分子检测[4,6]:前者耗时长,平均约需2个月;后者虽然快速,但技术要求较高、检测费用昂贵,且存在检测的准确性问题。另外,在同一样本中同时存在耐药菌与敏感菌的结核分枝杆菌异质性耐药更使结核分枝杆菌耐药性的准确鉴定困难加剧[7],高旭等[8]应用用基因测序和荧光定量PCR探针熔解曲线法检测结核分枝杆菌异质性耐药的相关研究显示,它们不能指示耐药菌比例低于20%的混合菌液。我们设想,若有一种方法能定量指示样本中的耐药菌与敏感菌,结核分枝杆菌的药物敏感性和异质性耐药的测定则可同时得到解决。此前,人们就对流式细胞术(flow cytometry,FCM)在此类问题中的应用进行了诸多探索[9-10],并已取得了全面的进步与辉煌的成就[11],其间也偶有利用FCM进行结核分枝杆菌药物敏感性测定的实验研究报道[12]。判断细菌对某种抗生素是否耐药的核心标志是一定条件下接触药物后能否存活,若人们可以找到能良好标记结核分枝杆菌活菌与死菌的荧光染料,而FCM能进行单细胞计数分析,两者相结合则可对样本中的死、活菌(亦即敏感菌和耐药菌)进行定量分析。前期研究中,我们探讨了6-羧基二乙酰荧光素(6-Carboxyfluorescein diacetae,6-cFDA)、荧光素双醋酸酯(fluorescein diacetae,FDA)、碘化丙锭(Propidium Iodide,PI)和SYTO9等染料对结核分枝杆菌的染色性能[13],本研究在此基础上选择了PI和6-cFDA两种染料用于死、活结核分枝杆菌的鉴定,并对其鉴定能力进行了系统的确证性实验研究,报道如下。
1 材料与方法
1.1 实验菌株
在本院结核病生物样本库中随机抽取-80℃冻存结核分枝杆菌临床分离株60株进行复苏培养;选择复苏培养生长良好的20株随机均分两组,按后续实验需求进行增菌培养。另外,从冻存库中取出结核分枝杆菌标准株H37Rv进行复苏培养与增菌培养,用于FCM分析方法建立,实验操作与临床分离株相同,具体操作见实验方法。研究所用结核分枝杆菌活菌菌液为新鲜培养且生长良好的对数期鲜活菌液;死菌菌液制备依据参考文献[14]将1麦氏浊度活菌菌液经85℃加热30 min处理而得,并经Middlebrook 7H10固体培养8周证实无细菌生长。实验工作经伦理委员会批准。
1.2 仪器与试剂
流式细胞仪FACSAriaTMⅡ为美国BD公司生产,细菌超声分散仪BACspreaderTM 1100为广东体必康生物科技有限公司生产;300目不锈钢细胞滤网购自翔博生物科技有限公司,Middlebrook 7H10固体培养基和Middlebrook 7H9液体培养基购自美国BD公司,PI购自美国LIFE公司,6-cFDA购自美国SIGMA公司,PBS(pH 7.4±0.1)购自杭州吉诺生物医药技术有限公司。
1.3 实验方法
1.3.1 复苏培养 考虑到-80℃冻存菌株仅约60%的复苏成功率,在生物样本库中应用随机数字表法随机挑选3倍于研究样本量的60株结核分枝杆菌临床分离株进行复苏培养。主要实验步骤包括:取出冻存菌株37℃恒温箱放置约24 h,取约0.3 mL冻存菌株混悬液接种于Middlebrook 7H10固体培养基斜面,置37℃恒温箱培养4周。
1.3.2 增菌培养 在60株复苏培养样本中挑选生长良好菌株20株,随机分为两组,一组用于平均荧光强度(mean fluorescence intensity,MFI)界值确定试验,一组用于性能检测试验。主要实验步骤包括:在复苏培养管中挑取菌落置于约4 mL Middlebrook 7H9液体培养基中,应用细菌超声分散仪制作1麦氏浊度的细菌混悬液,取约0.3 mL混悬液接种于Middlebrook 7H10固体培养基斜面,每一菌株接种2~3管,置37℃恒温箱培养4周。
1.3.3 PI、6-cFDA荧光染料贮存液配制 PI为1 mg/mL成品溶液,无须配制,置4℃冰箱避光保存。6-cFDA贮存液配制:称取6-cFDA 9.2 mg,加入20 mL二甲基亚砜(DMSO)溶解,待粉末彻底溶解后用孔径为0.25 μm的一次性针头式滤器过滤,配制成1 mmol/L的6-cFDA溶液,分装至EP管中(约130 μL/支)-20℃冰箱避光保存。
1.3.4 FCM分析菌液样本制备 取增菌培养生长良好的标准菌株、MFI界值确定试验菌株和性能检测试验菌株菌落,用无菌玻璃棒蘸取无菌生理盐水将菌研磨成菌液匀浆,加入适量无菌生理盐水混匀,再用细菌超声分散仪分散,经300目不锈钢细胞滤网滤过后,用无菌生理盐水配制2管(2 mL/管)1麦氏浊度的细菌混悬液,并将其中1管放至恒温水浴箱中85℃加热30 min。加热者即为死菌分析悬液,未加热者则为活菌分析悬液。另外,对死菌分析悬液加做Middlebrook 7H10固体培养实验,实验方法同上述增菌培养。
1.3.5 分析菌液PI与6-cFDA染色 临用前,取出PI、6-cFDA贮存液,在避光情况下解冻并应用PBS分别进行200、50倍稀释配制PI(5 μg/mL)和6-cFDA(20 μmol/L)工作液;在样品管中加入300 μL分析菌液,再向其中加入300 μL PI或6-cFDA工作液,充分震荡混匀,37℃恒温孵育30 min,即为流式细胞仪检测分析液。
1.3.6 流式细胞仪分析方法的建立与目的样本检测分析 首先,用荧光微球校准仪器的光路和液流系统,保证仪器各项指标在允许范围。其次,以结核分枝杆菌标准株H37Rv检测分析液建立FCM分析方法,FCM分析方法建立的主要原则如下:以生理盐水管和活菌管设前向角(FSC)和侧向角(SSC)的信号值为对数放大,根据FSC/SSC的信号情况调节电压;根据 FSC(log)、SSC(log)、FITC(log)、PE(log)等参数,找到细菌最集中的区域设门,同时建立直方图以计算PE、FITC通道上MFI,活菌管和死菌管互为对照。最后,依据建立的FCM分析方法分析目的样本。
1.4 统计学分析
采用SPSS 16.0统计软件进行统计学分析,正态分布计量结果以均数±标准差表示,非正态分布计量结果用中位数表示,正态性检验应用Shapiro-Wilk方法;活菌组与死菌组组间比较采用两个独立样本的t检验(正态分布时)或两个独立样本的秩和检验(非正态分布时),P<0.05为差异有统计学意义;利用受试者工作特征曲线(receiver operating characteristic curve,ROC)确定 MFI界值;性能检测中的准确度描述采用分类变量计数资料以例数(百分比)表示。准确度=(真阳性个数+真阴性个数)/总数,灵敏度=真阳性个数/(真阳性个数+假阴性个数),特异度=真阴性个数/(真阴性个数+假阳性个数),Youden指数=灵敏度+特异度-1,阳性预测值=真阳性个数/(真阳性个数+假阳性个数),阴性预测值=真阴性个数/(真阴性个数+假阴性个数)。
2 结果
2.1 FCM分析方法的建立
以结核分枝杆菌标准株H37Rv建立FCM分析方法:应用活菌FCM分析菌液设门如图1A;应用无菌生理盐水空白对照进行检测,其FSC/SSC二维散点图见图1B;应用死、活菌PI染色后的分析菌液进行FCM分析得PE通道的直方图1C和D;应用死、活菌6-cFDA染色后的分析菌液进行FCM分析得FITC通道的直方图1E和F。图1B表明设门适当,图1C、D表明PI染色能准确鉴定H37Rv死菌,图1E、F表明6-cFDA染色能准确鉴定H37Rv活菌。
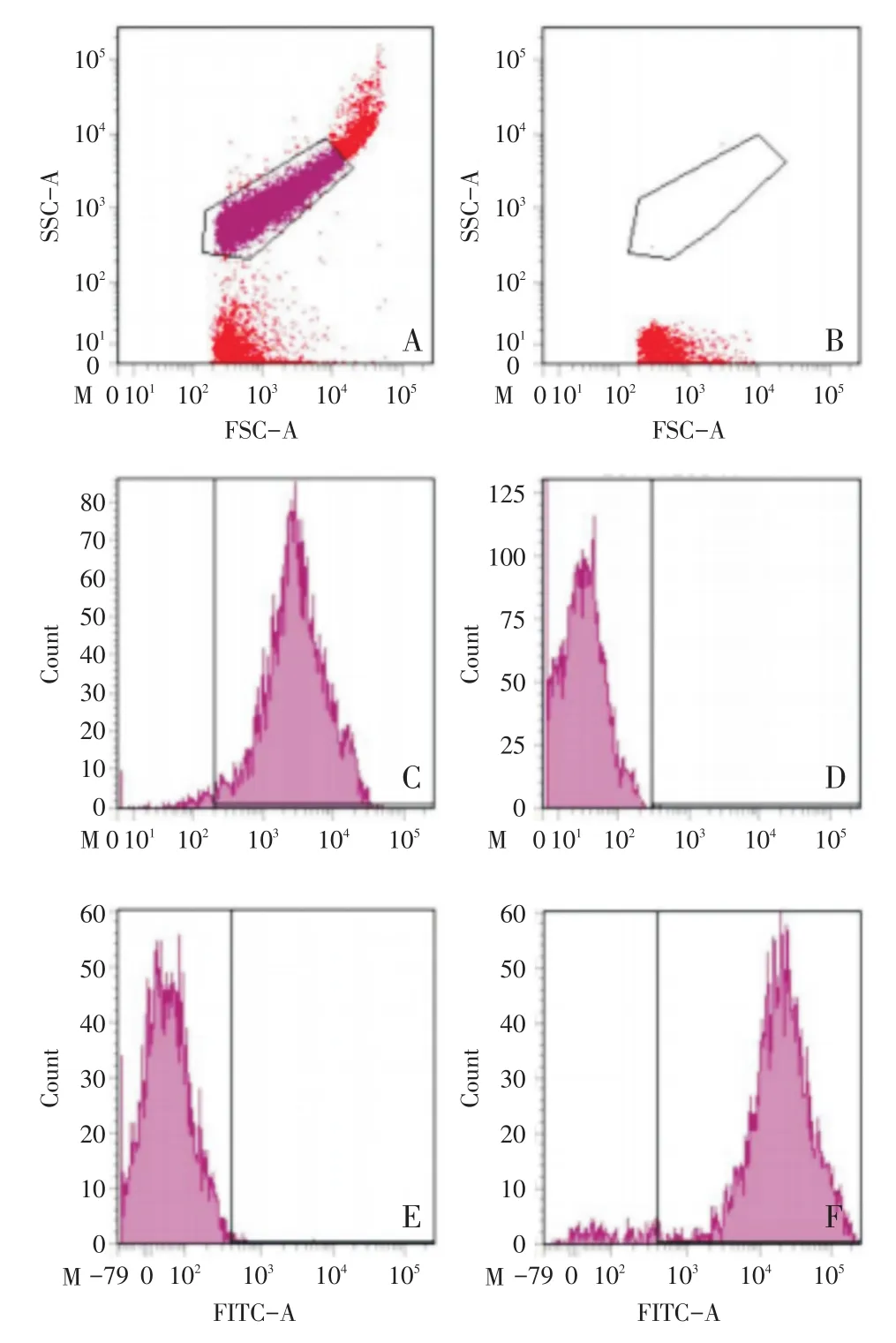
图1 标准株H37Rv死、活菌经PI或6-cFDA染色后流式细胞术检测结果Fig.1 Flow Cytometry Results of Dead or Living H37Rv Stained with PI or 6-cFDA
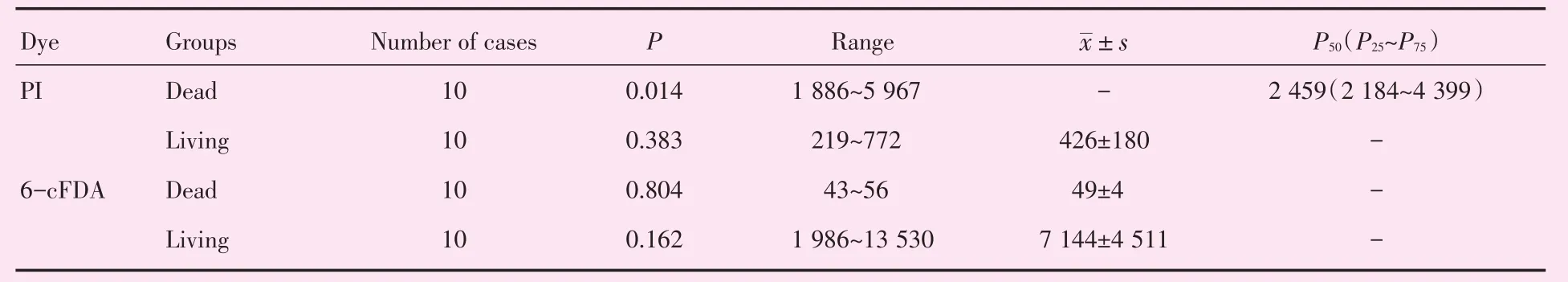
表1 结核分枝杆菌临床分离株PI或6-cFDA染色的MFI检测Table 1 Detection of MFI of clinical isolates of Mycobacterium tuberculosis after staining with PI or 6-cFDA
2.2 PI和6-cFDA染色鉴定死、活结核分枝杆菌的MFI界值确定
2.2.1 PI和6-cFDA染色样本MFI测定情况 10株死、活结核分枝杆菌PI染色的MFI值分别在1 886~5 967和219~772之间,死菌MFI值呈非正态性分布(P=0.014)、活菌MFI值呈正态分布(P=0.383);10株死、活结核分枝杆菌经6-cFDA染色的MFI值分别在43~56和1 986~13 530之间,均呈正态性分布(表1)。
2.2.2 死、活结核分枝杆菌PI和6-cFDA染色样本间MFI的比较 对于PI染色,死菌MFI值呈非正态性分布、活菌MFI值呈正态分布,经两个独立样本的秩和检验Mann-Whitney U=0.00;Wilcoxon W=55.00;Z=-3.78,双侧检验P=0.000,活、死菌之间PI染色后的MFI差异具有统计学意义。对于6-cFDA染色,死、活菌MFI值均呈正态分布,两样本所属总体方差不齐(F=25.635,P=0.000),经t′检验,t=4.973,P=0.001,活、死菌之间6-cFDA染色后的MFI差异具有统计学意义。
2.2.3 PI和6-cFDA染色鉴定死、活结核分枝杆菌的ROC曲线与MFI界值 依据MFI测定值分别绘制应用PI和6-cFDA染色鉴定死、活结核分枝杆菌的ROC曲线,如图2A和B。由图可见两者ROC曲线下的面积均为1.000,标准误差均为0.000,其95%的近似参考置信区间均为(1.000,1.000),说明两种染色方法用于鉴定死、活结核分枝杆菌的准确度均较高。综合灵敏度和特异度,PI染色鉴定死菌和6-cFDA染色鉴定活菌的MFI检测界值分别为1 329和1 021,此时两种染料鉴定死、活结核分枝杆菌的灵敏度均为1、特异度均为1。即当结核分枝杆菌菌液经PI染色后的MFI值大于1 329时,认为该菌液为死菌;当结核分枝杆菌菌液经6-cFDA染色后的MFI值小于1 021时,认为该菌液为活菌。综上,PI染色可以明确鉴定死结核分枝杆菌、6-cFDA染色能够明确鉴定活结核分枝杆菌。
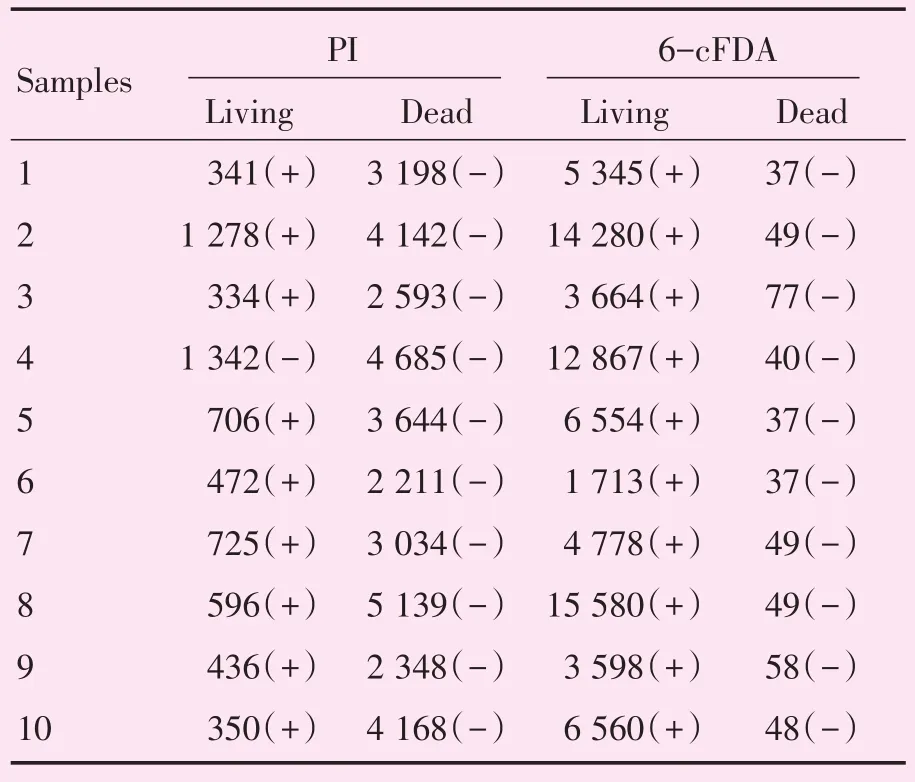
表2 PI或6-cFDA染色鉴定结核分枝杆菌临床分离株死和活Table 2 Identification of dead or living status of clinical isolates Mycobacterium tuberculosis by PI or 6-cFDA staining
2.3 应用MFI界值鉴定死和活结核分枝杆菌
应用不同于MFI界值确定的10株死、活结核分枝杆菌菌株进行测试,经PI染色10株死菌全部鉴定为死菌、10株活菌中有1株鉴定为死菌(其MFIPI为1 342,MFI6-cFDA为12 867),准确度为95%;经6-cFDA染色10株活菌全部鉴定为活菌、10株死菌全部鉴定为死菌,准确度为100%(表2),并对两种染料的鉴定性能进行评估(表3)。
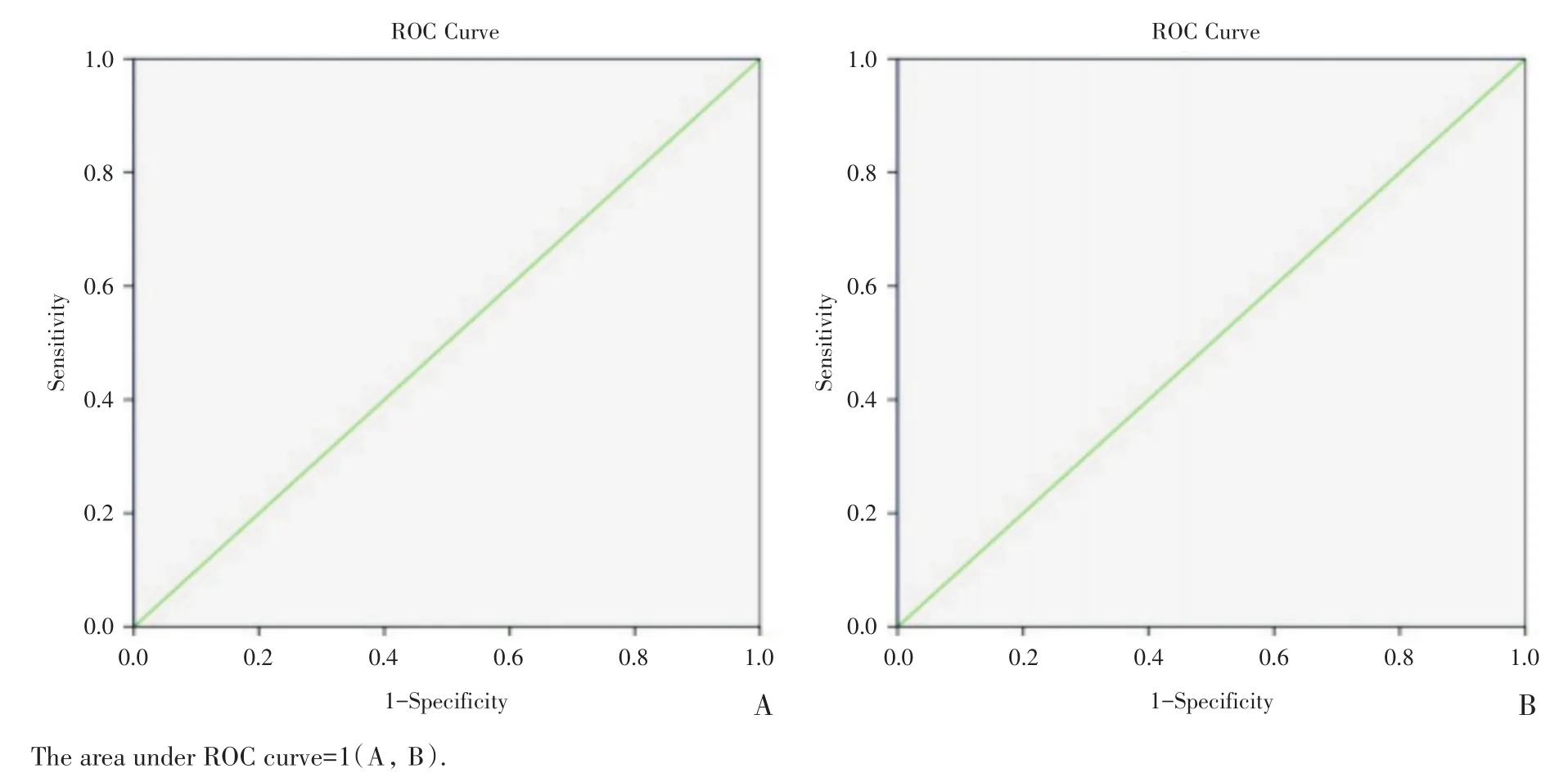
图2 PI染色鉴定死菌(A)和6-cFDA染色鉴定活菌(B)MFI的ROC曲线分析Fig.2 Analysis of ROC curves of PI staining MFI for dead bacteria detection(A)and 6-cFDA staining MFI for living bacteria detection(B)
3 讨论
对于细菌的活力迄今尚无直接测量指标,目前人们一般应用核酸染色、细胞膜功能试验、氧化还原反应和特定基因报告系统等间接评估细菌活力。PI作为一种非膜通透性染料,可以被完整的原核和真核细胞膜排斥于细胞膜外,只有当细菌活力严重降低或其它原因而致细胞膜完整性遭到破坏时,PI方能进入细胞以其菲啶环与细菌核酸结合并具增强荧光作用,因此PI染色着色即可显示细菌已无活力;6-cFDA则是膜通透性染料,经孵化后进入活性细胞被细胞内酯酶水解形成不能透过细胞膜的6-羧基荧光素而使细菌细胞产生荧光,死细胞则因缺乏活性酯酶而不能有效水解6-cFDA产生荧光[15]。我们的研究结果表明PI染色能准确鉴定加热致死的结核分枝杆菌死菌、6-cFDA染色可准确鉴定结核分枝杆菌活菌,此为人们应用FCM检测结核分枝杆菌耐药性与耐药异质性构建了基础性前提。目前我们尚未查见应用6-cFDA染色鉴定结核分枝杆菌死、活的相关文献,但对于PI染色鉴定结核分枝杆菌死、活,我们则注意到了罗燕辉等[16]有关PI不能区分结核分枝杆菌死、活菌的研究结果。本文与其结果的迥异是否源自PI染色时间的差异(文献[16]的染色时间为15 min,本研究为30 min)目前不得而知,有待探究。
从表1我们可以看到:本实验10例死菌PI染色MFI值的全距为4 081(5 967-1 886)、四分位间距为2 215(4 399-2 184),10例活菌6-cFDA染色MFI值的全距为11 544(13 530-1 986)、标准差为4 512。10例临床分离株死菌经PI染色后其荧光强度差异较大,反映出这10例临床分离株死菌对PI染料的透过性和结合力差异较大。10例临床分离株活菌经6-cFDA染色后荧光强度差别较大,反映出各临床分离株菌株酯酶表达量或其活力差异较大。这些数据充分说明:不同的临床分离株,无论是经非膜透性染料PI染过的死菌还是膜透性染料6-cFDA染过的活菌,其MFI值均具有较大的离散趋势。尽管如此,活菌PI染色和死菌6-cFDA染色的MFI值较为集中,因此不影响这两种染料对结核分枝杆菌死、活状态的鉴定。同时,不同临床分离株活力不同导致的染色后MFI值的差异,也从侧面说明了PI和6-cFDA的MFI值能很好的反应菌群中细菌活力的平均水平,具有进行结核分枝杆菌耐药性检测的潜力。为了消除临床分离株之间本身差异对检测结果的影响,对检测数值进行归一化处理,我们将更关注同一株临床分离株经药物处理前后MFI值的比值,而非其MFI值本身。
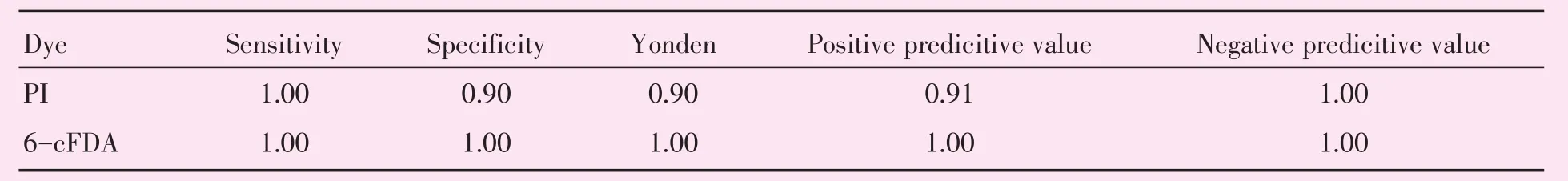
表3 PI或6-cFDA染色鉴定结核分枝杆菌临床分离株死、活的诊断性能Table 3 Diagnostic performance of PI or 6-cFDA staining for identification of dead or living clinical isolates of Mycobacterium tuberculosis
另外,我们在应用MFI界值鉴定死、活结核分枝杆菌的性能验证实验中发现:表2中的4号活菌经PI染色后MFIPI=1 342,此值略高于PI染色判断为死菌的界值(1 329),依据PI染色单个指标来看该样本应判定为死菌;但样本的制备过程及6-cFDA染色检测结果指示受检菌为活菌。为何如此?我们目前认为原因可能只有一个:该活菌菌液中既存在大量活菌又存在低比例的死菌,其低比例死菌的存在导致了PI染色的假阳性,但目前还没有很好的实验可以证实死、活菌的混合性存在,我们所开展的包括本实验在内的系列研究即旨在解决菌液中细菌活力异质性检测问题(此为细菌异质性耐药检测方法学中的关键技术问题)。这就提示我们:为最大限度消除受检细菌生命活力非均一性的影响,应用FCM检测细菌死、活宜以采用双染料染色为妥。尤其是在结核分枝杆菌耐药性检测及异质性耐药检测中我们必须虑及:抗结核药物作用下的结核分枝杆菌的活力状况可能远非加热处死结核分枝杆菌之死、活截然分开的状况。不同临床分离株因其本身活力的差异,会存在药物敏感性方面的差异,因此,同样条件的药物处理后不同的临床分离株会有不同比例的菌处于复杂的死、活菌中间态。这就使应用FCM进行结核分枝杆菌耐药性检测尤其是结核分枝杆菌异质性耐药检测呈现诸多困难,同时也许是近些年来此方面研究不多而相应技术止步不前的重要原因之一。但是FCM检测结核分枝杆菌耐药的方法相对于表型检测法快速[17],相对于基因型检测法准确,更具有定量检测结核分枝杆菌异质性耐药的潜力,正是这些优势敦促我们迎难而行。如何克服检测样本中细菌药物敏感性差异带来的非均一化问题将成为我们后续研究的难点,我们当努力为之。

