解毒清肺合剂对肺炎支原体感染大鼠肺组织NF-κB和p38 MAPK通路的影响*
严春霞,何国产,闻人庆,张艳芳
(金华职业技术学院,浙江 金华 321000)
肺炎支原体(Mycoplasmapneumoniae,MP)是常见的呼吸道感染致病原,可致严重肺炎,在世界各地均有发病,近年来已引起了研究者的关注。 MP感染的肺炎包括肺实质性肺炎、重症肺炎和支气管炎等,患者易出现发热、咳嗽、面色不好和食欲不振等症状[1-2]。MP可引起肺部严重炎症反应并可累及肺外组织和多脏器,引起脏器功能紊乱,严重影响了患者的身体健康甚至危害生命[3]。核因子κB(nuclear factor-κB,NF-κB)和p38丝裂原激活的蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)信号通路在炎症过程中发挥重要的作用,两者通过调控多种炎症因子,如白细胞介素12(interleukin-12,IL-12)、IL-13和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及炎性细胞的浸润促进肺组织炎症反应的发生、发展[4]。多项研究表明,NF-κB和p38 MAPK信号通路参与肺炎链球菌引起的肺炎,但NF-κB和p38 MAPK信号通路在MP感染肺炎中的作用报道较少。本研究以NF-κB和p38 MAPK信号通路为靶点,探索解毒清肺合剂对MP感染的肺组织的作用机制。
材 料 和 方 法
1 实验动物
清洁级SD大鼠30只,雌雄各半,7~8周龄,体质量(195.0±9.5) g。购自浙江省医学科学院动物中心[许可证号:SCXK(浙)2018-0029],实验期间饲养于重点实验室SPF级实验动物房。
2 试剂与仪器
MP标准株由丹麦Statens Serum 研究院提供;RIPA裂解液、ECL发光液和2×SDS-PAGE蛋白缓冲液购自北京鼎国昌盛生物技术有限公司;BCA蛋白定量试剂盒购自北京索莱宝科技有限公司;PVDF转印膜和SYBR Green PCR Master Mix试剂盒购自Bio-Rad;兔抗大鼠GAPDH、NF-κB p50、I-κBα和p38 MAPK抗体购自Abcam;HRP标记的兔抗山羊 II 抗购自Jackson Immuno Research;免疫组化试剂盒购自福建迈新生物技术开发有限公司;TRIzol RNA提取试剂盒购自Invitrogen;RNA反转录试剂盒购自TaKaRa;ELISA试剂盒购自上海蓝基生物科技有限公司。UV-1601紫外分光光度计购自Shimadzy;凝胶成像系统UVP;荧光定量PCR仪购自Eppendorf。
3 药物
解毒清肺合剂(北京中医药大学东直门医院,每瓶100 mL),8 mL/kg;地塞米松磷酸钠(天津金耀氨基酸有限公司)以生理盐水配制,0.5 mg·kg-1·d-1。
4 方法
4.1实验动物的分组与给药 雌雄各半SD大鼠40只,实验动物在SPF实验室适应 1 周后随机分为空白对照(blank control)组、模型(model)组、解毒清肺(Jiedu-Qingfei)组和阳性对照(positive control)4组,每组10只。根据文献报道[5]对实验大鼠进行建模,1%戊巴比妥钠腹腔注射麻醉大鼠,模型组、解毒清肺组和阳性对照组均鼻孔内缓慢滴入1×109CFU/L MP液100 μL,连续4 d,随大鼠自然呼吸吸入气道至肺部,空白对照组滴入等量的MP无菌培养液。各组均在接种完成后第2天处死1只大鼠进行MP核酸检测,同时其余大鼠开始灌胃治疗,空白对照组和模型组给予等量生理盐水灌胃,解毒清肺组每天给予8 mL/kg的解毒清肺合剂,阳性对照组给予地塞米松磷酸钠(0.5 mg·kg-1·d-1),连续治疗4周。
4.2样本的采集 治疗4周结束后,各组大鼠均有死亡,每组随机选取6只大鼠采集尾静脉血3 mL,室温静置30 min,1 500×g离心15 min,分离的血清置于EP管,-80 ℃保存;处死大鼠后,解剖暴露气管,将留置针插入气管,夹紧近端,用0.2 mL 预冷4 ℃无菌生理盐水反复灌洗4次,收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),-80 ℃保存;大鼠称重,腹主动脉放血处死大鼠,取右肺组织于4%中性甲醛溶液固定48 h,转移至0.1 mol/L PBS溶液中保存,用于病理形态和HE染色;另取左肺组织中叶,液氮保存;用于检测NF-κB p50、NF-κB抑制蛋白α(inhibitor of NF-κB α,I-κBα)和p38 MAPK的mRNA及蛋白水平。
4.3炎症因子的检测 采用ELISA方法检测血清和BALF中IL-12、IL-13和TNF-α水平,检测步骤严格按照试剂盒说明进行。
4.4肺组织病理评分 本次检测由专业科室病理医师进行随机检测,该评价系统由0~26分范围的可数评分组成,每张切片有5个分类评价系统组成,得分越高代表肺组织的炎症浸润程度越高[6]。得分组成由切片各部分分析,管腔周围浸润的支气管和细支气管数目、管腔内渗出程度、管腔周围浸润程度、血管周围浸润程度和实质性肺炎程度进行评分,再累计总分。对每侧肺分别评分,随后2侧分数相加除以2得出平均数为肺组织病理学评分。肺组织病理学评分标准:(1)细支气管和支气管周围浸润数目的百分比,0表示无;1表示少许(<25%);2表示许多(25%~75%);3表示所有(>75%)。(2)细支气管和支气管渗出,0表示无;1表示轻度腔闭合(<25%闭合);2表示重度腔闭合(25%~50%);3表示大多数腔闭合(>50%);(3)血管周围浸润部分的百分比,0表示无;1表示少(<10%闭合);2表示许多(10%~50%);3表示大多数(>50%);(4)细支气管、支气管浸润的定性,0表示无,见于正常动物,偶尔可见轻微浸润或者支气管周围淋巴样细胞团块;1表示轻度,伴有间断的环;2表示中度,新月形的环或者完整的环;3表示严重,完全的环,有>5~10个细胞厚度;(5)实质性肺炎,0表示无;1表示轻度,斑块实质性浸润;2表示重度,斑块出现融合的浸润。分数=(1)+(2)+(3)+(4)+(5)。
4.5RT-qPCR检测肺组织中mRNA的表达 提取RNA时,迅速从液氮中取出肺组织样品,无菌剪刀剪下0.5 g于5 mL试管中,TRIzol抽提总RNA,组织匀浆机匀浆30 s,提取总RNA。紫外分光光度计测定吸光度(A)值,记录A260/A280和A260/A230,根据测定值计算mRNA浓度。用反转录试剂盒反转录为cDNA,荧光定量PCR仪进行RT-qPCR检测mRNA表达水平,反应体系为20 μL(Ultra SYBR Mixture(2×)10 μL、cDNA 2 μL、上下游引物各0.4 μL、无RNA酶H2O 7.2 μL)。 SYBR Green法荧光定量PCR参数设置为:95 ℃预变性2 min、95 ℃变性15 s、60 ℃退火20 s、72 ℃延伸20 s,共40个循环。以GAPDH为内参照。根据NCBI相应的序列,按照引物设计原则,采用Primer Premier 5.0 设计引物,由上海生工有限公司合成,引物序列如表1所示。

表1 RT-qPCR实验的引物序列
4.6Western blot检测肺组织中蛋白的表达 取冻存大鼠肺组织样品约0.1 g,加入含1%蛋白酶抑制剂苯甲基磺酰氟的RIPA裂解液1 mL,裂解肺组织细胞,提取样本总蛋白。BCA法检测提取样品的蛋白浓度,记录562 nm处吸光值,绘制标准曲线,计算蛋白浓度。99 ℃煮沸10 min变性蛋白,分装储存备用。SDS-PAGE后将蛋白转于PVDF膜上,5%脱脂奶封闭液封闭1 h;稀释 I 抗4℃孵育过夜,TBST液洗膜3次,每次5min; II抗室温孵育2 h,TBST液洗膜3次,每次5 min。ECL法显影,用ImageJ对显影照片中的目的条带进行灰度分析。以GAPDH为内参照进行比对。
5 统计学方法
采集的原始数据用SPSS 20.0统计软件进行分析。计数资料用均数±标准差(mean±SD)表示。多组比较采用F检验,各组均数间的两两比较采用SNK-q检验;不同时点的组间比较采用重复测量方差分析。以P<0.05表示差异有统计学意义。
结 果
1 实验动物的一般情况
对各组大鼠接种后第2天进行MP核酸检测,PCR产物电泳发现模型组、解毒清肺组和阳性对照组于583 bp处有清晰条带,空白对照组无条带, 见图1。由此得知除空白对照组外其余大鼠均感染了MP,表明MP感染大鼠造模成功。每天对实验动物进行观察,发现感染MP第2天开始,大鼠出现明显倦怠,造模第4天,部分大鼠出现咳嗽,食欲不振。
2 大鼠肺组织的HE染色及肺组织病理评分
HE染色观察肺组织病理切片,统计肺组织病理评分,大鼠感染MP后模型组、解毒清肺组和阳性对照组肺组织出现炎性细胞浸润;治疗后解毒清肺组和阳性对照组炎性细胞浸润程度减轻,模型组仍存在炎性细胞浸润;治疗前后对照组变化不显著,均无炎性细胞浸润,见图2;治疗第1天模型组、解毒清肺组和阳性对照组肺组织病理评分显著高于空白对照组,4组病理组织评分差异具有统计学意义(P<0.05);治疗结束后模型组的肺组织病理评分显著高于空白对照组、解毒清肺组和阳性对照组,治疗后空白对照组和解毒清肺组、阳性对照组比较差异无统计学显著性(P>0.05),见表2。

Figure 1.Electrophoretic strip map of PCR products
图1 PCR产物电泳条带图
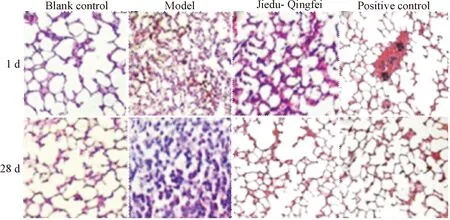
Figure 2.The pathological observation of the lung tissues (HE staining,×100).
图2 肺组织病理表现
3 治疗后血清和BALF中IL-12、IL-13和TNF-α水平
支原体感染后模型组血清的IL-12水平显著低于空白对照组(P<0.05),解毒清肺组和阳性对照组血清的IL-12水平显著高于模型组(P<0.05),与对照组比较差异无统计学显著性(P>0.05);支原体感染大鼠血清的IL-13和TNF-α水平显著升高,解毒清肺组和阳性对照组IL-13和TNF-α水平显著低于模型组,解毒清肺组与阳性对照组比较差异无统计学显著性(P>0.05),见表3。
表2 4组大鼠不同时点肺组织病理评分比较
Table 2.Comparison of pathological scores of lung tissues in 4 groups of rats at different time points (Mean±SD.n=6)

Group 1 d28 dBlank control5.56±1.465.61±1.24Model 15.03±2.41#13.05±1.89*#Jiedu-Qingfei13.85±2.16#6.21±2.37**Positive control13.67±2.13#4.15±1.05**
#P<0.05vsblank control group;*P<0.05,**P<0.01vs1 d in the same group.
支原体感染后模型组BALF的IL-12水平显著低于空白对照组(P<0.05),解毒清肺组和阳性对照组BALF的IL-12水平显著高于模型组(P<0.05),与对照组比较差异无统计学显著性(P>0.05);支原体感染大鼠BALF的IL-13和TNF-α水平显著升高,解毒清肺组和阳性对照组后IL-13和TNF-α水平显著低于模型组,解毒清肺组与阳性对照组比较差异无统计学显著性(P>0.05),见表4。

表3 4组大鼠血清中IL-12、IL-13和TNF-α水平的比较
*P<0.05vsblank control group;#P<0.05vsmodel group.

表4 4组大鼠BALF中IL-12、IL-13和TNF-α水平的比较
*P<0.05vsblank control group;#P<0.05vsmodel group.
4 肺组织中NF-κB p50、p38 MAPK和I-κBα的mRNA表达水平比较
RT-qPCR检测NF-κB p50、p38 MAPK和I-κBα的mRNA表达水平结果显示,与对照组相比,支原体感染的模型组NF-κB p50和p38MAPK的mRNA表达水平显著升高(P<0.01),解毒清肺组和阳性对照组NF-κB p50和p38 MAPK的mRNA表达水平与模型组比较显著降低(P<0.01),与对照组比较差异无统计学显著性(P>0.05);支原体感染模型组I-κBα的mRNA表达水平较对照组显著降低(P<0.05),解毒清肺组和阳性对照组I-κBα mRNA表达水平较模型组显著升高(P<0.05),解毒清肺组与阳性对照组比较差异无统计学显著性(P>0.05),见图3。
5 肺组织中NF-κB p50、p38 MAPK和I-κBα 蛋白的表达水平
Western blot检测肺组织NF-κB p50、p38 MAPK和I-κBα 蛋白表达水平的结果显示,肺组织中模型组的NF-κB p50和p38 MAPK蛋白表达水平显著高
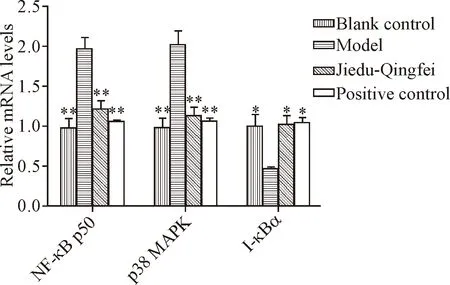
Figure 3.The mRNA expression levels of NF-κB p50, p38 MAPK and I-κBα.Mean±SD.n=6.*P<0.05,**P<0.01vsmodel group.
图3 NF-κB p50、p38 MAPK和I-κBα的mRNA表达水平
于空白对照组,解毒清肺组和阳性对照组蛋白表达水平显著降低(P<0.01);模型组的I-κBα蛋白表达水平显著低于空白对照组,经解毒清肺合剂治疗后其蛋白表达水平显著升高(P<0.01),解毒清肺组与阳性对照组无显著差异,见图4。
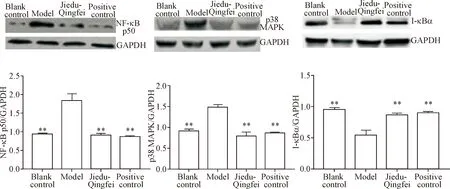
Figure 4.The protein expression levels of NF-κB p50, p38 MAPK and I-κBα. Mean±SD.n=6.**P<0.01vsmodel group.
图4 NF-κB p50和p38 MAPK和I-κBα 蛋白的表达水平
讨 论
免疫学研究认为,MP感染与免疫反应具有密切的联系,并且细胞和体液免疫共同参与MP引起的肺炎,MP所引起的肺炎所致损伤属于宿主自身免疫所致,并且多种细胞因子和炎性介质参与其中[7]。Th1与Th2在免疫反应处于动态平衡状态,但机体受到病原入侵时,动态平衡就会受到破坏[8]。MP感染患者引起气道高反应,影响Th1与Th2的动态平衡,影响细胞因子的产生和释放[9]。
清热解肺合剂组方有麻杏石甘汤加桔梗、僵蚕、牛蒡子、白花蛇舌草和黄芩等中草药,全方寒热相伍、升降结合,牛蒡子、白花蛇舌草和黄芩相伍清热,桔梗和僵蚕具有化痰之功效,麻黄和杏仁具有宣肺降肺之功效[10]。药物配伍起到清热解肺、祛痰化浊之功效。因此,使用此配方治疗肺炎支原体感染大鼠。
IL-12主要由Th1细胞分泌,IL-13主要由Th2细胞分泌,IL-12分泌不足时Th2反应加强[11]。IL-13可调节Th1和Th2细胞的平衡,参与炎症反应,促使气道上皮细胞分泌黏液。文献报道,MP感染后Th2细胞分泌增多,IL-13水平升高[12]。王志华等[13]报道,MP感染患者IL-13显著升高。本研究结果显示,MP感染后,血清和BALF中IL-13水平显著升高,IL-12水平显著降低,表明感染MP可引起机体IL-13和IL-12水平的显著变化,引起机体Th1与Th2平衡失调。解毒清肺合剂治疗后IL-13和IL-12与阳性对照组接近,恢复至正常水平,表明解毒清肺合剂可以抑制Th1与Th2失衡引起的炎症因子分泌失调。田芳等[14]研究表明,TNF-α与MP的发病有关,低浓度TNF-α具有抗感染、预防肿瘤等作用,高浓度的TNF-α可引起炎症反应。李梅等[15]报道,MP感染患者的TNF-α水平较对照组明显升高。本研究结果显示,MP感染模型组大鼠血清和BALF中TNF-α水平较空白对照组均显著升高,表明感染MP可引起TNF-α的变化,高浓度TNF-α引起局部炎症反应,可促进多种因子作用引起支气管和肺组织炎症反应。解毒清肺合剂治疗后,MP感染大鼠TNF-α水平显著降低,与空白对照组无差异,表明解毒清肺合剂可以抑制TNF-α的表达,进而减弱炎症反应。HE染色显示模型组大鼠比对照组淋巴细胞浸润严重,解毒清肺组治疗后淋巴细胞浸润减少,表明解毒清肺合剂能显著减轻肺组织炎症。
p38是丝裂原激活蛋白激酶家族成员,主要参与细胞凋亡与分化,细胞炎症和氧化应激等过程[16]。p38是MAPK信号通路的关键因子,p38 MAPK被激活后影响转录因子的活性,从而调控炎症反应[17]。研究报道p38 MAPK信号通路可以促进I-κBα的磷酸化和降解,进而激活NF-κB通路。本研究结果显示,MP感染后大鼠肺组织p38 MAPK蛋白表达升高,解毒清肺合剂灌胃治疗p38 MAPK显著降低,与空白对照组无显著差异。NF-κB是调控免疫反应与炎症通路的重要核转录因子,机体正常状态下,NF-κB在包浆中与I-κBα结合处于无活性状态[18]。机体受到致病因素刺激时,I-κBα被磷酸化降解,进而从NF-κB异源二聚体上脱离,暴露出p50蛋白的核定位信号,NF-κB被激活[19]。活化的NF-κB转移到细胞核内与目的基因κB序列结合,诱导炎症因子的表达,是MP引起的炎症反应的重要转录因子。机体受到刺激后炎症因子TNF-α表达升高,引起白介素分泌的改变,进而参与激活NF-κB信号通路。有研究报道,NF-κB 是 p38 MAPK的下游信号分子,其可以将信号从细胞质转至胞核,调控相应基因的表达,是信号通路末端重要的转录因子。本研究结果显示MP感染后,模型组NF-κB表达水平显著升高,I-κBα水平显著降低,表明感染MP可激活NF-κB通路,引起炎症反应。解毒清肺组NF-κB较模型组表达水平显著降低,I-κBα水平显著升高,2者与阳性对照组均无显著差异,表明经解毒清肺合剂治疗后,解毒清肺组炎症反应减弱。
综上所述,解毒清肺合剂能够通过调控NF-κB和p38 MAPK显著抑制肺炎支原体引起的肺炎。本研究尚存在不足之处,对其具体分子作用机制尚未研究清楚。

