梓醇促大鼠骨髓间充质干细胞骨向分化的机制研究*
傅淑平,杨 丽,龚 理,李潇潇,袁 璟,王军蒙,张荣华△
(1南京中医药大学针药结合教育部重点实验室,江苏 南京 210023;2暨南大学药学院中药教研室, 广东 广州 510632;3新疆医科大学附属中医医院,新疆 乌鲁木齐 830000)
梓醇(catalpol) 是中国药典指定的地黄定性指标,属于环烯醚萜类化合物[1]。有研究显示地黄提取物能改善骨质疏松症中的骨代谢情况,提高成骨细胞的增殖及碱性磷酸酶(alkaline phosphatase,ALP) 活性,抑制破骨细胞的生成及溶骨活性[2]。本课题组前期研究也发现不同浓度梓醇有促进骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)增殖及向成骨细胞方向分化的作用,且在促BMSCs增殖过程中,可同时激活经典及非经典 Wnt 信号通路[3-4],但其促BMSCs骨向分化的作用机制并不明确。本实验在前期实验结果的基础上,结合大量研究所提示的Wnt信号通路是BMSCs骨向分化过程中的重要通路[5-6]这一线索,探讨梓醇促大鼠骨髓间充质干细胞骨向分化的可能作用机制。
材 料 和 方 法
1 材料与仪器
1.1实验动物 SPF级3月龄SD雌性大鼠,体重(200±5.0)g,由上海西普尔-必凯实验动物有限公司提供。合格证号:SCXK(沪)2013-0016。
1.2实验药物 梓醇标准品购于北京世纪奥科生物技术有限公司,用天平称取梓醇1 mg,溶解于10 mL DMEM完全培养基中,0.22 μm滤器过滤分装,配制成为100 mg/L的母液,在以后的实验中根据需要稀释。-20℃保存备用。
1.3主要试剂 低糖DMEM培养基(Gibco);优级胎牛血清(天津灏洋生物科技有限公司);胰酶(Amresco);地塞米松、β-糖蛋白(β-glycoprotein,β-GP)、维生素C、EDTA、DMSO 及茜素红(Sigma);ALP检测试剂盒 (南京建成生物工程研究所); TRIzol(Invitrogen);RT-PCR试剂盒(TaKaRa)。
1.4主要仪器 CO2培养箱 (ThermoForma);超净工作台(苏州净化设备有限公司) ;普通光学显微镜、倒置相差显微镜(Leica);Model 680型酶标仪(Bio-Rad);Chromo 4 荧光定量PCR仪(MJ Research)。
2 实验方法
2.1梓醇促BMSCs骨向分化过程中对ALP活性的影响
2.1.1实验分组 将细胞分为对照(control)组、成骨诱导(osteoinduction)组和梓醇组,对照组加入DMEM完全培养液,成骨诱导组加入经典骨向分化诱导液(含10%胎牛血清、10-8mol/L 地塞米松、50 mg/L VitC和10 mmol/L β-GP的DMEM 培养液),梓醇组加2.0 mg/L梓醇培养液进行培养。
2.1.2细胞上清液中ALP活性的检测 取生长良好的3代或4代细胞,以1×108/L接种于24孔板中,待细胞汇合达80%~90%后,根据实验分组分别加入相应培养液进行培养,每3 d全量换液1次,于培养的第7、14和21天分别收集各实验组上清液,根据试剂盒操作说明进行ALP活性检测,每组各设6个复孔。以ALP活性为纵轴,天数为横轴,绘制ALP活性的变化曲线,ALP活性用金氏单位表示,即100 mL血清在37 ℃与基质作用15 min产生1 mg酚为1个金氏单位。计算公式如下:
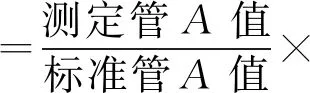
2.1.3ALP染色阳性率的检测 按2.1.2所述方法培养细胞,14 d后消化各孔细胞,1 200 r/mim离心5 min,去上清,加入1 mL普通培养液重悬细胞,接种于预先置有无菌盖玻片的6孔板中,充分贴壁6 h,采用改良钙钴法对爬片细胞进行染色,随后于100倍镜下,随机选取不重复的8个视野,进行阳性细胞及总细胞数计数,计算ALP阳性染色率:ALP阳性染色率(%)=(ALP染色阳性细胞数/总细胞数)×100%。
2.2梓醇对BMSCs 矿化能力的影响 按2.1.2所述分组培养细胞,培养至第21天时,弃去培养液,进行茜素红染色,染色后,置50倍镜下观察各组细胞的矿化结节数,评价BMSCs的矿化能力。
2.3梓醇促BMSCs骨向分化过程中对BMSCs成骨基因及Wnt基因表达的影响 按2.1.2所述分组培养细胞,分别在培养后的第7、14和21天用TRIzol提取细胞的总RNA,然后根据real-time PCR试剂盒操作步骤说明,逆转录RNA后进行PCR扩增,检测各实验组细胞中Runx2、骨钙素(osteocalcin)、Wnt3a、Wnt5a、Wnt11及β-连环蛋白(β-catenin)的Ct值,采用2-ΔΔCt(Livak)法计算成骨诱导组、梓醇组中靶基因相对于对照组增加或减少的倍数,评价梓醇对目的基因mRNA表达水平的影响。引物序列详见表1。
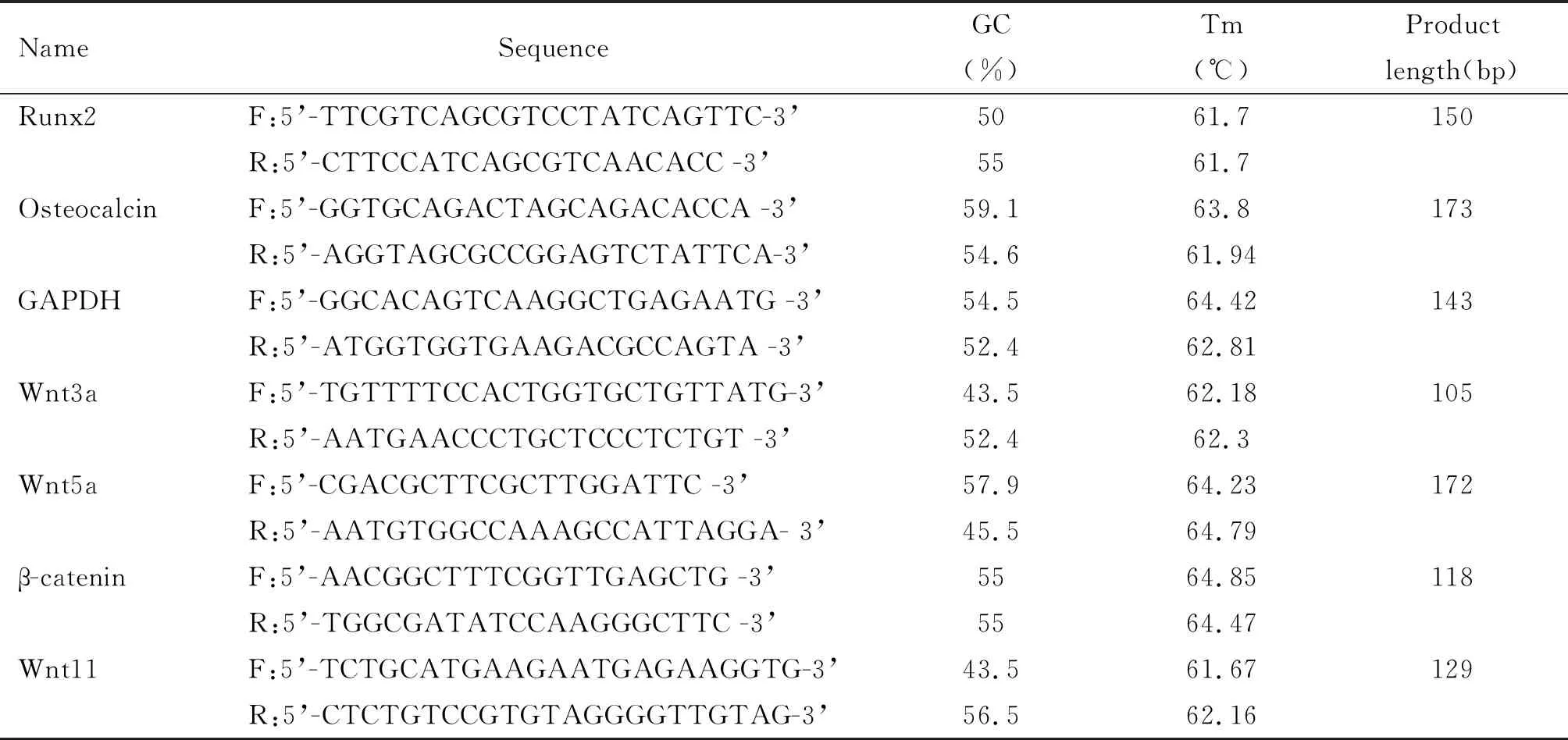
表1 Real-time PCR引物信息表
R:forward; R:reverse.
3 统计学处理
采用SPSS 18.0软件进行数据统计分析。计量资料以均数±标准差(mean±SD)表示,各时点的组间数据比较采用单因素方差分析,若方差齐,则选用Bonferroni法进行组间比较;若方差不齐,则选用Tamhane法进行组间比较,以P<0.05为差异有统计学意义。
结 果
1 梓醇对细胞上清液中ALP活性及ALP染色阳性率的影响
采用单因素方差分析比较各实验组不同诱导时点ALP的活性,结果显示:第7天时,成骨诱导组和梓醇组ALP活性均高于对照组(P<0.05),且梓醇组低于成骨诱导组(P<0.05)。第14天时,成骨诱导组与对照组比较无统计学意义,且此2组ALP活性均低于梓醇组 (P<0.05)。第21天时,梓醇组及成骨诱导组均高于对照组(P<0.05),但前两者之间比较,其ALP活性无差异,见表2。ALP染色阳性率统计结果显示,第14天时,梓醇组及成骨诱导组的ALP染色阳性率均大于对照组(P<0.05),梓醇组与成骨诱导组无差别,见图1。
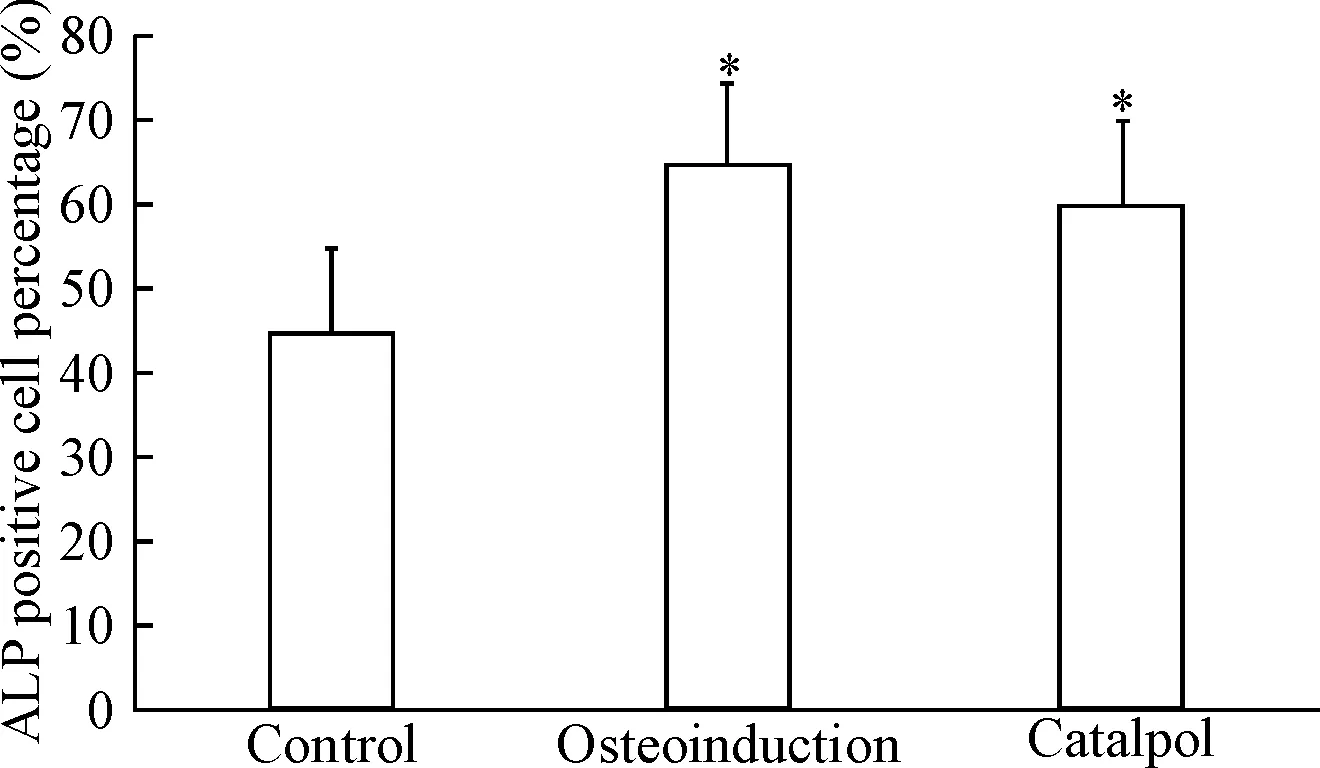
Figure 1.The effect of catalpol on ALP positive cell percentage of BMSCs. Mean±SD.n=8*P<0.05vscontrol group.
图1 梓醇对BMSCs中ALP染色阳性率的影响
表2 梓醇对ALP活性的影响
Table 2.The effect of catalpol on ALP activity (Mean±SD.n=6)

GroupTime (d)7 14 21 Control4.110±0.2377.110±0. 7376.680±0.483Osteoinduction7.470±0.132*8.090±0.6718.280±0.541*Catalpol6.130±0.415*#8.970±0.369*#8.860±0.251*
*P<0.05vscontrol group;#P<0.05vsosteoinduction group.
2 梓醇对BMSCs矿化能力的影响
干预21 d后,各实验组均有矿化结节形成,茜素红染色法对其进行染色计数后,采用单因素方差分析比较各实验组中BMSCs矿化结节数,结果显示,梓醇组及成骨诱导组的矿化结节数均大于对照组(P<0.05),且梓醇组与成骨诱导组无显著差别,见图2。
3 梓醇促BMSCs骨向分化中对Runx2和osteocalcin表达的影响
Real-time PCR结果显示:第7天时,成骨诱导组Runx2 mRNA表达量显著高于对照组与梓醇组 (P<0.05),而后两组之间无统计学意义;第14天时,梓醇组Runx2 mRNA相对表达量高于对照组,但小于成骨诱导组(P<0.05);第21天时,对照组、梓醇组及成骨诱导组之间比较均无统计学意义;各组间osteocalcin mRNA相对表达量的比较结果显示:在第7、14及21天3个时点,梓醇组、成骨诱导组均高于对照组,且梓醇组各时点均低于成骨诱导组 (P<0.05) ,见图3。
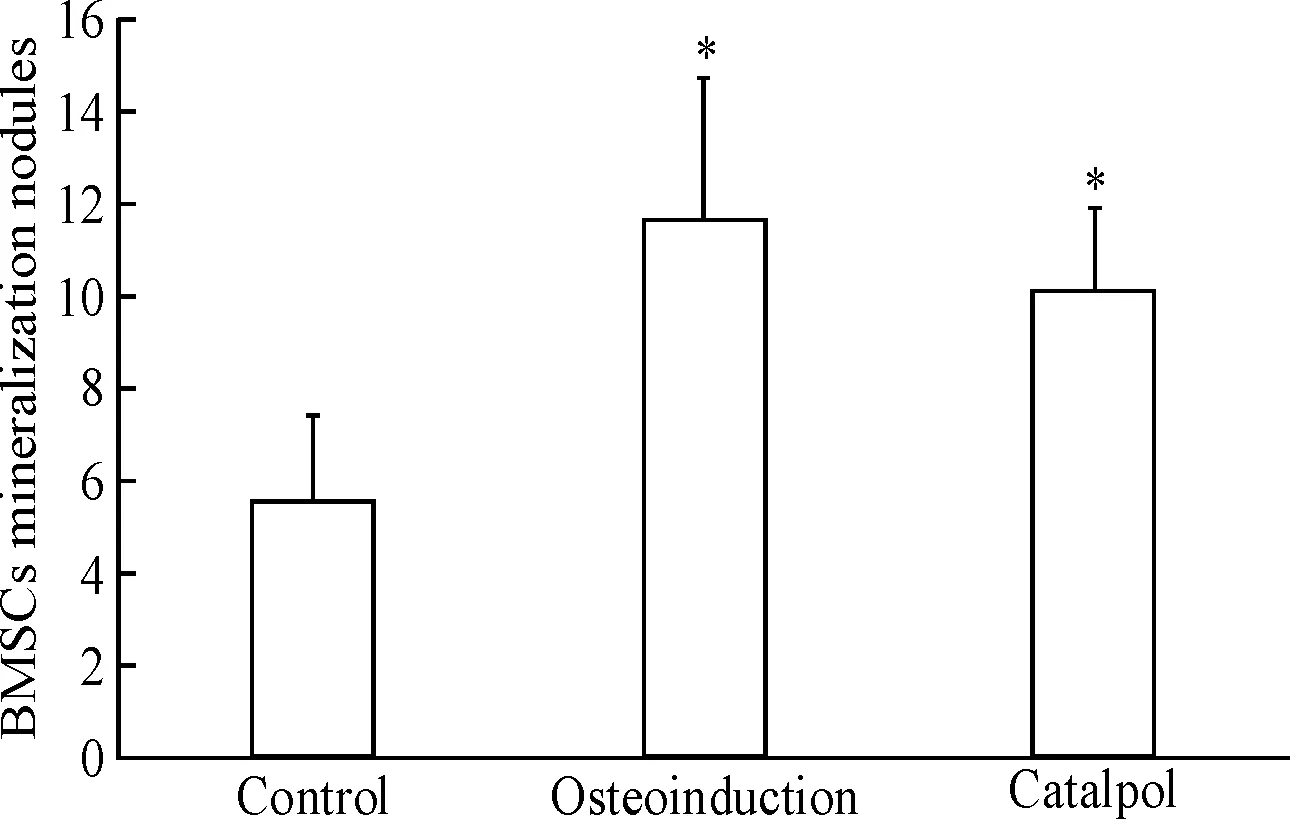
Figure 2.The effect of catalpol on mineralization in BMSCs. Mean±SD.n=8*P<0.05vscontrol group.
图2 梓醇对BMSCs矿化能力的影响
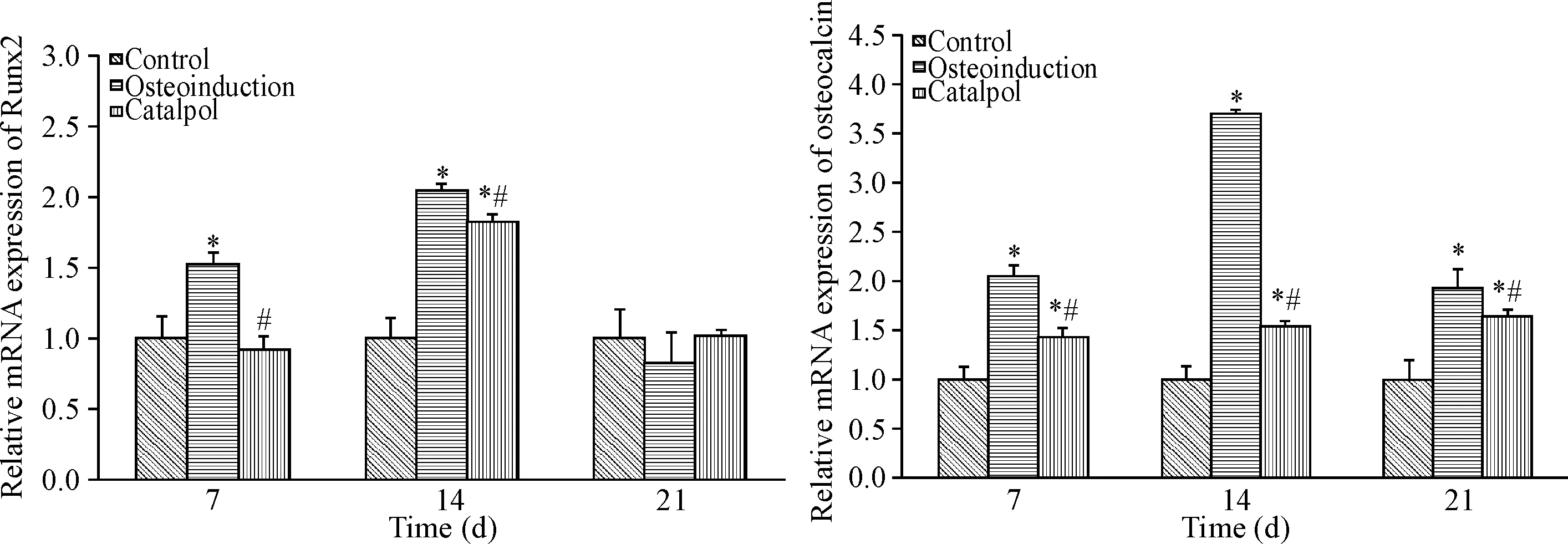
Figure 3.The effect of catalpol on the mRNA expression of Runx2 and osteocalcin in BMSCs. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsosteoinduction group.
图3 梓醇对Runx2及osteocalcinmRNA表达的影响
4 梓醇促BMSCs骨向分化中对β-catenin和Wnt3a mRNA表达的影响
Real-time PCR结果显示:第7天时,各实验组β-catenin mRNA表达量无统计学意义;第14、21天时,成骨诱导组和梓醇组均高于对照组(P<0.05),其中第14天时,梓醇组β-catenin mRNA表达量低于成骨诱导组(P<0.05),第21天时,两组之间的差异无统计学意义。各组间Wnt3a mRNA相对表达量的比较结果显示:第7天时,各实验组Wnt3a mRNA表达量无统计学意义;第14和21天时,成骨诱导组和梓醇组均高于对照组(P<0.05),且梓醇组各时点均低于成骨诱导组(P<0.05),见图4。
5 梓醇促BMSCs骨向分化中对Wnt5a和Wnt11 mRNA表达的影响
Real-time PCR结果显示:第7天时,梓醇组Wnt5a mRNA表达量高于对照组与成骨诱导组(P<0.05),而后两者之间的差异无统计学意义;第14天时,成骨诱导组和梓醇组均高于对照组(P<0.05),且梓醇组Wnt5a mRNA表达量低于成骨诱导组(P<0.05);第21天时,成骨诱导组和梓醇组均高于对照组(P<0.05),但前两组之间的差异无统计学意义。各组间Wnt11相对表达量的比较结果显示:第7天时,各实验组Wnt11 mRNA相对表达量无统计学意义;第14天时,成骨诱导组低于对照组(P<0.05),梓醇组高于对照组和成骨诱导组(P<0.05);第21天时,梓醇组与成骨诱导组均低于对照组(P<0.05),见图5。
讨 论
有研究显示,在胚胎骨发育期的BMSCs凝集阶段,Runx2表达缺失将造成无成骨细胞发生;Runx2基因敲除纯合子小鼠完全缺乏骨组织,不仅无骨基质和成骨细胞,而且也无髓腔形成;在BMSCs向成骨细胞转化的过程中,出现Runx2表达后,才启动细胞分化“开关”,促使BMSCs发育为成骨细胞或成软骨细胞,因此Runx2被认为是BMSCs向成骨细胞系分化的关键调控因子,是骨形成过程中最早和最具特异性的标志[ 7-9]。Osteocalcin,即骨γ-羧基谷氨酸蛋白,是一种仅由成骨细胞和成牙骨质细胞合成的VitK依赖酶修饰的非胶原蛋白,主要沉积在骨组织的细胞外间质,一般在钙化早期开始表达,钙结节成熟后达高峰,是成骨细胞分化成熟和进入矿化期的主要指征之一[10]。
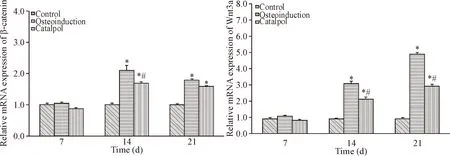
Figure 4.The effect of catalpol on the mRNA expression of β-catenin and Wnt3a in BMSCs. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsosteoinduction group.
图4 梓醇对β-catenin和Wnt3a mRNA表达的影响
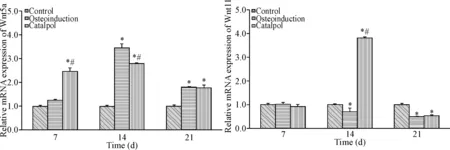
Figure 5.The effect of catalpol on the mRNA expression of Wnt5a and Wnt11 in BMSCs. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsosteoinduction group.
图5 梓醇对Wnt5a和Wnt11 mRNA表达的影响
本课题组在前期研究中,通过检测不同浓度梓醇对BMSCs细胞增殖及骨向分化的影响时,发现梓醇促BMSCs 增殖及骨向分化的最佳浓度分别为1.0 mg /L和2.0 mg /L,且经典与非经典Wnt信号通路的激活参与了梓醇促BMSCs增殖的过程[3-4],但其促BMSCs骨向分化的具体作用机制却并不明确。为探讨梓醇促BMSCs骨向分化的可能机制,本研究在验证梓醇可增加BMSCs ALP活性,促进BMSCs矿化的基础上,观察梓醇对骨向分化关键因子Runx2及osteocalcin表达情况的影响,结果显示:成骨诱导组BMSCs从第7天开始,其Runx2与osteocalcin表达量就明显高于对照组,且均在第14天时达到峰值;随后开始下降,第21天时osteocalcin表达量仍高于对照组,但Runx2与对照组无差异。梓醇促BMSCs 骨向分化过程中,Runx2 mRNA表达水平也是第14天时达到峰值,随后开始下降,第21天时与对照组无统计学差异;osteocalcin mRNA相对表达量在第7天时就高于对照组,随后持续上升直至第21天。梓醇组中Runx2 mRNA表达量在第7和14天时均低于成骨诱导组,第21天时两者无差异;但梓醇组中osteocalcin mRNA表达量在3个时点均低于成骨诱导组。这些结果说明梓醇培养液可通过上调Runx2和osteocalcin表达,促进BMSCs向成骨细胞方向分化,增加细胞钙沉积,促进成骨作用的形成,但其作用强度低于化学诱导剂;体外培养的BMSCs可自动向成骨细胞方向分化,因此培养至一定时间后骨向分化标志因子Runx2的表达不会再因诱导剂的作用而持续增加,此结果与课题组前期研究结果相似[ 11]。
自从最初报道低密度脂蛋白相关蛋白5(low-density lipoprotein receptor-related protein 5,LRP5)变异可引发常染色体退行性病变骨质疏松假性神经胶质瘤综合征,使患者骨量下降、骨折风险增加以及骨骼畸形后[12],越来越多的研究证实Wnt信号的经典与非经典通路在BMSCs骨向分化过程中具有重要的作用。Gong等[13]发现Wnt1、Wnt2和Wnt3a通过与其受体LRP5作用,增加β-catenin在核内的积累,诱发ALP活性增加,参与骨向分化;保守型活化的β-catenin转染亦可提高ALP活性。去除内源性LRP抑制因子Dickkopf 和sclerostin,可增强体内Wnt信号的功能,提高β-catenin累积量,刺激骨的形成[14-15];当小鼠体内缺乏可溶性Wnt蛋白抑制剂分泌型卷曲相关蛋白1时,其成骨细胞及骨细胞的凋亡明显下降,且从这种小鼠骨髓中分离培养的间充质干细胞,其凋亡明显降低的同时,其骨向分化能力、增殖能力却明显得到提高[16-17]。Bennett[18]、 Jackson等[19]则发现LiCl可以阻断糖原合成酶激酶-3β酶活性,刺激BMSCs骨向分化,Wnt3a、Wnt1、Wnt10b、保守型活化的β-catenin均可以活化Wnt/β-catenin通路刺激成骨细胞的形成,而这一通路的抑制因子Dickkopf 蛋白1则可减少成骨细胞的形成,提示内源性Wnt信号通路在成骨细胞的形成及骨形成中具有重要的作用。此外,Gaur等[20]还发现Runx2是Wnt/β-catenin/转录因子1(transcription factor 1, TCF1)信号的一个靶点,经典Wnt信号通路可通过直接活化Runx2基因的表达而增强BMSCs的骨向分化能力。此外,Boland等[21]发现,Wnt11在BMSCs骨向分化时表达上调;而Wnt5a对骨的形成有促进的作用。Boyan等[6]则发现,Wnt11为Wnt5a上游基因,可通过上调Wnt5a的表达,促进MSCs向成骨细胞方向分化,这些都提示我们经典和非经典Wnt信号通路参与调节BMSCs骨向分化过程。本研究通过检测不同干预时点BMSCs中Wnt3a、β-catenin、Wnt5a及Wnt11 mRNA情况,探讨梓醇促BMSCs骨向分化过程中对经典及非经典Wnt信号通路相关因子的影响。结果表明,在经典骨向分化诱导液与梓醇培养液干预下,BMSCs内Wnt3a和β-catenin mRNA表达量在第14和21天时均显著提高,但梓醇组中Wnt3a表达量在这2个时点均低于成骨诱导组,β-catenin表达量在第14天时低于成骨诱导组,第21天时,两者之间无差异。说明梓醇及骨向分化诱导液在诱导BMSCs向成骨细胞方向分化的过程中激活了Wnt经典信号通路。此外,本实验结果还显示:梓醇组中BMSCs内Wnt5a mRNA表达量在第7天时就高于对照组,并在整个培养周期内均处于高表达状态;成骨诱导组在第7天时与对照组无差异,第14天时达到高峰,且高于梓醇组,随后开始下降,至第21天时与梓醇组处于同一水平。就Wnt11相对表达量而言,第7天时,各实验组之间无差异;第14天时梓醇组中Wnt11相对表达量显著上升,高于对照组;而成骨诱导组则显著下降,低于对照组;至21天时,梓醇组Wnt11表达量快速下降,与成骨诱导组持平,且均低于对照组。从这个结果中,我们看到经典骨向分化诱导液在促BMSCs骨向分化过程中并未提高Wnt11的表达;梓醇在第14天时表现出显著提高BMSCs Wnt11表达量的作用,且这一作用持续时间并不长,在第21天时又低于对照组。结合相关文献报到所指出的Wnt11表达的上升可能主要出现在BMSCs骨向分化的早期或中期,在细胞进入矿化后,其表达量下降[21]这一提示,以及本研究中所观测到的成骨诱导组在第7天时,Runx2基因相对表达量就已高于对照组,我们推测经典成骨诱导液促BMSCs向成骨方向分化的诱发时点可能早于第7天,因此错过了其Wnt11相对表达量的高峰期。此外,在第21天时成骨诱导组、梓醇组细胞Wnt11表达量均低于对照组的现象,可能是由于BMSCs在体外自然培养过程中,细胞缓慢地向成骨细胞方向分化,Wnt11表达逐步提升,而成骨诱导组、梓醇组的细胞均已处于矿化期,Wnt11表达量下降所致,由此也提示我们Wnt11表达量的上升应该主要是在BMSCs骨向分化早中期。
综上所述,我们认为梓醇通过上调Runx2和osteocalcin的表达,同时增加ALP的分泌沉积,促进BMSCs向成骨细胞方向分化及新生成骨细胞的成熟,此作用可能与其同时激活经典与非经典Wnt信号通路相关,但其具体作用途径有待进一步研究。

