丹参多酚酸盐对过氧化氢诱导人内皮细胞EA.hy926氧化应激损伤的保护作用及机制*
吕林林,安姿旖,梁家健,刘革修
(暨南大学基础医学院血液研究所,广东 广州 510632)
材 料 和 方 法
1 药物
丹参多酚酸盐注射剂(上海绿谷制药有限公司;规格:每瓶100 mg;批号:Z20050248),4 ℃冰箱保存。
2 主要试剂
人脐静脉血管内皮细胞EA.hy926购自中国医学科学院基础医学研究所细胞资源中心。30%过氧化氢购自广州化学试剂厂;高糖DMEM培养液购自HyClone;CCK-8试剂购自日本同仁公司;胎牛血清(fetal bovine serum,FBS)购自Gibco;0.25%胰酶购自Sigma-Aldrich;ROS试剂盒和线粒体膜电位试剂盒购自BD;VEGF ELISA试剂盒和NO检测试剂盒购自南京建成生物工程研究所;细胞凋亡检测试剂盒和DAPI购自南京凯基生物科技发展有限公司;ECL化学发光试剂盒购自Thermo;兔抗人caspase-3单抗、兔抗人cleaved caspase-3单抗、兔抗人Bax单抗、鼠抗人Bcl-2单抗、鼠抗人NF-κB单抗、鼠抗人p53单抗和鼠抗人GAPDH单抗均购自CST。
3 主要方法
3.1EA.hy926细胞培养及其 H2O2损伤模型的建立 复苏EA.hy926细胞,加入含10%FBS和1%双抗的高糖DMEM培养液,置于37 °C、5 % CO2、饱和湿度的培养箱中培养。待细胞生长至90%融合时,用PBS洗2遍,加入0.25%胰酶消化3 min 左右,再加入新鲜的培养液中和胰酶。将细胞悬液移入离心管,200×g离心5 min收集细胞,用新鲜培养液重悬细胞,并调整细胞浓度为 5×107/L,每孔100 μL细胞悬液接种于96孔板中,并置于培养箱中孵育24 h。戴青里等[3]研究表明,当H2O2浓度大于100 μmol/L时,细胞大量死亡。故细胞培养24 h,添加终浓度分别为0、15、25、50和100 μmol/L的 H2O2培养24 h以摸索构建血管内皮细胞氧化损伤的条件。每组设4个复孔,重复3次;根据细胞活性选择合适的过氧化氢浓度。
3.2实验分组和CCK-8法检测细胞存活率 实验分为对照(control)组、损伤(25 μmol/L H2O2,da-mage)组和抗损伤(丹参多酚酸盐+25 μmol/L H2O2,anti-damage)组,其中抗损伤组分3个亚组,即丹参多酚酸盐的质量浓度分别为50、100、200 mg/L[4]。调整EA.hy926细胞密度为 5×107/L,每孔100 μL细胞悬液接种于96孔板内,并置于5% CO2、37 ℃的细胞培养箱中培养24 h。然后加入丹参多酚酸盐溶液,使其终浓度分别为50、100和200 mg/L;预处理1 h后加入H2O2,继续置于培养箱中培养24 h。然后更换不含血清的新鲜的培养液,并每孔加入CCK-8溶液10 μL ,置于培养箱中避光孵育2~4 h,当颜色逐渐变深时,用酶标仪检测450 nm(参比波长为630 nm)处的吸光度(A),计算细胞存活率。细胞存活率(%)=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值) ×100%。
3.3Transwell小室检测细胞迁移能力和DAPI染色观察细胞凋亡形态 取对数生长期的细胞,按每孔5×105细胞接种于上室,使其终体积含200 μL无血清培养液,下室加入500 μL含10% FBS的培养液。同时加入丹参多酚酸盐(终浓度为100 mg/L)和过氧化氢(终浓度为25 μmol/L )加入Transwell 小室的下室,置于培养箱中培养48 h后,将小室取出,用棉签将未迁移的细胞小心擦去,甲醇固定10 min,经DAPI染色后,荧光显微镜下随机计数3个高倍镜视野中细胞,随后用图像处理软件ImageJ统计细胞迁移的数量,重复3次。
3.4一氧化氮试剂盒检测细胞上清中NO含量 取对数生长期的内皮细胞制成细胞悬液,按每孔2×105个接种至6孔板中,培养24 h后,抗损伤组加入丹参多酚酸盐(终浓度为100 mg/L),对照组加入等体积溶剂,预处理1 h后,损伤组加入过氧化氢(终浓度为25 μmol/L),培养24 h后收集细胞上清液,使用一氧化氮试剂盒检测各组细胞培养液上清中NO含量。
3.5ELISA法检测细胞上清中VEGF含量 取对数生长期的内皮细胞制成细胞悬液,按每孔2×105个接种至6孔板中,培养24 h后,抗损伤组加入丹参多酚酸盐,对照组加入等体积溶剂,预处理1 h后,损伤组加入过氧化氢,培养24 h后收集细胞上清液,按照VEGF试剂盒操作方法检测各组细胞培养液上清中VEGF含量。
3.6流式细胞术检测细胞内超氧化物阴离子含量 取对数生长期的内皮细胞制成细胞悬液,按每孔2×105个接种至6孔板中,培养24 h后,抗损伤组加入丹参多酚酸盐,对照组加入等体积溶剂,预处理1 h后,损伤组加入过氧化氢,置于培养箱中培养48 h后,胰酶消化,离心收集细胞,用PBS洗3遍;加入二氢乙啶(dihydroethidium,DHE;10 μmol/L)至细胞悬液,置于培养箱中避光孵育20 min,离心,弃上清后用PBS重悬细胞,流式细胞术检测样本的荧光强度,用平均荧光强度(mean fluorescence intensity)表示细胞内ROS水平。
这年秋天,我上学的事忽然被提上了议事日程,之前一直都是妈妈在家里教我。说实话,我对上学不可能没有顾虑。开学那天,我径直朝教室走去,不用抬头也知道沿路有一些同学在直勾勾地盯着我看个没完,“注目礼”形成的光束灼灼燃烧着我。
3.7流式细胞术检测线粒体膜电位 取对数生长期的内皮细胞制成细胞悬液,按每孔2×105个接种至6孔板中,培养24 h后,抗损伤组加入丹参多酚酸盐,对照组加入等体积溶剂,预处理1 h后,损伤组加入过氧化氢,置于培养箱中培养48 h后,胰酶消化,离心收集细胞,用PBS洗3遍;将500 μL的罗丹明123(rhodamine 123,Rho123;5 μmol/L)加入至细胞悬液,置于37 ℃培养箱中避光孵育20 min,离心后用PBS重悬细胞,流式细胞术检测样本的荧光强度,用平均荧光强度(mean fluorescence intensity)表示线粒体膜电位水平。
3.8流式细胞术检测细胞凋亡 取对数生长期的内皮细胞制成细胞悬液,按每孔2×105个接种至6孔板中,培养24 h后,加入丹参多酚酸盐使其终浓度为100 mg/L,预处理1 h后,加入过氧化氢,置于细胞培养箱中培养24 h后,用胰酶消化,离心,收集细胞并进行Annexin V-FITC和PI染色,染色方法参照试剂盒,最后于流式细胞仪上检测分析。
3.9Western blot实验 取对数生长期的内皮细胞制成细胞悬液,按每孔2×105个接种至6孔板中,培养24 h后,加入丹参多酚酸盐使其终浓度为100 mg/L,预处理1 h,加入过氧化氢,在细胞培养箱中培养24 h后,胰酶消化,离心,收集细胞。采用RIPA法提取细胞总蛋白,BCA试剂盒定量,100 °C变性5 min后上样,SDS-PAGE分离目标蛋白,上样量为40 μg。转至PVDF膜上,TBST漂洗后,5 %脱脂奶粉封闭液封闭60 min,孵I抗过夜,TBST漂洗3次(每次10 min),加入II抗摇床孵育1 h,TBST漂洗3次(每次10 min),用ECL试剂盒显色,最后显影拍照观察,并用Image J软件对图片进行分析。
4 统计学方法
本研究中数据以均数±标准差(mean±SD)表示。此外,应用GraphPad Prism 7.00进行数据的统计学分析和统计绘图;多组间的比较采用单因素方差分析(one-way ANOVA),两两比较时采用LSD法;以P<0.05为差异有统计学意义。
结 果
1 EA.hy926细胞的过氧化氢氧化损伤模型的建立
CCK-8结果显示,随着过氧化氢浓度的升高,细胞活性呈下降趋势。与对照组(H2O2浓度为0 μmol/L)比较,当过氧化氢浓度小于15 μmol/L时,EA.hy926细胞活性抑制(抑制率为24.41%)不显著;当过氧化氢浓度达到25 μmol/L时,细胞活性受到显著性抑制(抑制率为44.38 %);当浓度升至50 μmol/L~100 μmol/L时,细胞绝大部分都已死亡,见图1A。故在接下来的实验中,选择25 μmol/L 过氧化氢构建氧化损伤模型。
2 丹参多酚酸盐对过氧化氢损伤的EA.hy926细胞活性的影响
CCK-8检测细胞活性结果提示,与对照组细胞活性相比,损伤组细胞活性显著下降(P<0.05);与损伤组比较,随着丹参多酚酸盐浓度的升高,抗损伤组细胞活性显著提高(P<0.05),其中100 mg/L和200 mg/L丹参多酚酸盐抗损伤组细胞活性分别为(92.75±6.13)%和(100.00±2.94)%,且差异有统计学意义(P<0.05),而50 mg/L浓度丹参多酚酸盐抗损伤组细胞活性为(72.75±2.50)%,差异无统计学意义;另外100 mg/L和200 mg/L丹参多酚酸盐抗损伤组之间无显著差异,故选择100 mg/L浓度的丹参多酚酸盐用于后续实验,见图1B。
3 丹参多酚酸盐对过氧化氢诱导的EA.hy926细胞凋亡的影响
经100 mg/L丹参多酚酸盐预处理1 h后,加入过氧化氢处理24 h后,流式细胞术检测细胞凋亡情况如下:与对照组细胞的凋亡率比较,损伤组细胞的凋亡率显著升高(P<0.01);与损伤组细胞的凋亡率比较,抗损伤组细胞的凋亡率显著下降(P<0.05);对照组细胞的凋亡率与抗损伤组细胞的凋亡率比较差异无统计学意义,见图2。此外,药物处理后收集细胞,经DAPI染色,细胞形态发生明显改变;对照组与抗损伤组的细胞大部分呈光滑、圆形的核形态,染色均匀,蓝色荧光较弱;损伤组的细胞大部分细胞核呈现固缩状,边缘不清楚,蓝色荧光加强,见图3A。
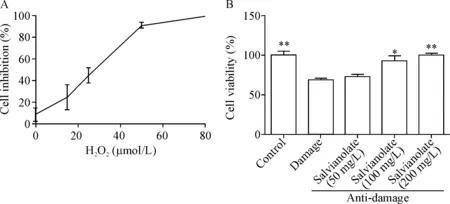
Figure 1.Effects of different concentrations of hydrogen peroxide (H2O2) and salvianolate on EA.hy926 cell activity. A: the inhibitory effect of different concentrations of hydrogen peroxide on the viability of EA.hy926 cells; B: effect of salvianolate on the viability of EA.hy926 cells induced by hydrogen peroxide. Mean±SD.n=3.*P<0.05,**P< 0.01vsdamage group.
图1 不同浓度的过氧化氢和丹参多酚酸盐对EA.hy926细胞活性的影响
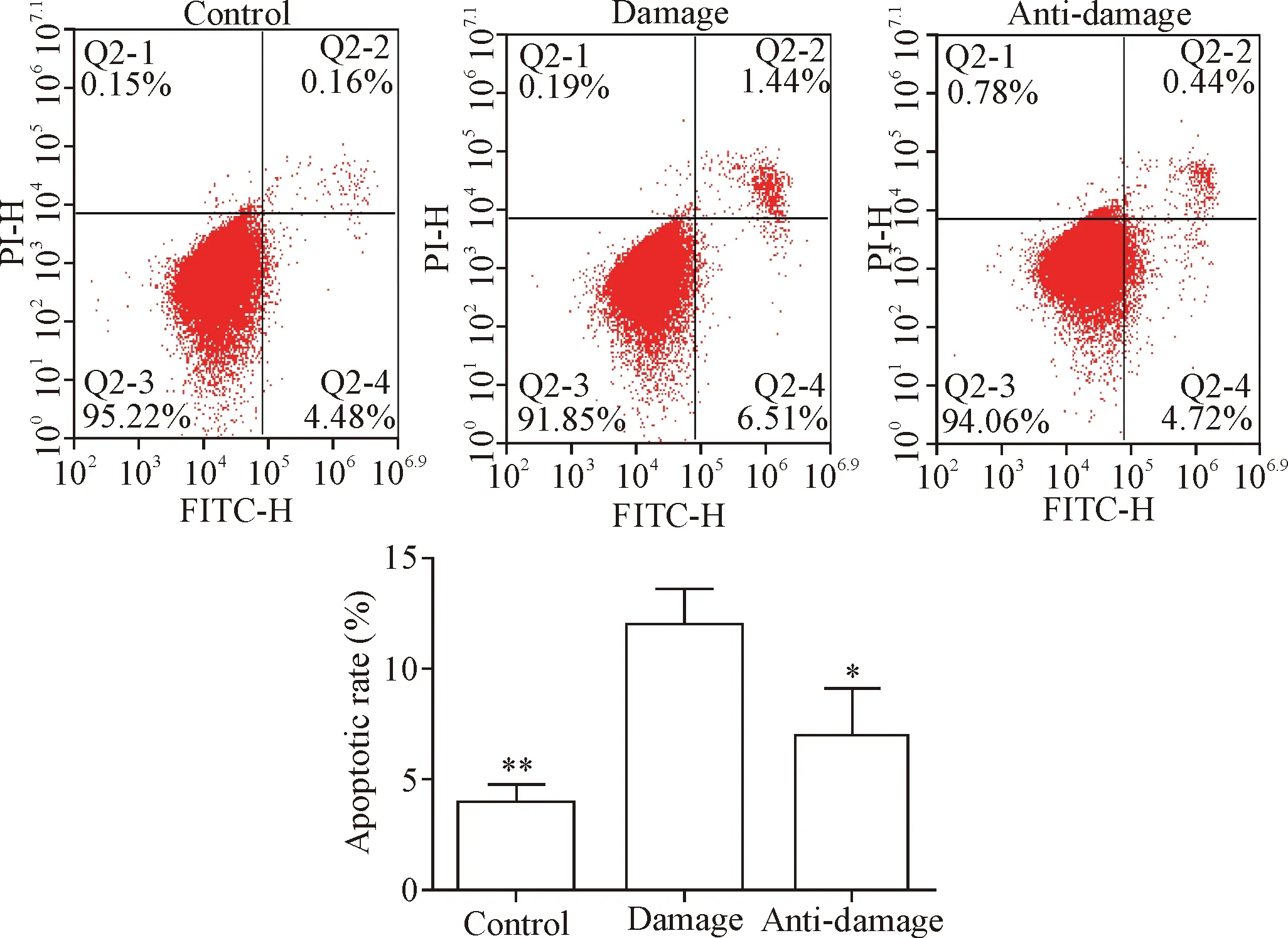
Figure 2. The effect of salvianolate on the apoptosis of EA.hy926 cells induced by hydrogen peroxide. Mean±SD.n=3.*P<0.05,**P<0.01vsdamage group.
图2 丹参多酚酸盐诱导过氧化氢对EA.hy926细胞凋亡的影响
4 丹参多酚酸盐对过氧化氢诱导的EA.hy926细胞迁移的影响
采用Transwell迁移实验检测EA.hy926细胞迁移的能力,以迁移至小室下室面的细胞数量来表示迁移能力,数量越多表明迁移能力越强,数量越少表明迁移能力越弱;处理后的细胞经DAPI染色后,可根据平均荧光强度间接反映细胞数量的多少。Transwell迁移实验结果显示,与对照组细胞比较,损伤组细胞的平均荧光强度显著下降(P<0.05);抗损伤组细胞的平均荧光强度无显著变化;损伤组细胞的平均荧光强度较抗损伤组细胞的平均荧光强度显著降低(P<0.05),见图3B。

Figure 3.The effects of salvianolate on the nuclear morphological change (A) and the migration ability (B) of EA.hy926 cells induced by hydrogen peroxide (DAPI staining, scale bar=100 μm). Mean±SD.n=3.*P<0.05vsdamage group.
图3 丹参多酚酸盐诱导过氧化氢对EA.hy926细胞核形态和迁移的影响
5 丹参多酚酸盐对过氧化氢损伤的EA.hy926细胞线粒体膜跨电位的影响
流式细胞术检测结果示,与对照组比较,过氧化氢损伤组细胞的平均荧光强度显著升高(P<0.01),表明过氧化氢可导致线粒体膜电位下降;与损伤组比较,丹参多酚酸盐抗损伤组细胞的平均荧光强度显著下降(P<0.01),见图4。

Figure 4.Effect of salvianolate on the mitochondrial membrane potential of EA.hy926 cells. Mean±SD.n=3.**P<0.01vscontrol group.
图4 丹参多酚酸盐对EA.hy926细胞线粒体跨膜电位水平的影响
6 丹参多酚酸盐对过氧化氢诱导EA.hy926细胞内ROS水平的影响
流式细胞术检测结果示,与对照组比较,过氧化氢损伤组细胞的平均荧光强度显著升高(P<0.01),表明过氧化氢可诱导胞内ROS升高;与过氧化氢损伤组比较,丹参多酚酸盐抗损伤组细胞的平均荧光强度显著下降(P<0.01);表明丹参多酚酸盐减少过氧化氢诱导胞内ROS的生成,见图5。
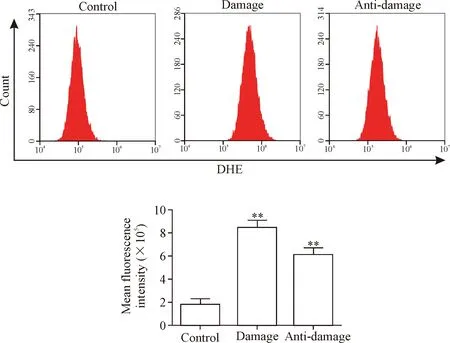
Figure 5.Effect of salvianolate on ROS formation induced by hydrogen peroxide. Mean±SD.n=3.**P<0.01vscontrol group.
图5 丹参多酚酸盐对过氧化氢诱导的EA.hy926细胞生成ROS的影响
7 丹参多酚酸盐对过氧化氢诱导EA.hy926细胞NO和VEGF 分泌水平的影响
与对照组比较,过氧化氢损伤组细胞的NO和VEGF分泌水平显著降低(P<0.01);与过氧化氢损伤组比较,丹参多酚酸盐抗损伤组细胞的NO和VEGF分泌水平显著升高(P<0.05),见表1。
表1 丹参多酚酸盐对过氧化氢诱导的EA.hy926细胞培养上清中NO和VEGF相对含量的影响
Table 1.The effects of salvianolate on the contents of NO and VEGF in hydrogen peroxide-induced EA.hy926 cells (Mean±SD.n=3)

GroupNO (μmol/L)VEGF (ng/L)Control98.42±6.47**882.77±66.83*Damage47.02±8.42342.14±82.82Anti-damage72.12±11.06*650.48±46.02*
*P<0.05,**P<0.01vsdamage group.
8 丹参多酚酸盐对EA.hy926细胞Bcl-2、Bax、caspase-3、NF-κB和p53蛋白表达量的影响
Western blot实验结果显示,与对照组相比,过氧化氢损伤组的cleaved caspase-3/caspase-3比值显著增大(P<0.01),NF-κB和p53 蛋白表达水平显著升高(P<0.05),Bcl-2/Bax比值显著减小(P<0.01); 与过氧化氢损伤组比较,抗损伤组的cleaved caspase-3/caspase-3比值显著减小,NF-κB和p53 蛋白表达水平显著下降(P<0.05),Bcl-2/Bax比值显著增大(P<0.05),见图6。
讨 论
血管内皮系统是心血管系统的重要部分,参与各组织器官营养物质供应与废物清理。在一定程度上,内皮细胞损伤与功能失常可导致各种各样的疾病。内皮细胞氧化应激可见于多种疾病的病理生理过程,主要表现为组织体液循环障碍等,其本质是细胞内ROS异常升高[5]导致线粒体跨膜电位下降,影响细胞的代谢和生理功能,并最终引起内皮细胞功能失调或丧失,激活凋亡信号通路,导致细胞损伤和凋亡[6-7]。本研究结果显示,丹参多酚酸盐具有对抗过氧化氢诱导内皮细胞EA.hy926细胞氧化应激损伤的作用,可显著改善H2O2损伤的内皮细胞活力,改善细胞迁移能力,显著增加细胞VEGF[8-10]和NO水平,显著减少细胞凋亡。
该结果与已报道的其相关药理作用具有一致性,如丹参多酚酸盐体内外应用方面显示可对抗高糖[11]、辐射、高血压、心肌梗死、动脉粥样硬化、缺血再灌注和高同型半胱氨酸[12]等引起的氧化应激反应;此外,丹参多酚酸盐通过抑制氧化应激相关途径降低培养的乳鼠心肌细胞凋亡[4, 13-14]。本研究结果表明,丹参多酚酸盐可显著降低ROS水平、稳定H2O2诱导的线粒体膜电位水平,抑制氧化应激相关途径,如显著降低NF-κB、p53、Bax和cleaved caspase-3蛋白水平,显著升高Bcl-2蛋白水平,该部分结果与已报道的H2O2导致的氧化应激信号途径具有相关性和一致性,如在过氧化氢诱导的人皮肤成纤维细胞氧化应激发生中NF-κB被激活并表达增加,同时激活经典的p53的表达[6],抑制细胞增殖,促进细胞凋亡[15-18]。由于bcl-2和bax是p53的下游靶基因,进而导致Bcl-2/Bax比率下降,导致线粒体跨膜电位下降,激活caspase家族,诱导细胞凋亡[7]。这说明丹参多酚酸盐对抗H2O2诱导的内皮细胞损伤与其抑制氧化应激相关途径有关。

Figure 6.The effects of salvianolate on the protein levels in the EA.hy926 cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05vsdamage group.
图6 不同浓度的丹参多酚酸盐对EA.hy926细胞相关蛋白表达的影响
丹参多酚酸盐具有中医学方面的活血、化瘀和通脉等多种作用。这些反映了丹参多酚酸盐药理作用的多样性与复杂性,其关于内皮功能方面的作用是本实验研究的观察点,即丹参多酚酸盐对内皮细胞氧化应激损伤的抑制作用。本研究通过体外细胞培养实验观察到的作用只是丹参多酚酸盐对过氧化氢诱导的内皮细胞氧化应激损伤具有抑制作用,因素相对单一。而丹参多酚酸盐在体内效应则极其复杂,还有待进一步探究。
总之,本研究证实,丹参多酚酸盐对过氧化氢诱导的内皮细胞氧化应激损伤具有保护作用,其机制是通过降低ROS水平,抑制NF-κB和p53蛋白表达水平,提高Bcl-2/Bax比值和稳定细胞线粒体膜电位,改善与恢复细胞功能活性。本研究可为临床上心脑血管疾病抗氧化损伤的治疗提供一定的参考资料。

