BDNF在APP/PS1转基因小鼠皮层和海马内的表达及其对学习记忆能力的影响*
郝继伟,李莺歌,王 来,耿慧霞△
(河南大学1护理与健康学院,2生命科学学院,河南 开封 475001)
阿尔茨海默病(Alzheimer disease,AD)是一种中枢神经慢性退行性疾病,其典型的神经病理学变化为大脑内出现β-淀粉样蛋白(amyloid β-protein,Aβ)沉淀形成老年斑和神经原纤维缠结(neurofibrillary tangles,NFTs),从而致使神经元大量凋亡,导致患者记忆能力的降低和认知、情感的障碍[1]。APP/PS1双转基因小鼠大脑神经元内转入突变的淀粉样前体蛋白(APPswe)和早老素(ΔE9)基因,从而使该小鼠的大脑内在3月龄时即可检测出Aβ斑,因此,常作为研究AD的一种动物模型[2]。
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)属于神经营养因子家族成员之一,广泛表达在皮层、海马、杏仁核和小脑等脑区,参与神经元的发育、生长、轴突出芽和树突棘形成等神经元的成熟过程,影响着神经元与神经元之间突触的可塑性和学习记忆能力的形成等高级神经生物学过程[3]。AD患者的临床检测显示大脑内BDNF的表达减少,然而对多种AD动物模型的研究表明,脑内BDNF表达水平的变化出现差异,如APPswe和APPswe/PS1-P264L模型小鼠的BDNF在mRNA水平降低,而APPswe/PS1-M146V 模型小鼠没有发生该类改变;APPswe/PS1/tau模型小鼠脑内BDNF在蛋白质水平表达降低,而另外的研究显示该蛋白的表达水平升高[4]。为进一步明确AD动物模型APP/PS1双转基因小鼠脑内BDNF的表达变化以及对学习记忆能力的影响,本研究以APP/PS1双转基因小鼠作为研究对象,利用刚果红染色、TUNEL试剂盒、免疫荧光、Western blot技术和Morris水迷宫方法分别检测大脑皮层和海马区淀粉样蛋白Aβ斑的沉积,神经元细胞凋亡,BDNF的表达以及空间学习记忆能力,从而深入探究BDNF在野生型小鼠和APP/PS1双转基因小鼠大脑皮层和海马内的表达变化以及对学习记忆能力的影响。
材 料 和 方 法
1 实验动物
C57BL/6小鼠和APP/PS1双转基因小鼠购于南京大学模式动物研究所[许可证号:SCXK(苏)2001-0001],并在本实验室饲养繁育。APP/PS1双转基因雄鼠与野生型雌鼠合笼繁殖,幼鼠2周后,做基因型鉴定,选取6月龄和12月龄的雌雄APP/PS1转基因鼠和野生型小鼠作为研究对象。在保证供水、饲料充足的前提下,按自然昼夜节律,室温22~25 ℃、相对湿度60%~80%的环境下饲养。
2 主要试剂
TUNEL细胞凋亡检测试剂盒购自Promega;DAPI试剂和刚果红染色试剂盒购自索莱宝公司;兔抗BDNF多克隆抗体(ab108319)和鼠抗β-actin多克隆抗体(ab8226)购自Abcam;2×PCR Mix和RIPA裂解液购自康为世纪生物有限公司;增强型ECL发光试剂盒购自Millipore;Alexa Fluor 488标记的荧光 II 抗和BCA蛋白定量试剂盒购自Thermo Fisher;HRP标记的 II 抗购自北京中杉金桥生物科技有限公司;其它试剂均为国产分析纯。
3 实验方法
3.1石蜡切片 选取适宜月龄的APP/PS1双转基因和C57BL/6野生型小鼠,10%水合氯醛腹腔麻醉,预冷PBS经心脏灌流,直至灌流液清亮为止,随后用4%的多聚甲醛缓缓进行灌注固定。将固定后的小鼠用剪刀从颈部剪开取出完整大脑,并置于4%多聚甲醛中室温浸泡固定24 h,然后用PBS漂洗3次。对固定后的大脑组织块进行修剪处理,弃小脑,分离左右半球。随后进行脱水处理,依次在浓度为50%的乙醇浸泡2 h、70%的乙醇浸泡过夜、80%的乙醇浸泡1 h、90%的乙醇浸泡1 h、95%的乙醇Ⅰ浸泡1 h、95%的乙醇Ⅱ浸泡1 h、无水乙醇Ⅰ浸泡1 h、无水乙醇Ⅱ浸泡1 h、二甲苯Ⅰ浸泡1 h、二甲苯Ⅱ浸泡1 h,放入冬青油中过夜。提前1~2 h打开生物组织包埋机,脱水后的组织块分别用蜡Ⅰ、蜡Ⅱ和蜡Ⅲ各处理1 h,最后用硬蜡包埋即可得到蜡块。将蜡块置于莱卡轮式切片机(Leica,RM2235)上切为厚度为4 μm的薄片。
3.2Aβ斑标记 将切好的组织切片铺于涂有多聚赖氨酸的载玻片上,60 ℃烘箱烘干1 h,常规脱蜡至水(二甲苯Ⅰ浸泡15 min,二甲苯Ⅱ浸泡15 min、无水乙醇Ⅰ浸泡5 min、无水乙醇Ⅱ浸泡5 min、95%的乙醇Ⅰ浸泡5 min、95%的乙醇Ⅱ浸泡5 min、90%的乙醇浸泡5 min、80%的乙醇浸泡5 min、70%的乙醇浸泡5 min、50%的乙醇浸泡5 min)。入苏木素染色液浸染5~15 min,酸性乙醇分化10~15 s,然后立即入水终止分化,自来水冲洗2 min,再用碱性NaCl溶液浸染切片,然后将切片直接放入碱性刚果红染色液浸染(溶液均为现配现用),无水乙醇冲洗,逐级常规乙醇脱水,二甲苯透明,中性树胶封固。显微镜(Olympus, BX61)观察海马和皮层区域并拍照。
3.3TUNEL检测细胞凋亡 选取小鼠大脑石蜡切片,常规脱蜡至水,根据试剂盒说明书进行实验操作。将载玻片依次浸入0.85% 的NaCl溶液5 min、PBS 5 min、4%的甲醛溶液20 min,PBS洗涤 5 min×3次,蛋白酶 K覆盖孵育7~12 min、PBS 5 min、4%的甲醛溶液5 min、PBS 5 min、100 μL平衡缓冲液覆盖细胞5~10 min(以上过程均在室温下进行)。与此同时提前避光配制rTdT孵育缓冲液(每50 μL 反应体系含有平衡缓冲液45 μL+核苷混合物5 μL+rTdT酶1 μL)。吸去平衡缓冲液,然后在细胞上加上rTdT孵育缓冲液,置于湿盒内,在37 ℃孵育60 min发生加尾反应,避免光照,后将载玻片浸入2×SSC溶液,室温放置15 min以终止反应,后将载玻片浸入新鲜的PBS中洗涤3次,每次5 min。DAPI甘油封片,在荧光显微镜下观察皮层和海马区域并拍照。
3.4免疫荧光 选取石蜡切片,脱蜡至水,0.1 mol/L的 PBS浸洗3次,每次10 min,后将石蜡切片浸入柠檬酸盐缓冲液中微波加热到92~100 ℃ 10 min(注意不能沸腾)以修复抗原,待放置恢复常温后PBS洗3次,每次10 min,擦干切片组织周围水分后用免疫组化笔圈起组织,加稀释过的 I 抗(兔抗BDNF多克隆抗体,稀释比例1∶100),放置于湿盒内,4 ℃冰箱过夜。次日早晨,取出室温放置30 min,PBS洗涤3次,每次10 min。擦干多余液体,注意组织不能干透,避光加稀释过的 II 抗(稀释比例1∶500),室温孵育3 h或38 ℃ 30 min,PBS洗涤3次,每次10 min,DAPI甘油封片,荧光显微镜(Olympus,BX61)观察皮层和海马区域并拍照。
3.5Western blot实验 10%水合氯醛腹腔麻醉实验小鼠,冰上灌流,取脑,剥离皮层和海马,分别置于800 mL和500 mL 的RIPA裂解液中,匀浆器匀浆,4 ℃、12 000×g离心10 min,收集上清冻存-80 ℃备用。BCA法对蛋白定量。30 μg样品经12% SDS-PAGE分离,电流200 mA,湿法转膜2 h,5%脱脂牛奶室温封闭1 h,加入 I 抗,4 ℃过夜。次日早上,用TBST漂洗3次,每次5 min,然后在含有 II 抗的孵育袋内室温孵育2 h,TBST漂洗3次,每次5 min,添加ECL发光液暗室曝片。
3.6Morris水迷宫实验 分2个部分进行。第1部分为定位航行实验,该实验用于训练和检测小鼠的空间学习和记忆能力。每天训练小鼠,选定水迷宫的某一象限将小鼠放入,摄像头记录并计算小鼠从放入点游到平台所需的时间,即为逃避潜伏期;倘若小鼠在60 s时间内没有游行到平台,则引导其到平台并停留10 s。每天如此训练,共持续6 d。第7天开始记录小鼠游到平台所需的时间即为逃避潜伏期。第2部分为空间搜索实验:在第8天时,将水下平台撤除,将小鼠放置在训练时的同一象限,记录60 s内小鼠寻找平台所耗费的时间和进入该平台所位象限的次数,作为空间记忆的检测指标。
4 统计学处理
采用GraphPad Prism 6.0软件对数据进行统计分析。数据结果以均数±标准差(mean±SD)的形式表示。组间均数比较采用单因素方差分析(one-way ANOVA)或独立样品t检验,以P<0.05 为差异有统计学意义。
结 果
1 Aβ斑的形成
刚果红染色标记皮层和海马区Aβ斑变化的结果显示,12月龄的野生型小鼠皮层和海马CA1区都没有见到Aβ斑的出现,而6月龄和12月龄的APP/PS1双转基因小鼠皮层和海马CA1区都出现Aβ斑,且12月龄小鼠Aβ斑的数量多于6月龄小鼠(P<0.05)。对Aβ斑的形态结构和大小分析表明,12月龄小鼠皮层和海马CA1区Aβ斑的形态明显大于6月龄小鼠,见图1、2。这说明随着年岁的增加和发病时间的延长,脑内形成的Aβ斑数量增加,形态变大,因此后续实验就采用12月龄的APP/PS1双转基因小鼠作为研究对象。
2 神经元凋亡
APP/PS1双转基因小鼠和野生型小鼠皮层和海马区神经元细胞凋亡的检测结果显示,12月龄APP/PS1双转基因小鼠TUNEL阳性细胞数量明显多于野生型小鼠(P<0.01),见图3、4。
3 BDNF的表达
分别采用免疫荧光和Western blot的方法检测APP/PS1双转基因小鼠和野生型小鼠皮层和海马区BDNF的表达变化。免疫荧光的结果显示,野生型小鼠BDNF表达阳性的细胞数量多于APP/PS1双转基因小鼠(P<0.01),见图5。Western blot结果显示,野生型小鼠皮层和海马区成熟形式的BDNF表达量明显高于APP/PS1转基因小鼠(P<0.01),见图6。

Figure 1.Aβ plaques were stained with Congo red in the cerebral cortex of WT andAPP/PS1transgenic mice. A: WT mice; B: 6-month-oldAPP/PS1mice; C: 12-month-oldAPP/PS1mice; D: the quantificative analysis of Aβ plaques inAPP/PS1mice. The scale bar=20 μm. Mean±SD.n=3.*P<0.05vs6 months.
图1 刚果红染色标记皮层的Aβ斑
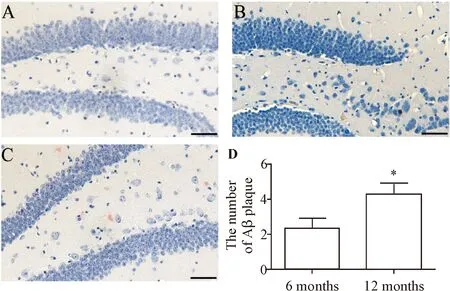
Figure 2.Aβ plaques were stained with Congo red in the hippocampus of WT andAPP/PS1transgenic mice. A: WT mice; B: 6-month-oldAPP/PS1mice; C: 12-month-oldAPP/PS1mice; D: the quantitative analysis of Aβ plaques inAPP/PS1mice. The scale bar=20 μm. Mean±SD.n=3.*P<0.05vs6 months.
图2 刚果红染色标记海马的Aβ斑
4 空间学习记忆能力
Morris水迷宫检测结果显示,APP/PS1双转基因小鼠的逃逸潜伏期长于野生型小鼠,且在空间搜索实验中,APP/PS1双转基因小鼠在60 s内穿越平台所在象限的次数也少于野生型小鼠(P<0.05或P<0.01),见图7A、B。轨迹图的结果表明APP/PS1双转基因小鼠的运行轨迹杂乱无章,而野生型小鼠运行轨迹并不杂乱,围绕平台寻找,规律性比较明显,见图7C。
讨 论
随着老龄化社会的到来,AD严重威胁着中老年人的身心健康。病理检测发现,该病的典型病理学特点为大脑内出现Aβ斑聚集和神经元纤维缠结,并观察到神经元的凋亡和轴突降解,致使患者出现认知功能障碍、记忆能力降低等症状。有研究显示,APP/PS1双转基因小鼠可以作为AD研究的动物模型,最早在3月龄时即可观测到脑内Aβ斑的形成,本研究证实,该鼠在6个月时可观察到皮层和海马区出现Aβ斑,并随病程的增长,12月龄时,Aβ斑的数量和形态都呈进行性增加,说明随着年岁的增加,该小鼠AD的神经病理学变化更加明显,符合临床上年龄越大该病发病率越高、症状越严重的特点。伴随Aβ斑形成,出现的是神经元凋亡的数量发生相应的变化,如12月龄的APP/PS1双转基因小鼠皮层和海马区神经元细胞凋亡的数量与野生型相比急剧增加。对小鼠空间学习记忆能力的检测也表明,12月龄APP/PS1双转基因小鼠的空间学习记忆能力受到严重损伤,如逃逸潜伏期所耗时长远远大于野生型小鼠,在60 s内穿越平台所位象限的次数也少于野生型小鼠,且在Morris水迷宫实验中的游泳轨迹杂乱无章,没有规律可循。这些变化与AD患者出现Aβ斑聚集的病理变化和病程增加出现认知、记忆功能障碍的临床表现相一致,表明该转基因小鼠可以作为研究AD发病机制的一种理想动物模型。
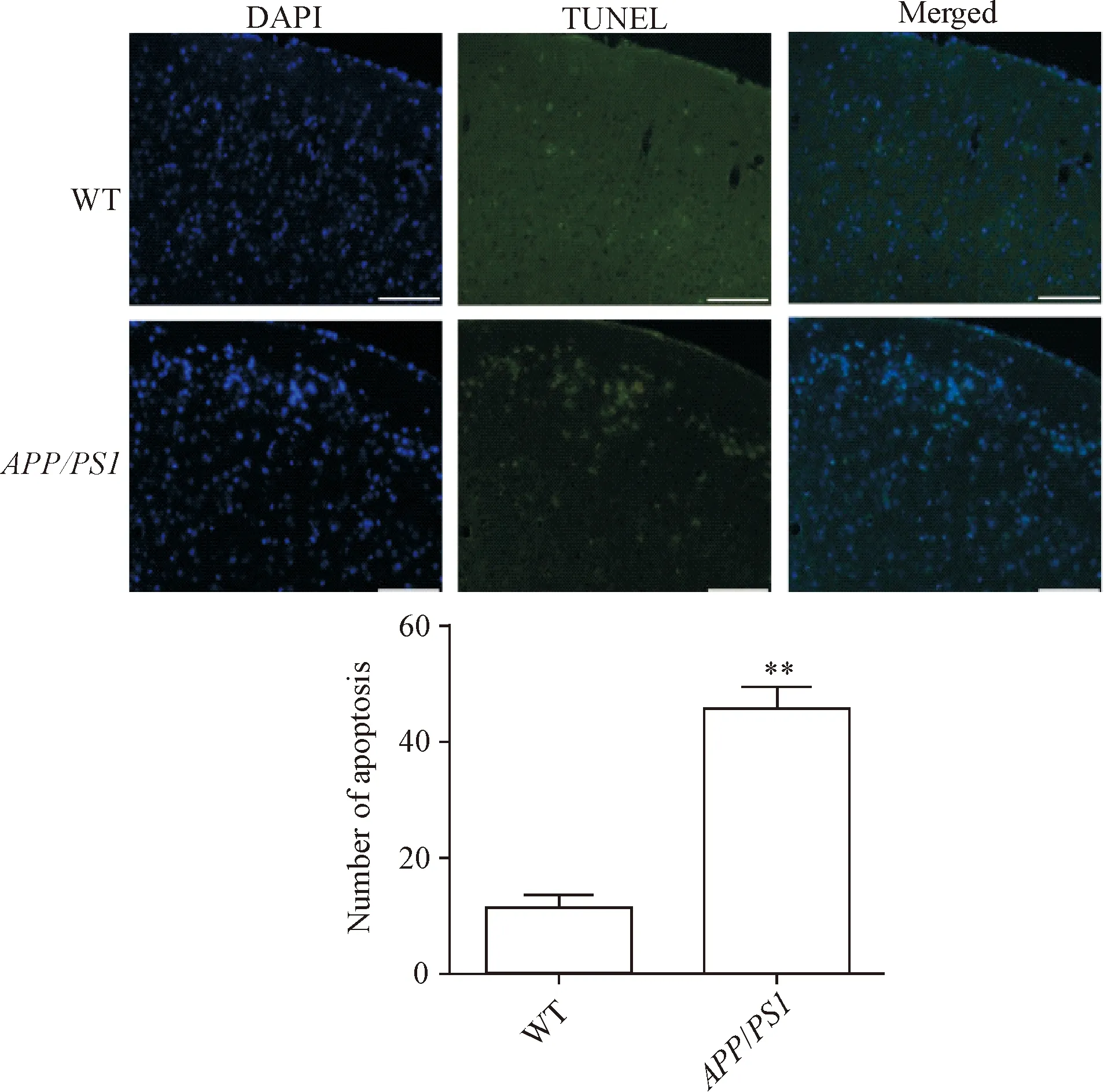
Figure 3.Apoptosis in the cerebral cortex of WT andAPP/PS1transgenic mice was detected by TUNEL assay. The scale bar=50 μm. Mean±SD.n=3.**P<0.01vsWT group.
图3 野生型和APP/PS1转基因小鼠皮层细胞凋亡情况的比较
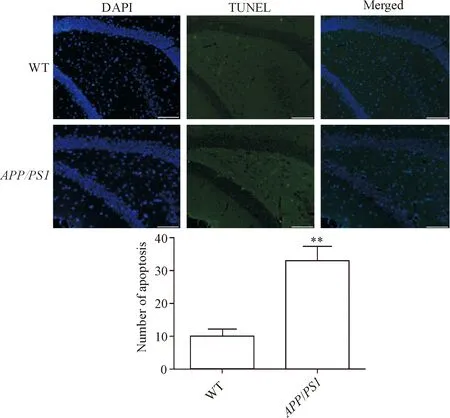
Figure 4.Apoptosis in the hippocampus of WT andAPP/PS1transgenic mice was detected by TUNEL assay. The scale bar=50 μm. Mean±SD.n=3.**P<0.01vsWT group.
图4 野生型和APP/PS1转基因小鼠海马区细胞凋亡情况的比较
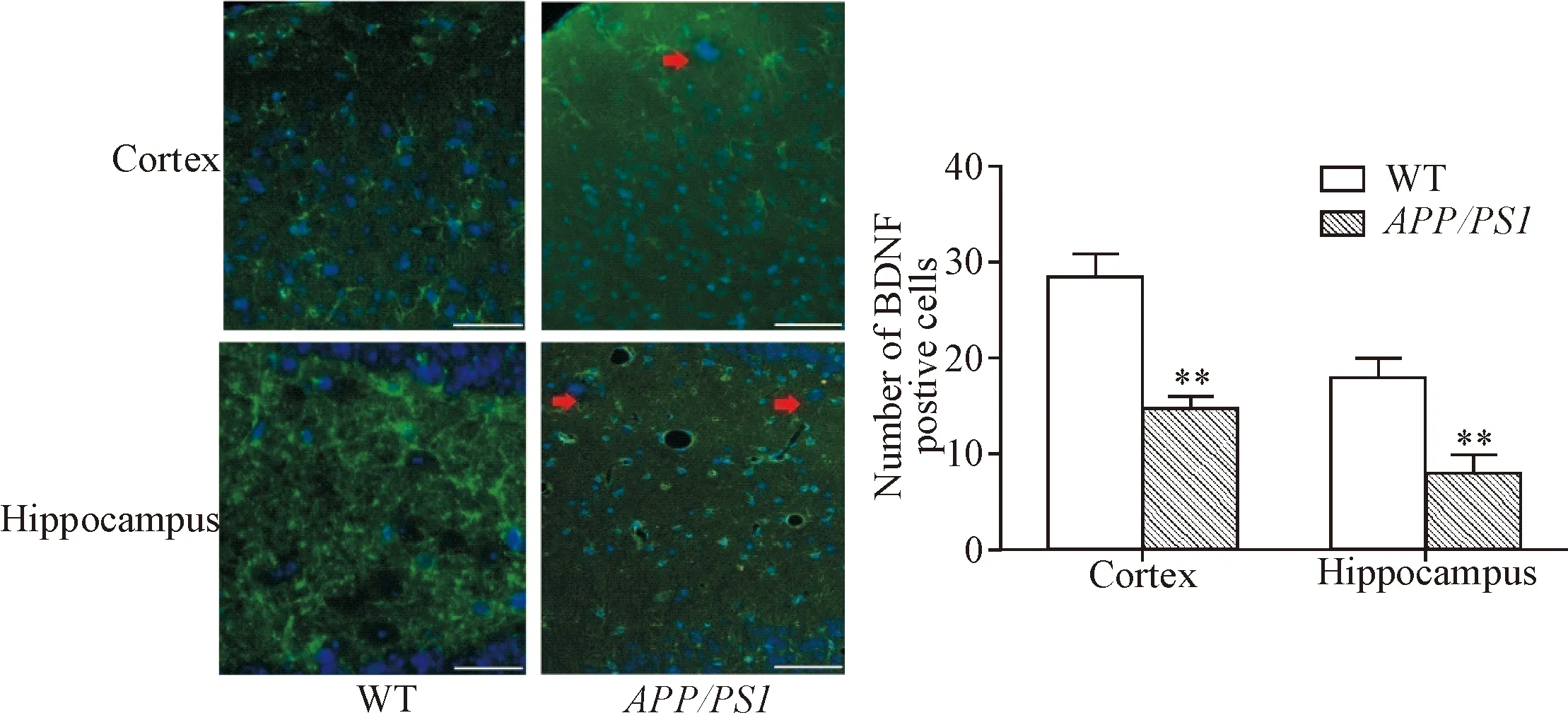
Figure 5.BDNF positive cells were detected by immunofluorescence staining in cerebral cortex and hippocampus of WT andAPP/PS1transgenic mice. The scale bar=20 μm. Mean±SD.n=3.**P<0.01vsWT group.
图5 免疫荧光检测皮层和海马区BDNF表达阳性的细胞数

Figure 6.BDNF expression was detected by Western blot in the cerebral cortex and hippocampus of WT andAPP/PS1transgenic mice. Mean±SD.n=3.**P<0.01vsWT group.
图6 Western blot检测皮层和海马区BDNF的表达
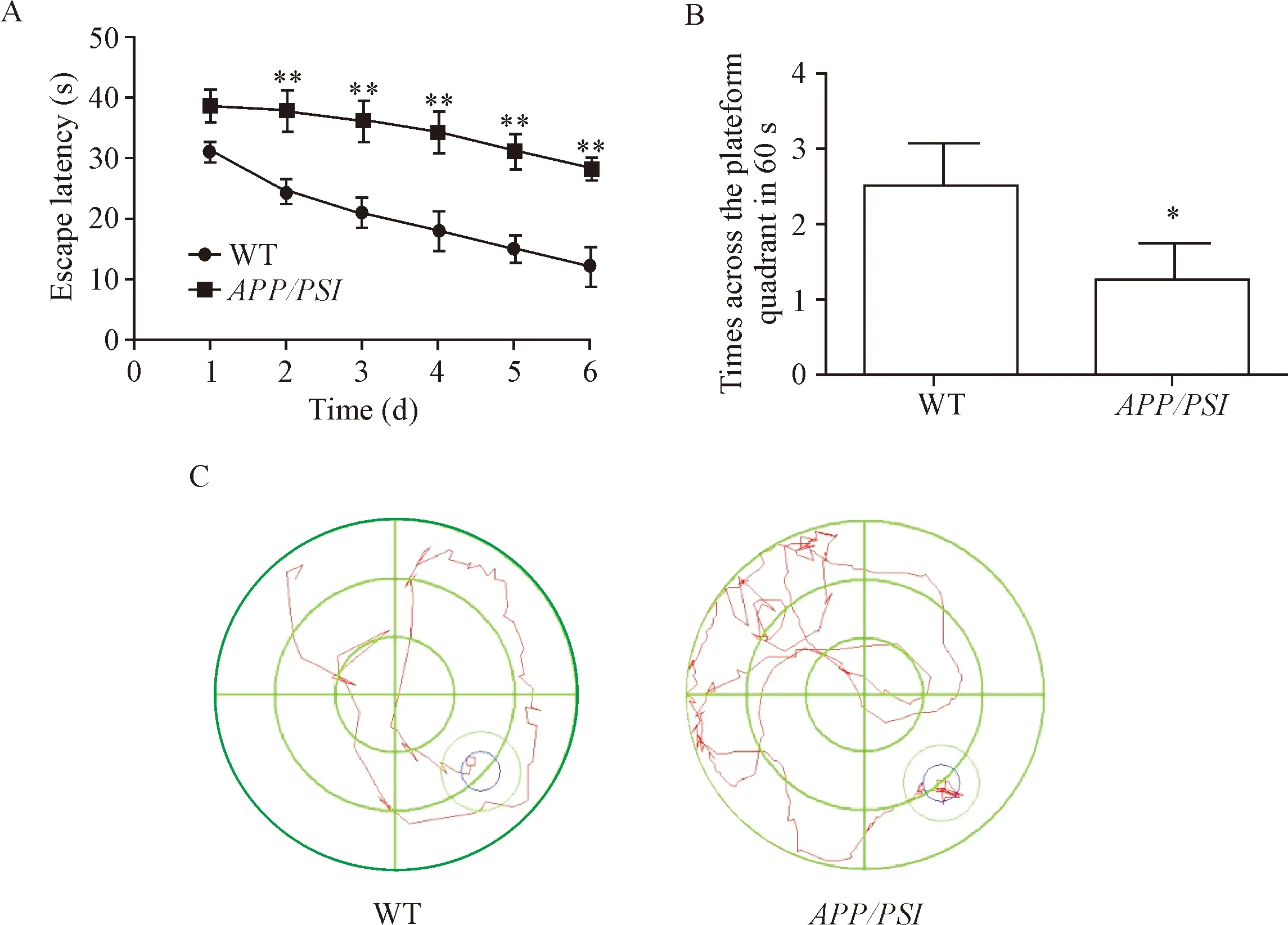
Figure 7.The changes of learning and memory abilities of WT andAPP/PS1transgenic mice. A: the escape latency; B: the times across the platform quadrant in 60 s; C: the swim-tracking path. Mean±SD.n=3.*P<0.05,**P<0.01vsWT group.
图7 野生型与APP/PS1转基因小鼠学习记忆能力的变化
BDNF最早由德国神经化学家Barde从猪的大脑中分离并克隆[5],其基因在人类定位于第11号染色体短臂1 区3 带(11p13),而在鼠类定位于第12号染色体上。BDNF基因编码的多肽链为前体BDNF(proBDNF),相对分子质量约为32 kD,经过胞内的丝氨酸蛋白酶和基质金属蛋白酶切除N端的信号肽等翻译后修饰过程,从而形成相对分子量为13 kD的具有生物学活性的成熟形式BDNF(active BDNF)[6-7]。成熟形式的BDNF与酪氨酸蛋白激酶受体TrkB结合发挥其促进神经元分化、发育、存活、轴突出芽、树突棘形成、突触可塑性以及学习记忆的形成和维持等神经生物学功能[8]。本研究证实,BDNF阳性表达的细胞数量在12月龄的APP/PS1双转基因小鼠皮层和海马区与野生型相比明显减少,并且成熟形式的BDNF表达也随着减少,表明BDNF在大脑的表达量降低参与了APP/PS1转基因小鼠产生AD的病理变化及临床表现,如神经元细胞凋亡增加和学习记忆能力降低。
BDNF在神经系统内的重要作用促使研究人员关注其参与中枢神经系统疾病的病理机制和治疗潜力,对AD患者的大脑标本检测表明,BDNF在mRNA和蛋白质表达水平都出现降低,且这种减低在AD患者出现轻度认知障碍阶段就已发生,说明BDNF在大脑内表达水平的降低确实导致AD记忆能力降低等临床症状的出现[4]。BDNF基因的单核苷酸多态性(Val66Met,rs6265)影响该蛋白在细胞内的转导和分泌,也参与AD的发病病理机制,尤其是Met携带者具有更严重的Aβ斑聚集和认知功能障碍[9-10]。其它研究证明,增强或促进脑内BDNF的表达可以改善其他中枢神经系统疾病的病理改变和临床症状,如脑内高的BDNF水平抑制抑郁症小鼠海马区神经元的凋亡,减轻抑郁症症状,从而发挥神经保护作用[11-12]。本研究显示,12月龄的APP/PS1双转基因小鼠皮层和海马区成熟形式BDNF的表达下降,并出现神经元凋亡增加,导致小鼠空间学习记忆能力的降低。因此,调控脑内成熟BDNF的含量也许可以作为预防和治疗AD的一个有效手段。

