脓毒症相关性脑病小鼠模型的建立及其认知功能障碍的初步研究*
蓝 欣, 肖 书▲,张家玮,程小凤,赵佳仪,王华东,陆大祥,朱丽红△
(暨南大学1基础医学院病理生理学系,2附属第一医院,国家中医药管理局三级科研实验室,广东 广州 510632)
脓毒症相关性脑病(sepsis-associated encephalo-pathy, SAE),又称脓毒性脑病,是由脓毒症所致的全身炎症反应所引起的一种弥漫性脑功能障碍,是脓毒血症的严重并发症之一[1]。SAE以注意力不集中和谵妄甚至昏迷等不同程度的脑功能障碍为主要临床特征[2],可导致脓毒症患者死亡率增加,同时伴有行为、认知、意识状态和知觉等改变,并且脓毒症患者预后往往出现长期认知障碍等后遗症。目前临床上对于SAE的诊断与治疗尚未有特异性方法,因而脓毒症脑病患者的生存率以及预后生存质量较差[3]。因此SAE的诊断治疗和预后改善是医学界面临的重大难题。
SAE发病机制错综复杂,尚未完全清楚。相关研究显示,SAE可能与细菌直接侵袭和内毒素的作用、脑血流量改变[4]、脑缺血或血脑屏障功能障碍[5]、神经炎症[6]、内皮细胞功能障碍、线粒体功能障碍及氨基酸比例失调等机制有关[7]。研究发现脓毒症相关性脑病的病死率远远大于脓毒症无脑病患者,因此SAE已成为近年危重症领域的研究热点和难点之一。
动物疾病模型是研究疾病发病机制和防治的重要基础,因此建立一个合理稳定可重复的动物疾病模型对于SAE的发病机制和治疗方法的研究有重要的意义。成功复制SAE的动物模型,可为探索SAE的发病机制和治疗手段提供可行性和便捷性。盲肠结扎穿孔术(cecal ligation and puncture, CLP)是脓毒症研究的金标准,通过结扎盲肠近端,用无菌针在结扎盲肠末端贯穿穿孔[8],模拟临床上肠穿孔诱导腹膜炎的发病过程,造成腹腔内感染导致全身性炎症[9]。
本实验对小鼠行盲肠结扎穿孔术,观察C57BL/6J小鼠术后生存率、体重和神经行为学评分改变,采用水迷宫实验、爬杆实验和悬挂实验等测试其行为学变化,取材后检测血浆前列腺素E2(prostaglandin E2, PGE2)变化,目的在于建立稳定合理可重复的脓毒血症相关脑病小鼠动物模型,阐明CLP术后小鼠的学习记忆认知功能障碍。
材 料 和 方 法
1 动物
SPF级雄性C57BL/6J小鼠,体重18~22 g,8~10周龄,均购自广东省医学实验动物中心,合格证号: SYXK(粤)2012-0117,粤监证字: SCXK (粤) 2013-0002。根据动物护理指南将小鼠饲养于暨南大学实验动物中心,自由进食进水,使用灭菌饲料和垫料,室温维持在(22±2) ℃,12/12 h明暗周期,适应实验环境10 d 后开始实验。
2 主要试剂
PGE2ELISA试剂盒购自R&D。
3 主要方法
3.1实验分组 第1部分实验将小鼠随机分为4组:(1)正常对照(control)组(n=6);(2)假手术(sham)组(n=6):只对小鼠进行盲肠分离,不行结扎穿孔术;(3)CLP1组(n=10):用7号针对小鼠采取盲肠结扎穿孔术;(4)CLP2组(n=10):用12号针对小鼠采取盲肠结扎穿孔术。第2部分实验将小鼠随机分为3组:(1)正常对照组(n=9);(2)假手术组(n=9):只对小鼠进行盲肠分离,不行结扎穿孔术;(3)CLP组(n=20):用12号针对小鼠采取盲肠结扎穿孔术;
3.2盲肠结扎穿孔术 小鼠禁食4 h后,用1.25%三溴乙醇按13 mL/kg剂量对其行腹腔注射麻醉。麻醉后将小鼠仰卧位固定于手术台上,备皮后消毒腹部手术区域。在剑突下1~1.5 cm处沿腹白线做一约1 cm长的竖切口,无菌条件下游离肠系膜和盲肠。在距盲肠末端约0.8 cm处用1号线结扎肠管,根据分组不同分别用7号和12号针穿孔2次,挤出少许粪便,擦干,回纳盲肠。4号线缝合腹部肌肉和皮肤后,于小鼠颈部皮下注射生理盐水(30 mL/kg)作为术后补液。假手术组小鼠,仅游离暴露盲肠,既不结扎也不穿孔。
3.3基本情况观察及生存分析 CLP术后,连续7 d观察记录各组小鼠基本情况和存活数量。计算存活率,绘制生存曲线。
3.4神经行为学评分 神经行为学评分主要是用于评估小鼠的神经行为变化[10],包括角膜反射,耳廓反射,翻正反射,甩尾反射和逃避反射。角膜反射:用棉签轻触小鼠的角膜,引起眨眼或摇头。耳廓反射:触动小鼠的耳廓引起强烈的头部旋转为正常。翻正反射:将小鼠标置在仰卧位,迅速恢复俯卧位,并前后脚放平为正常。甩尾反射逃:短暂刺激尾巴,鼠转身逃脱伤害为正常。逃避反射:给予小鼠身体短暂刺激,小鼠逃避刺激为正常。正常反射(1 s内)记为2分,反射迟钝(1~10 s内)记为1分,无反射记为0分。记录小鼠每种反射所得分数,每项分数相加记为总分,10分为满分。
3.5Morris水迷宫实验 Morris水迷宫实验是用于评价小鼠空间学习和记忆能力的经典行为学实验[11],包括定位航行实验和空间探索实验。在CLP术之前,将所有实验小鼠进行连续1周的水迷宫训练:将平台置于某一随机象限,训练小鼠找到水下隐藏平台,每天随机3个象限,每个象限60 s,若小鼠60 s内未找到隐藏平台,则引导小鼠至平台上停留10 s。CLP术后小鼠进行水迷宫测试,其中定位航行实验:轻轻地将小鼠面向池壁、尾部朝水池中央放入水中随机4个象限,记录小鼠找到隐藏平台所需的时间,记为逃避潜伏期;若小鼠在60 s 内未找到平台,实验者需引导其至平台并停留10 s,并记其潜伏期为60 s。空间探索实验:平台所在象限为目标象限,撤除水下平台,从目标象限的对角线象限将小鼠放入水中,记录小鼠在60 s内穿过平台所在位置的次数及在目标象限内停留的时间。
3.6爬杆实验 所用的杆长60 cm,直径1 cm,在杆周缠2层纱布。在实验之前,持续3 d训练小鼠爬杆行为[12]。将小鼠置于杆的顶端,小鼠会沿杆往下爬,记录小鼠爬完杆长上半部分所用时间、下半部分所用时间及全长所用时间。3 s内完成记3分、6 s内完成记2分、超过6 s完成记1 分,将3次分数相加记为总分。
3.7悬挂实验 在实验之前,持续3 d训练小鼠爬杆行为。引导小鼠由前爪悬挂在杆上,观察小鼠前后爪均抓不住杆,记0分;前爪可以抓住,记1分;只有一只后爪可以抓住,记2分;两只后爪均可以抓住,记3分[13]。
3.8避暗实验 避暗实验利用小鼠趋暗避明的习性,避暗装置分为暗室和明室,中间有一门洞相连,暗室底部铺有通电的铜栅,小鼠进入暗室即受到电击。实验前3 d对小鼠进行适应训练,将小鼠头朝室壁放入明室内,不通电状态下将明暗室之间的门洞敞开,让小鼠在两室内自由活动5 min后取出。实验前2 d对小鼠进行避暗训练,将小鼠头朝室壁放入明室,关闭两室之间门洞,通电后将门洞打开,整个实验持续5 min,电压为36 V。记录过程中小鼠首次进入暗室的时间为逃避潜伏期,以及小鼠在5 min内进入暗室的次数为错误次数。若小鼠5 min内未进入暗室,逃避潜伏期记为300 s,错误次数记为0。
3.9ELISA CLP术后7 d,行为学实验结束后通过眼球采血法将各小鼠血液分别收集到1.5 mL的EP管中,室温放置2 h后,1 000 ×g离心20 min。取上清液,即为血清。用R&D的PGE2ELISA试剂盒,根据试剂盒说明测定小鼠血清中PGE2含量。
4 统计学处理
使用SPSS 13.0统计软件进行统计学分析,计量资料采用均数±标准误(mean±SEM)表示。用Kaplan-Meier分析存活率。组间数据比较用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 CLP术后各组小鼠基本情况及存活率
CLP术后,小鼠出现嗜睡、竖毛、寒颤、抽搐和厌食等一系列症状,第1部分实验中7号针穿孔组小鼠48 h死亡率为20%,12号针穿孔组小鼠48 h死亡率为30%,见图1。
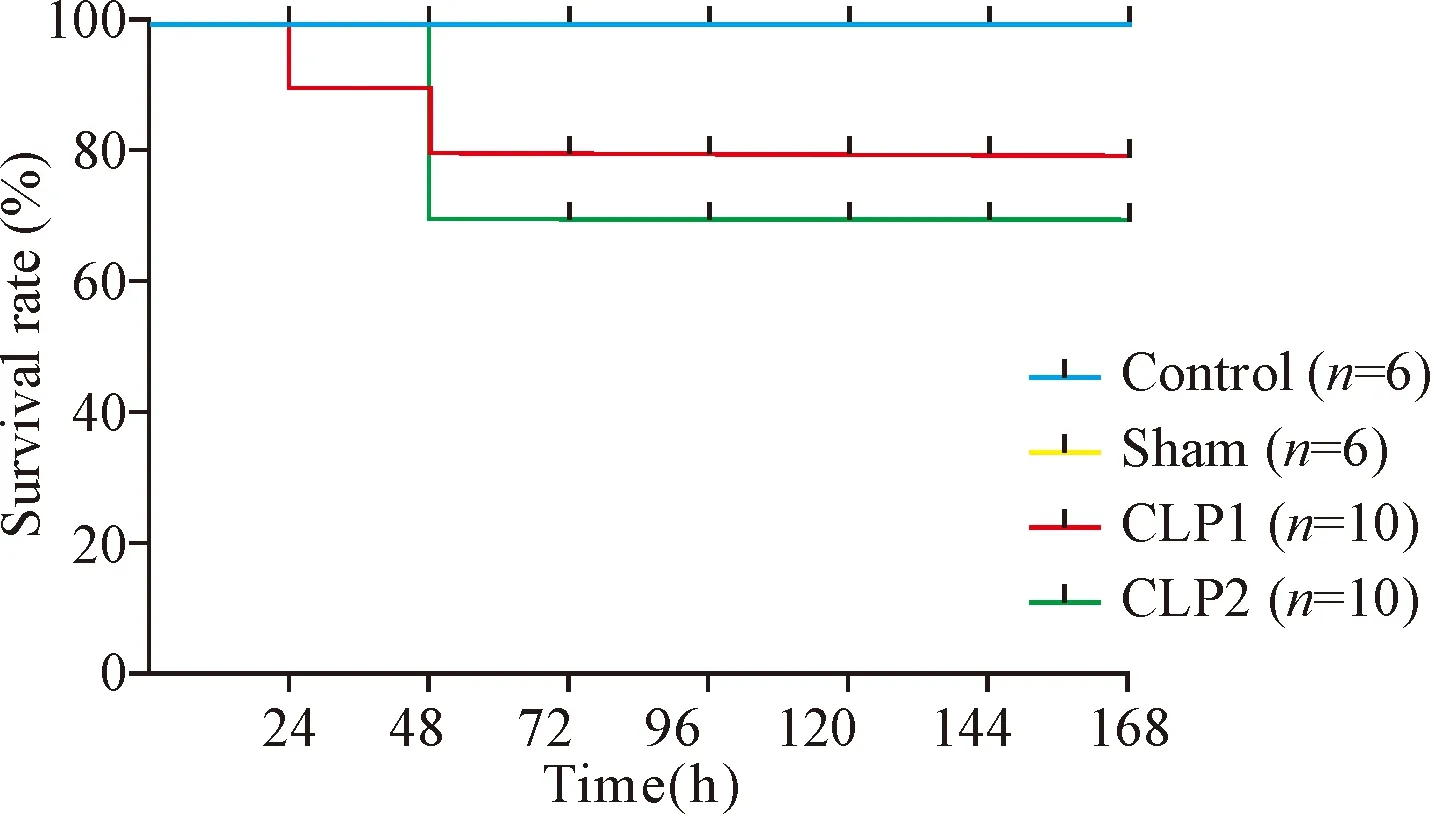
Figure 1.The survival analysis of mice in different group.
图1 各组小鼠生存率分析
2 CLP术后小鼠神经行为学评分变化
第1部分实验中2组CLP小鼠术后3 h神经行为学评分均开始下降,至24 h下降最为显著(P<0.01),此后评分开始恢复,但仍低于对照组和假手术组,见图2。第2部分实验中CLP组小鼠24 h神经行为学评分结果统计与第1部分结果相一致,见表1。
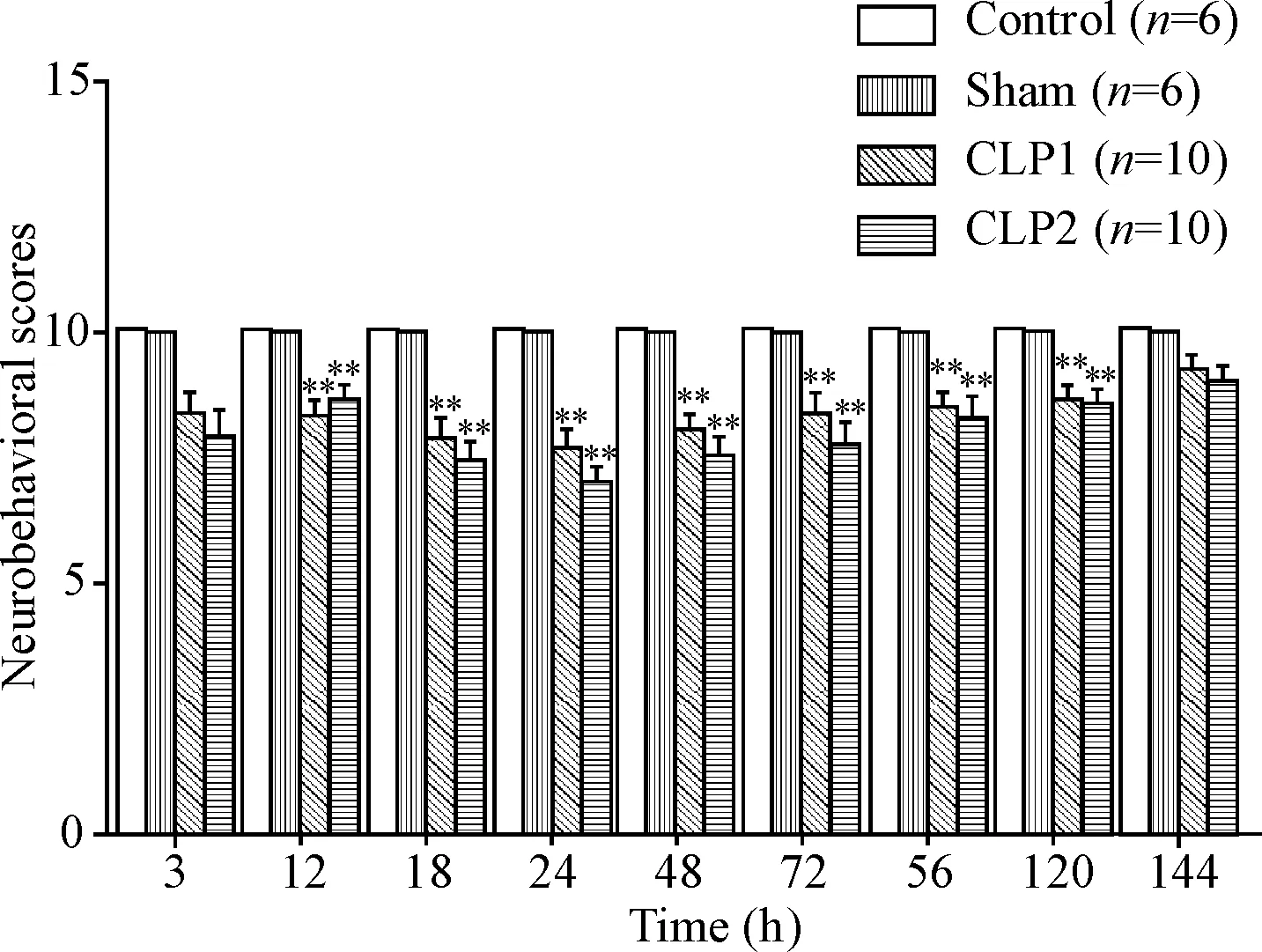
Figure 2.Neurobehavioral scores of the mice in different group at different time. Mean±SEM.**P<0.01vscontrol group.
图2 CLP术后小鼠的神经行为学评分变化
表1 CLP术后24 h各组小鼠神经行为学评分
Table 1.Neurobehavioral scores of the mice in different group at 24 h after CLP (Mean±SEM)

GroupnNeurobehavioral scoresControl910±0Sham910±0CLP20 7.20±0.17**
**P<0.01vscontrol group.
3 CLP对小鼠水迷宫实验的影响
在第1部分水迷宫实验中,与正常组和假手术相比较,CLP1组与CLP2组小鼠术后寻找水下隐藏平台的时间均显著延长(P<0.01),有的甚至在60 s结束之后仍无法成功寻找到平台,见图3。
在第2部分空间探索实验中,CLP组小鼠目标象限停留时间减少,60 s内穿越平台次数也显著少于对照组和假手术组(P<0.01),见表2。
4 CLP对小鼠爬杆实验的影响
第2部分爬杆实验中,采用12号针行CLP术,造成小鼠无法顺利流畅地爬完全程,爬杆实验中出现行动迟缓、运动不协调的现象,甚至出现跌落情况,见表3。

Figure 3.The results of navigation test in Morris Water Maze after CLP. Mean±SEM.**P<0.01vscontrol group.
图3 CLP对小鼠水迷宫逃避潜伏期的影响
表2 CLP对小鼠空间探索实验的影响
Table 2.Spatial probe test for retention of crossing target plat- form and stay time after CLP (Mean±SEM)

GroupnStay time (s)Through platform numberControl932.29±3.788.00±1.21Sham931.11±2.207.71±0.42CLP2017.18±2.93**6.50±1.62**
**P<0.01vscontrol group.
表3 CLP对小鼠爬杆实验的影响
Table 3.Pole test scores of the mice in different groups (Mean±SEM)

GroupnPole test scoresControl96.38±0.38Sham96.33±1.00CLP20 4.55±0.51**
**P<0.01vscontrol group.
5 CLP对小鼠悬挂实验的影响
第2部分悬挂实验中,正常组和假手术组小鼠能悬挂较长时间,而CLP组小鼠在术后运动协调性受到显著影响,双后肢无法悬挂,或者仅前肢可短暂悬挂,或直接跌落,悬挂实验结果见表4。
表4 CLP对小鼠悬挂实验的影响
Table 4.Wire suspension scores of the mice in different groups (Mean±SEM)

GroupnSuspension scoresControl93.00±0.00Sham93.00±0.00CLP20 1.64±0.33**
**P<0.01vscontrol group.
6 CLP对小鼠避暗实验的影响
第2部分避暗实验结果示,CLP组小鼠在实验开始后大部分活动量显著减小甚至无活动,有的甚至未曾进入暗室。在避暗实验中CLP术后的小鼠逃避潜伏期显著高于对照组和假手术组(P<0.05),错误次数也显著减少(P<0.05),见图4。
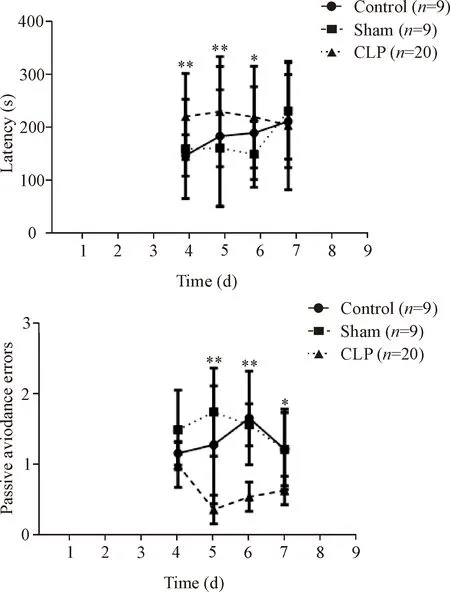
Figure 4.Effects of CLP on the memory and learning of the mice in passive avoidance test.Mean±SEM.*P<0.05,**P<0.01vscontrol group.
图4 CLP对小鼠避暗实验的影响
7 CLP术后各组小鼠血清PGE2检测结果
第2部分实验中,行为学实验结束后取小鼠血清检测PGE2改变。ELISA结果显示,CLP术后小鼠血清中PGE2释放量较正常组和假手术组显著增多(P<0.01)。统计结果见图5。
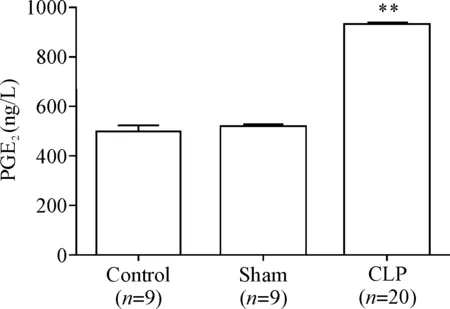
Figure 5.CLP promoted the release of PGE2in the serum of mice. Mean±SEM.**P<0.01vscontrol group.
图5 CLP术后各组小鼠血清PGE2含量
讨 论
动物疾病模型的成功建立是为研究人类疾病的发生、发展规律,以及为研究人类疾病的预防、治疗、药物筛选等提供实验依据。目前建立脓毒症动物模型的方法主要有:盲肠结扎穿孔、经腹腔或静脉注射大剂量脂多糖(lipopolysaccharide,LPS)、腹腔持续置管引流、活细菌或病毒造成细菌性腹膜炎、软组织感染等[14]。目前脓毒症及其并发症的动物模型有很多,但是尚缺乏用于SAE及其预后长期认知功能障碍研究的稳定小鼠模型。 CLP是建立脓毒症模型的金标准,可重复性好,易于标准化,CLP术后的动物通常很快表现出脓毒症的症状和变化[15]。本实验采用CLP术建立稳定的脓毒血症小鼠模型,同时建立认知功能障碍评价体系,为SAE研究奠定了模型基础。
SAE是脓毒症患者常见并发症之一,发病率和病死率高,可出现在脓毒症进程的各个阶段中[16]。在临床中,由于SAE诊断标准尚未明确、诊断标准不一,缺乏特异性的检测标志物[17],不同学者的研究对SAE发病率报道有较大差别,可在9%~71%不等,而由于患者常用的镇静剂、呼吸机、本身存在的神经系统器质性病变及伴随的其它脏器衰竭、代谢紊乱等众多复杂因素的存在,实际SAE的发病率远远超过文献中所报道的数据。在小鼠模型中SAE的发病率控制有一定难度,较大样本量就可能会更好地控制SAE发病率的稳定性。临床上对SAE的诊断是一种排它性诊断,利用动物模型研究SAE发病机制及治疗方案,可通过观察动物的学习认知功能改变进行评价。
相关临床研究数据表明,SAE的死亡率约在33%~39%之间[18]。实验证明,在CLP脓毒症小鼠模型中,当盲肠结扎长度和穿刺次数一定的条件下,穿孔针的尺寸大小不同,小鼠死亡率和预后情况也并不一样[9]。本次实验我们分别用7号针和12号针穿孔2次,引发小鼠脓毒症相关脑病,旨在建立适合SAE预后长期认知功能障碍研究的稳定的小鼠模型。7号针和12号针穿孔组小鼠48 h死亡率分别为为20%和30%,其中12号针穿孔组小鼠死亡率更符合SAE相关报导,且可成功复制该死亡率。
CLP术后,小鼠出现嗜睡、竖毛、寒颤、抽搐和厌食等一系列症状[19],符合脓毒症的症状,术后伤口愈合状况良好。临床上可观察到SAE患者从轻微异常到深昏迷的意识状态变化,患者轻者可表现为行为异常、意识状态改变、注意力不集中等,严重病例可出现易激惹、谵妄、继之昏迷[20-21]。本实验中CLP小鼠神经行为学评分始终低于正常组和假手术组,12号针组小鼠评分较7号针小鼠减少更为明显,至24 h下降最明显,此后得分开始增高。
Morris 水迷宫[11]是应用小鼠学习记忆能力来评价脑功能的经典行为学方法[22]。在Morris水迷宫实验中,我们首先动态观察了2种尺寸穿刺针CLP小鼠找到水下隐藏平台的时间变化,在整个过程中较正常组和假手术组显著延长,12号针穿刺组小鼠的逃避潜伏期较7号针小鼠延长更为显著,且无改善趋势。综合死亡率、神经行为学评分以及水迷宫动态结果考虑,我们最终选取12号针作为CLP穿孔条件。
避暗实验是利用小鼠具有趋暗避明的习性设计,小鼠进入暗室即受到电击造成轻微不适,被迫逃回亮处并获得记忆,对记忆过程特别是记忆再现有较高的敏感度。由于小鼠CLP术后精神恍惚异常、嗜睡、寒颤,CLP组小鼠实验开始后大部分保持刚进入避暗装置时的状态蜷缩在明室内活动量显著减小甚至无活动,未曾进入暗室,不存在记忆刺激和形成过程,由此可见避暗实验并不适用于SAE小鼠模型中学习认知记忆功能的评价。
此外,CLP小鼠的运动协调能力也受到显著影响[3]。爬杆实验是一种敏感的行为测试,可以反映运动功能障碍[12, 22]。在爬杆测试中,CLP组小鼠分数降低,所需时间更长,表明CLP术后小鼠运动能力显著下降。悬挂实验,不仅可以检测肌肉力量,还可检测协调平衡能力[13]。我们的研究结果表明,CLP不仅会削弱小鼠肌肉力量,还会使其协调平衡能力受到损伤。
脓毒症发生后,全身炎症是机体对感染做出的主要的反应,其进展可能加速中枢神经系统疾病相关的器官功能障碍[23],PGE2是炎症、发热及疼痛发生和发展的一个关键介质[24]。相关实验表明,脓毒症病人血浆中PGE2的含量显著增高,全身炎症反应发生时免疫细胞主要是巨噬细胞受刺激后大量分泌PGE2[25]。本实验中CLP小鼠术后血清中PGE2释放量显著高于对照组和假手术组。
综上所述,通过CLP术距盲肠末端0.8 cm处结扎盲肠后用12号针穿孔2次,可以成功构建SAE小鼠模型,用此法建立的SAE小鼠模型存在学习记忆认知功能障碍,死亡率和行为学改变符合SAE临床表现。

