ZIP14对人肝细胞癌BEL-7404细胞生物学行为的影响*
郑佳莹,李亚东,郑庆祝,余丽丽,吴庆伟,邱福南,伍严安,黄 毅△
(1福建医科大学省立临床医学院,2福建省立医院检验科,3福建省立医院肝胆外科,福建 福州 350001)
肝细胞癌(hepatocellular carcinoma,HCC)是全球范围内高发的恶性肿瘤之一,具有易转移、易复发和死亡率高的特点,其治疗仍是一个世界性的难题[1]。锌(zinc,Zn)是人体重要的微量元素,是机体多种含有锌指结构的酶的关键组成成分[2]。正常的肝脏含有丰富的锌[3],而锌在组织细胞内的稳态,与锌转运蛋白有关。现已发现存在2个锌转运蛋白家族——SLC30基因家族和SLC39基因家族,其中在哺乳动物体内SLC30基因家族又被命名为SLC39A基因家族,对应编码ZRT/IRT样蛋白(ZRT/IRT-like proteins,ZIP)[4],其功能是促进细胞外的锌内流入细胞浆内[5]。研究表明HCC患者肿瘤组织中,锌的含量明显低于配对癌旁组织以及正常肝脏组织[6-9];近来有国外学者报道,负责转运锌进入肝脏细胞的关键蛋白ZIP14,其在肝癌组织的表达和正常肝组织相比,亦出现明显减少。因此推测HCC的肿瘤组织可能通过下调ZIP14的表达,减少胞浆内锌的摄入以避免锌的积聚对肿瘤细胞的毒性作用[9]。本研究旨在观察ZIP14在HCC肿瘤组织的表达情况,并构建有效表达ZIP14的慢病毒载体,研究ZIP14过表达对HCC细胞活力、细胞周期及迁移和侵袭能力的影响,探讨ZIP14作为一种潜在治疗靶点在HCC的可能应用前景。
材 料 和 方 法
1 临床病例和检材的收集
80例研究对象来自2014年2月~2016年2月期间于福建省立医院肝胆外科住院行手术切除术的HCC患者,男66例,女14例,年龄 (54.3±12.2) 岁。收集患者经手术切除的癌组织和距离癌灶5 cm的配对癌旁组织,经生理盐水清洗后,立即加入RNA保存液并置于4 ℃环境过夜,次日转移至-80 ℃冰箱保存,备用real-time PCR的检测;其中60例癌组织和配对癌旁组织收集后同时置4%甲醛固定,备用免疫组化法检测。所有入选病例均为在肝炎与肝硬化基础上发生的HCC,术前均未接受放化疗及生物治疗等抗肿瘤治疗,标本均经病理检查证实。所有被检测者均知情同意。
2 细胞培养
人HCC细胞株 BEL-7404购自中国科学院细胞库,使用含10%胎牛血清的RPMI-1640培养基培养于37 ℃、5% CO2、饱和湿度的细胞培养箱内。2~3 d换液传代1次。实验用细胞为状态良好的对数生长期细胞。
3 主要试剂
氯仿(分析纯)、异丙醇(分析纯)和无水乙醇(分析纯)购自上海振兴化工一厂;RevertAid First Strand cDNA Synthesis试剂盒购自Thermo Fisher Scientific;DEPC水、TRIzol总RNA提取试剂和UltraSYBR Mixture (Low ROX)购自北京康为世纪生物科技有限公司;UltraSensitiveTMS-P 超敏试剂盒(兔)、酶底物显色剂(DAB)和柠檬酸组织抗原修复液购自福州迈新生物技术开发有限公司;兔抗人ZIP14抗体与兔抗人GAPDH抗体分别购自Rockland和CST;七水硫酸锌(细胞培养级)购自上海阿拉丁生化科技股份有限公司;RPMI-1640培养基、磷酸盐缓冲液(PBS)和青-链霉素混合液(100×)均购自HyClone;胎牛血清(fetal bovine serum,FBS)和胰蛋白酶(含EDTA)购自Gibco;MTT和DMSO购自Amresco;Matrigel 和Transwell小室购自Corning;细胞周期检测试剂盒购自杭州联科生物科技有限公司;蛋白裂解液和BCA蛋白浓度测定试剂盒购自上海碧云天生物科技有限公司;所用引物由南京金斯瑞生物科技有限公司根据设计合成,见表1。
4 主要方法
4.1Real-time PCR法检测HCC癌组织与BEL-7404细胞ZIP14 的mRNA表达 用TRIzol法提取经充分研磨的80例HCC癌组织和配对癌旁组织,用紫外分光光度仪对RNA纯度与浓度进行测定,分别取1 μg RNA按照RNA逆转录试剂盒的说明逆转录为cDNA,以SYBR GreenⅠ为荧光染料,在real-time PCR仪(ABI ViiATM7)上进行扩增。反应体系为25 μL,反应条件为:预变性95 ℃ 10 min;变性95 ℃ 15 s、退火/延伸60 ℃ 1 min,共40个循环。熔解曲线分析条件为:95 ℃ 15 s、60 ℃ 1 min、95 ℃ 15 s、60 ℃ 15 s。以GAPDH为内参照,采用相对定量的方法,根据2-ΔΔCt计算公式对结果进行数据分析。ΔCt=目的基因Ct-内参基因Ct,ΔΔCt=ΔCt(肿瘤组织)-ΔCt(癌旁组织)。扩增引物序列见表1。
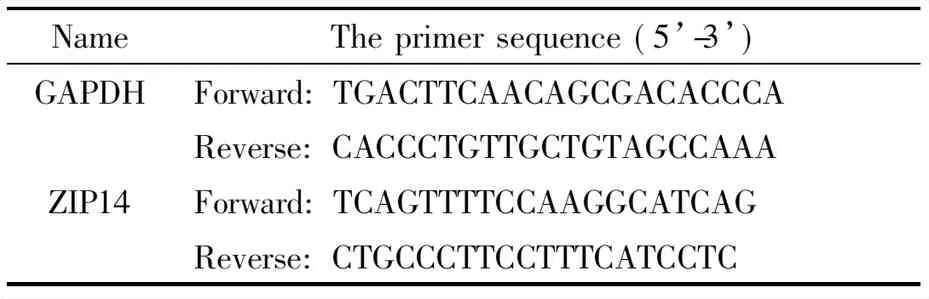
表1 Real-time PCR引物序列
4.2免疫组化法检测HCC组织ZIP14蛋白的表达 60例HCC组织和配对癌旁组织经4%甲醛固定后,制作成石蜡切片,采用免疫组化SP法染色,将抗ZIP14抗体按1 ∶100进行稀释并滴加于每张切片上进行检测,每批实验设阳性和阴性对照。蛋白在正常肝脏细胞的表达为自身切片的阳性对照,PBS液取代 I 抗作为阴性对照。判断方法和标准为细胞膜中出现棕黄色颗粒为阳性细胞,高倍镜下计数500个细胞,染色细胞<10%为阴性,≥10%为阳性,其中≥10%的肿瘤细胞中出现弱到中等强度完整细胞膜染色为弱阳性,≥10%的肿瘤细胞中出现中到高等强度完整细胞膜染色为强阳性。病理阅片由2个有经验的病理科医师双盲阅片完成。
4.3Western blot法检测BEL-7404细胞的ZIP14蛋白表达 按1×105∶1的比例加入细胞裂解液提取HCC细胞株BEL-7404的总蛋白,经紫外分光光度计 (Beckman DU640)测定含量后,分别取等量总蛋白99 ℃变性5 min,进行12% SDS-PAGE,电转移至NC膜上;封闭NC膜1 h,加入相应抗体4 ℃孵育过夜;TBS洗涤后,加辣根过氧化物酶标记的羊抗兔IgG(KPL),室温孵育1 h;TBS洗涤后加LumiGLO che-miluminescent substrate(KPL)室温下孵育1 min,曝光,洗片,然后在GelDoc凝胶图像分析仪(Bio-Rad)上扫描条带的灰度,并以GAPDH为内参照,计算ZIP14的相对表达量。
4.4表达ZIP14的慢病毒构建 (1)ZIP14表达慢病毒载体的构建:根据GenBank数据库提供的SLC39A14(即ZIP14)的序列NM_015359,设计出含交换配对碱基和酶切位点,并含有目的基因5’端部分序列用于PCR钓取目的基因的1对引物,正向引物为:5’-GAGGATCCCCGGGTACCGGTCGCCACCAT-GAAGCTGCTGCTGCTGCACC-3’,反向引物为:5’- TCCTTGTAGTCCATACCCCCAATCTGGATCTGTCCTG-AATAC-3’。经PCR扩增后,将得到的PCR产物(1 520 bp),与线性化表达载体GV365(AgeI/AgeI酶切)混匀,37 ℃反应30 min,构建重组的GV365-ZIP14慢病毒表达载体,预期表达产物为56 kD的ZIP14蛋白,然后以线性环化的空载体作为阴性对照,转化感受态大肠杆菌DH5α,挑取重组阳性菌落行PCR及测序鉴定。(2)慢病毒包装:通过Lipofectamine 2000(Invitrogen)将构建的重组慢病毒表达载体和相对应的包装质粒pHelper 1.0载体和pHelper 2.0载体共转染293T细胞进行慢病毒包装,48 h后收集上清液,浓缩,测定慢病毒的滴度,分装,-80 ℃保存备用。(3)细胞转染及实验分组:根据预实验摸索的MOI值(MOI=5),将获得的慢病毒转染对数生长期的BEL-7404细胞(存在ZIP14的低表达),12 h后吸去含病毒和聚凝胺的上清液,加入新鲜含有10% FBS的RPMI-1640上清液。转染后96 h,用荧光倒置显微镜观察,慢病毒转染效率在80%以上的细胞分组用于后续实验。每次实验分3组:过表达(over-expression,OE)组,转染ZIP14表达慢病毒;阴性对照(negative control,NC)组,转染ZIP14空载体;空白对照(control,CON)组,未转染慢病毒。(4)GV365-ZIP14表达的鉴定:收集慢病毒转染5 d后的各组细胞,分别提取RNA和总蛋白,采用real-time PCR法检测ZIP14的mRNA,Western blot法检测ZIP14的蛋白,观察ZIP14表达慢病毒在BEL-7404细胞内表达ZIP14的效果。
4.5七水硫酸锌预处理BEL-7404细胞 配制含有七水硫酸锌的细胞完全培养基,使得锌离子的终浓度分别为0、25、50、75和100 μmol/L。收集对数期BEL-7404细胞,调整细胞悬液浓度为5.0×107/L,以每孔1 mL接种细胞于6孔板中,37 ℃和5% CO2条件下培养20 h后,弃去原培养液,根据实验设计加入含有相应浓度锌离子的完全培养基,每孔2 mL。37 ℃、5% CO2条件下培养48 h;以此预处理的细胞用于后续的DNA倍体法检测细胞周期、Transwell小室细胞迁移实验和Transwell小室细胞侵袭实验。
4.6MTT法检测ZIP14过表达对BEL-7404细胞活力的影响 收集对数期BEL-7404细胞,调整细胞悬液浓度为2.0×107/L,以每孔100 μL接种于96孔板,37 ℃、5% CO2条件下培养OE组、NC组和CON组细胞18 h;移去上层细胞培养液,加入200 μL终浓度为0、25、50、75和100 μmol/L的硫酸锌,以NC组的0 μmol/L硫酸锌为对照组,其余各加入不同浓度硫酸锌的组别为实验组,分别培养细胞24 h、48 h和72 h;加入20 μL MTT溶液,混匀,继续孵育4 h。小心吸弃孔内溶液,加入150 μL DMSO溶解甲臜,置摇床上低速振荡10 min,使结晶物充分溶解。用酶标仪(Thermo Multiskan MK3)测量各孔的吸光度(A)值(检测波长为490 nm,校正波长为630 nm),以空白对照孔调零,取3次试验均值;各时间段细胞存活率(%)=A实验组/A正常对照组×100%。
4.7DNA倍体法检测细胞周期 收集硫酸锌预处理的BEL-7404细胞,调整细胞悬液浓度至1.0×109/L;取1 mL单细胞悬液离心,去除培养基,PBS洗2次;加入1 mL DNA staining solution(已含有PI和RNase)以及10 μL破膜剂,漩涡振荡器上振荡5~10 s,避光30 min;在FACSCalibur流式细胞仪上对样本进行检测,运用Modfit软件分析计算实验结果。
4.8Transwell小室细胞迁移实验 收集硫酸锌预处理的BEL-7404细胞,PBS洗2次后,调整细胞悬液浓度至5.0×108/L;取出Transwell小室,置于24孔板内,下室加入含有10% FBS的完全培养基600 μL,上室加入无血清细胞悬液100 μL。37 ℃和5% CO2条件下培养24 h;将小室的上室取出,用棉签擦去上室内未迁移的细胞,PBS液漂洗小室2遍;用4%多聚甲醛固定上室20 min;其后PBS漂洗2遍,适当风干后用0.5%结晶紫染色20 min,PBS漂洗2遍,风干。倒置显微镜(ZEISS Axiocam ERc 5s)高倍镜下任意选取5个不相同的视野,拍照,计数细胞。另以各组0 μmol/L硫酸锌预处理为正常对照组,其余不同硫酸锌浓度组为实验组,计算各组迁移变化率(%)=(1-实验组平均细胞数/对照组平均细胞数)×100%。
4.9Transwell小室细胞侵袭实验 铺胶前1 d将事先分装好的Matrigel取出,4 ℃冰盒过夜;第2天用预冷过的RPMI-1640培养基以基质胶∶RPMI-1640=1 ∶29的比例稀释,迅速往每个小室的上室加入75 μL稀释后的基质胶,37 ℃静置3 h。收集硫酸锌预处理的BEL-7404细胞,PBS洗2次后,调整细胞悬液浓度至1.0×109/L;向已铺好基质胶的Transwell小室加入无血清细胞悬液100 μL,下室加入含有10% FBS的完全培养基600 μL,37 ℃、5% CO2条件下培养48 h;将小室的上室取出,用棉签擦去上室内未迁移的细胞,PBS液漂洗2遍;用4%多聚甲醛固定上室20 min;其后PBS漂洗2遍,适当风干后用0.5%结晶紫染色20 min,PBS漂洗2遍,风干。倒置显微镜高倍镜下任意选取5个不相同的视野,拍照,计数细胞。另以各组0 μmol/L硫酸锌预处理为正常对照组,其余不同硫酸锌浓度组为实验组,计算各组侵袭变化率,侵袭率(%)=(1-实验组平均细胞数/对照组平均细胞数)×100%。
5 统计学处理
采用GraphPad Prism 5.0作图,采用IBM SPSS Statistics 23.0软件进行统计学处理。各组实验均重复3次,所有计量资料的数据结果用均数±标准差(mean±SD)表示。采用Kolmogorov-Smirnov法进行正态性检验,对符合正态分布的数据,两组样本均值的差异比较采用t检验,多组样本行Levene方差齐性检验,方差齐即采用单因素方差分析(one-way ANOVA)进行组间差异的显著性检验,并用Bonferroni校正的t检验进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 HCC组织ZIP14的表达
80例HCC组织ZIP14的mRNA表达水平明显低于癌旁组织(P<0.01),见图1,其中86.25%(69/80)癌组织的ZIP14 mRNA表达出现下调。免疫组化检测结果显示ZIP14蛋白的阳性表达主要位于细胞膜,见图2;60例HCC组织仅有8例呈ZIP14蛋白的强阳性表达(13.33%,8/60),其余52例呈弱阳性表达(86.67%,52/60),而配对癌旁组织均呈ZIP14蛋白的强阳性表达(100%,60/60);HCC组织的ZIP14蛋白强阳性表达率明显低于配对癌旁组织(P<0.01)。
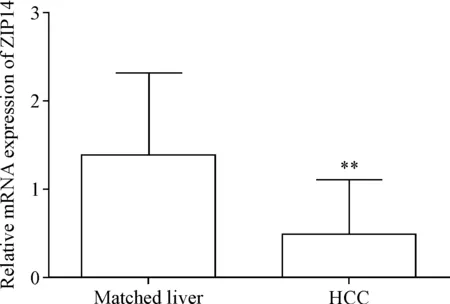
Figure 1.The relative mRNA expression level of ZIP14 in the HCC tissues and matched liver tissues.Mean±SD.n=3.**P<0.01vsmatched liver group.
图1 HCC组织与配对癌旁组织ZIP14的mRNA表达
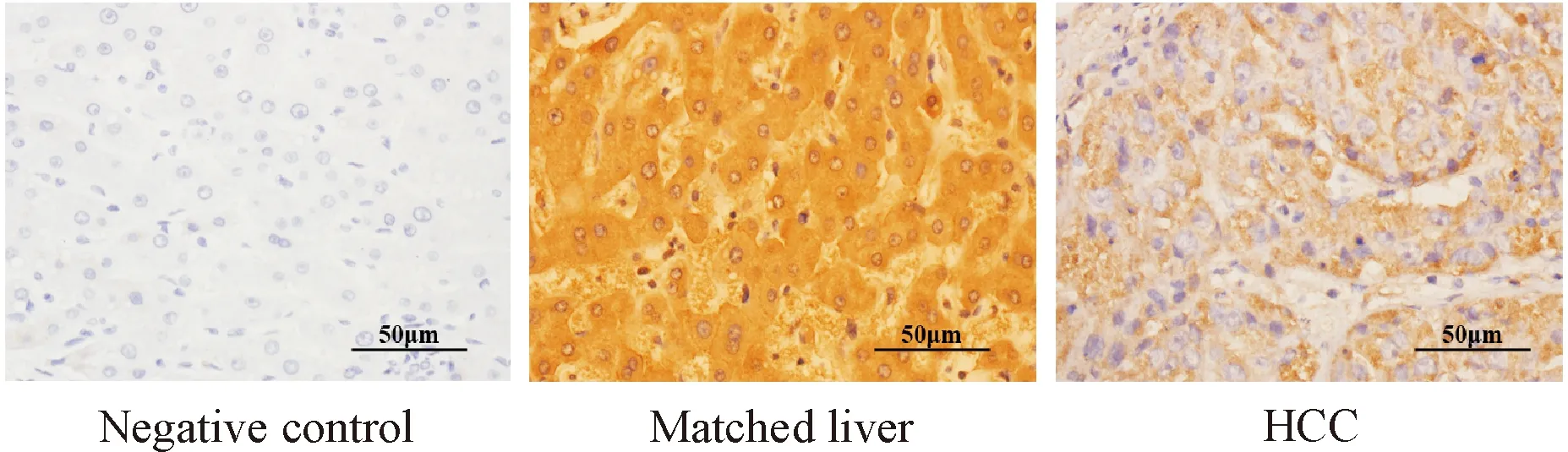
Figure 2.The protein expression of ZIP14 in the HCC tissues and matched liver tissues (IHC, ×400).
图2 HCC患者癌组织和配对癌旁组织ZIP14蛋白的表达
2 GV365-ZIP14慢病毒在BEL-7404细胞内的转染效果
构建GV365-ZIP14表达慢病毒并转染BEL-7404细胞后,与NC组相比较,OE组ZIP14的mRNA与蛋白表达水平均明显升高(P<0.01或P<0.05),见图3。

Figure 3.The effect of GV365-ZIP14 on the mRNA and protein expression of ZIP14 in the BEL-7404 cells. A: the relative mRNA expression levels of ZIP14 among OE, NC and CON groups; B: the relative protein expression levels of ZIP14 among OE, NC and CON groups. Mean±SD.n=3.*P<0.05,**P<0.01vsNC group.
图3 GV365-ZIP14对BEL-7404细胞ZIP14表达的影响
3 ZIP14过表达对BEL-7404细胞活力的影响
MTT法检测结果显示,培养24 h后,100 μmol/L和125 μmol/L硫酸锌处理的OE组细胞存活率明显低于NC组(P<0.05);培养48 h和72 h后,OE组细胞的存活率均明显低于NC组(P<0.05或P<0.01),见图4。
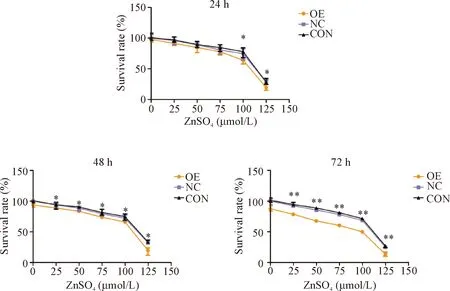
Figure 4.The effect of GV365-ZIP14 on the viability of BEL-7404 cells. Mean±SD.n=5.*P<0.05,**P<0.01vsNC group.
图4 GV365-ZIP14对BEL-7404细胞活力的影响
4 ZIP14过表达对BEL-7404细胞周期分布的影响
DNA倍体法检测结果显示,在相同浓度硫酸锌刺激下,OE组处于G0/G1期和S期的细胞比例均明显低于NC组(P<0.05或P<0.01),处于G2/M期的细胞比例均明显高于NC组(P<0.01),见图5。
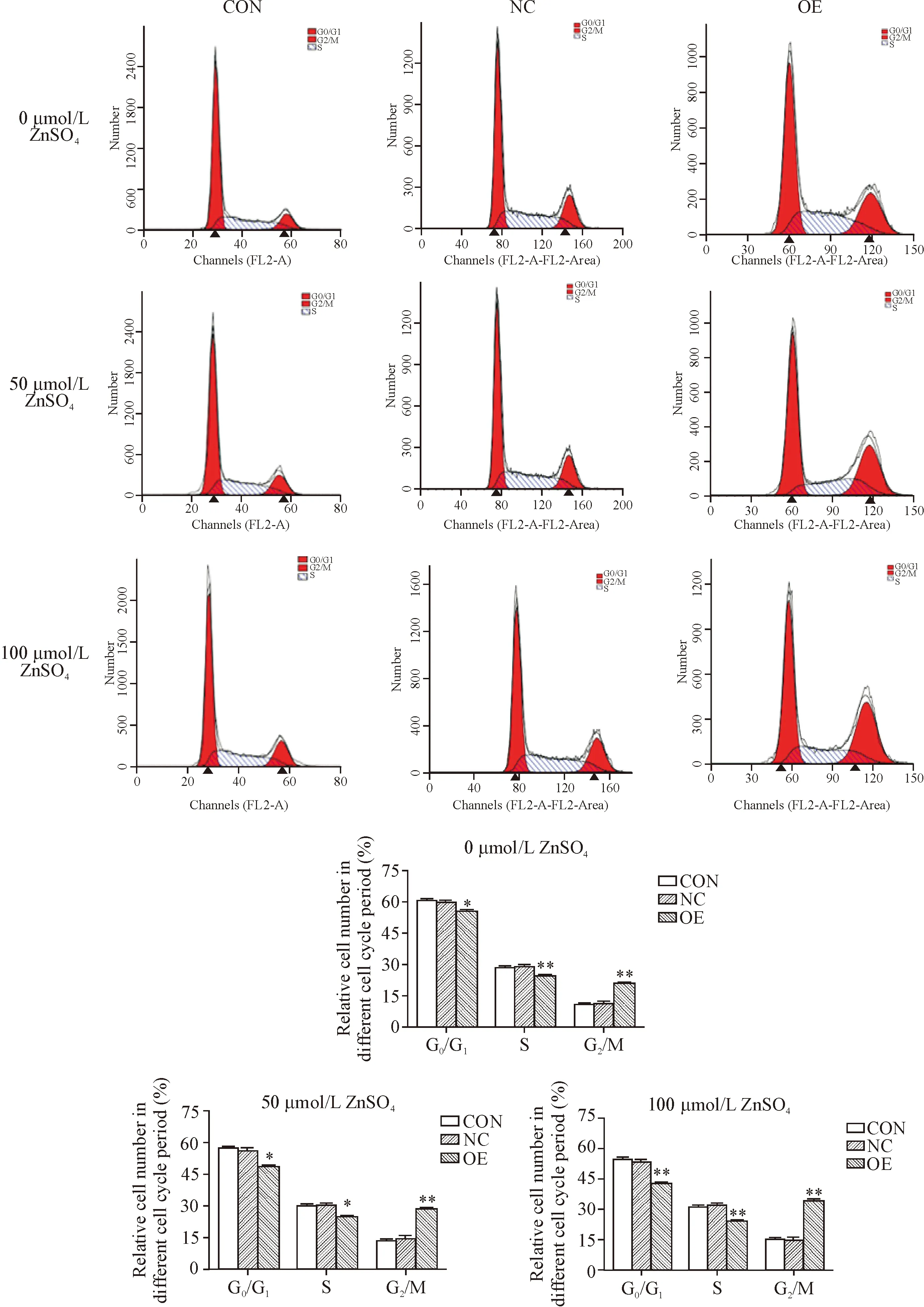
Figure 5.The effect of GV365-ZIP14 on the cell cycle distribution of BEL-7404 cells. Mean±SD.n=3.*P<0.05,**P<0.01vsNC group.
图5 GV365-ZIP14对BEL-7404细胞周期的影响
5 ZIP14过表达对BEL-7404细胞迁移能力的影响
Transwell小室细胞迁移实验检测结果显示,在相同浓度硫酸锌刺激下,OE组细胞的迁移能力均显著低于NC组(P<0.01),见图6。 各组细胞的迁移变化率结果显示,OE组的细胞迁移变化率改变程度均明显高于NC组(P<0.05),见图7。

Figure 6.The effect of GV365-ZIP14 on the migration ability of BEL-7404 cells (×200). Mean±SD.n=3.**P<0.01vsNC group.
图6 GV365-ZIP14对BEL-7404细胞迁移能力的影响
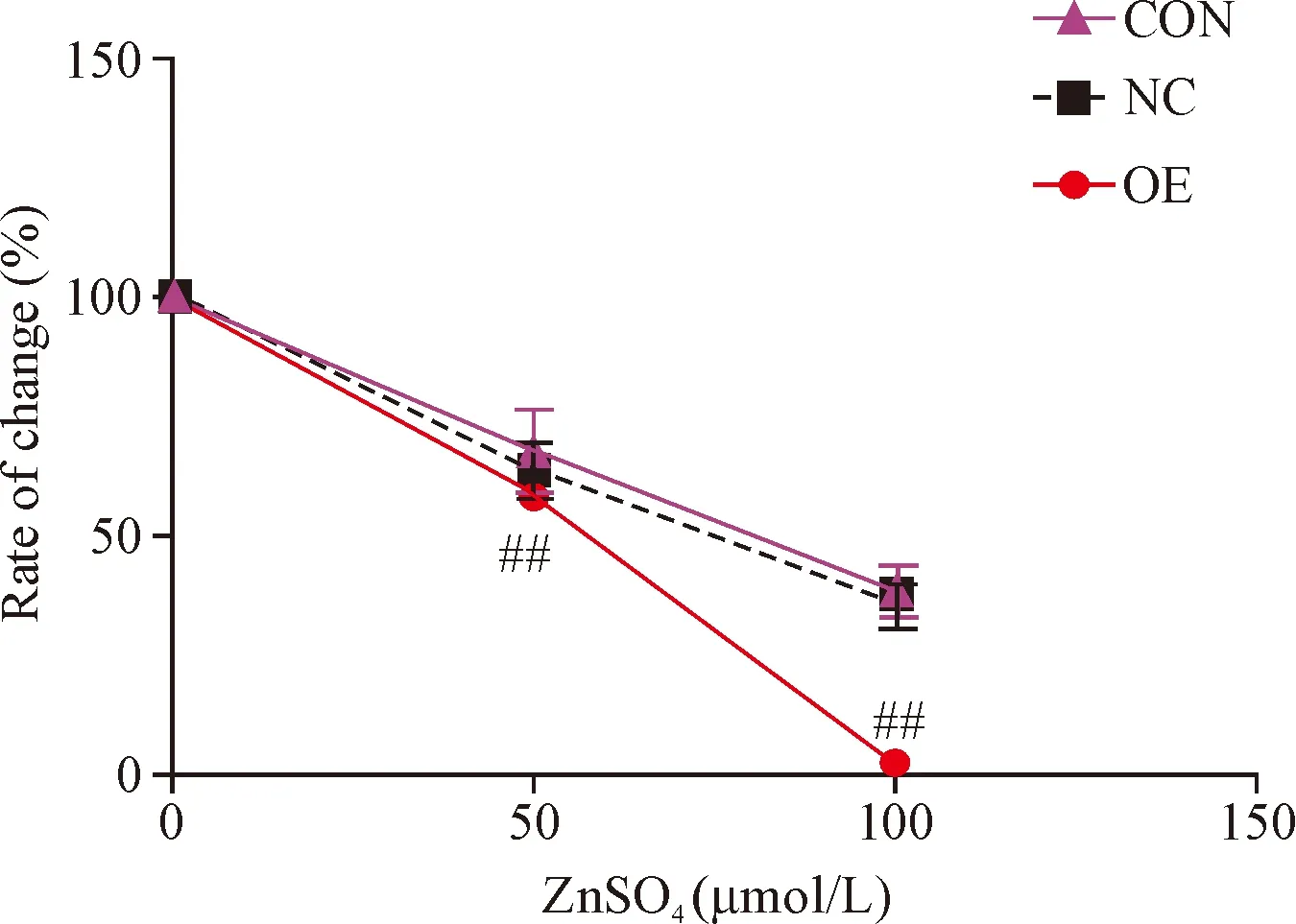
Figure 7.The inhibition rate of migratory cells with ZnSO4treatment at different concentrations. Mean±SD.n=3.##P<0.01vsNC group.
图7 不同浓度硫酸锌条件下细胞迁移的变化率
6 ZIP14过表达对BEL-7404细胞侵袭能力的影响
Transwell小室细胞侵袭实验检测结果显示,在相同浓度硫酸锌刺激下,OE组细胞的迁移能力均显著低于NC组(P<0.01),见图8。各组细胞的变化率结果显示,OE组的细胞侵袭变化率改变程度均明显高于NC组(P<0.05),见图9。
讨 论
近年来的研究发现,ZIP家族部分成员在一些恶性肿瘤组织中存在异常表达,可能参与了肿瘤发生发展的进程。Kagara等[10]首先发现ZIP10蛋白表达量的增高与乳腺癌的转移功能有关。Taylor等[11]发现,ZIP6是一种雌激素调控基因,与转移性乳腺癌有关,且在低分化的肿瘤中呈高表达,有望成为新的乳腺癌诊断标志物。也有研究发现,ZIP4蛋白可明显抑制前列腺癌细胞株DU145的增殖和侵袭能力[12]。

Figure 8.The effect of GV365-ZIP14 on the invasion ability of BEL-7404 cells (×200). Mean±SD.n=3.**P<0.01vsNC group.
图8 GV365-ZIP14对BEL-7404细胞侵袭能力的影响
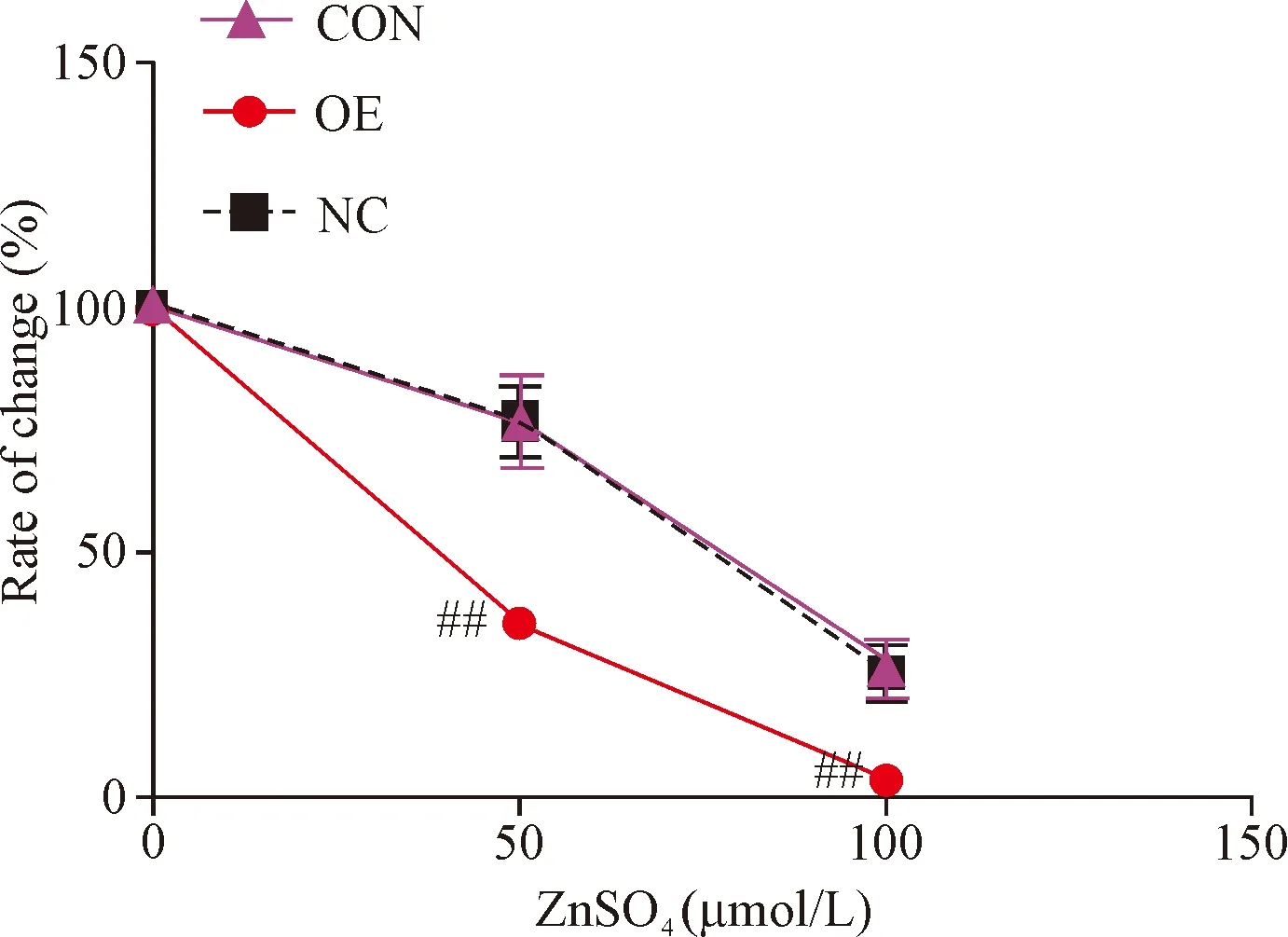
Figure 9.The inhibition rate of invasive cells at different concentrations of ZnSO4.Mean±SD.n=3.##P<0.01vsNC group.
图9 不同浓度硫酸锌条件下细胞侵袭的变化率
作为ZIP家族的重要成员,ZIP14在肝脏组织中具有丰富的表达,是促进细胞外的锌内流入细胞浆内、维护肝脏细胞锌稳态的关键锌转运蛋白。HCC癌组织存在低锌的环境,可能与癌细胞下调ZIP14的表达以减少锌的内流有关[9]。本课题组的前期研究发现,给予一定剂量外源锌的刺激,可明显抑制HCC细胞的生长、迁移和侵袭能力[13];在保持外源锌刺激的条件下,对ZIP14的表达予以上调以进一步提高细胞内锌的浓度,对HCC细胞的生物学行为是否具有更明显的影响,值得探讨。
本研究real-time PCR与免疫组化的检测结果从mRNA与蛋白表达两个层面均显示ZIP14在HCC组织中存在明显的低表达。在此基础上,我们通过重组表达慢病毒的转染,成功构建了能稳定过表达ZIP14蛋白的HCC细胞株BEL7404-ZIP14。将该BEL7404-ZIP14设为OE组,转入空载体慢病毒的BEL-7404细胞株设为NC组,正常BEL-7404细胞株设为CON组,3组细胞共同进行后续实验。MTT 实验结果显示过表达ZIP14的细胞活力受到明显抑制,此外,ZIP14的过表达对BEL-7404细胞活力抑制的现象在含有外源锌的条件下表现得更为明显,表现为加入锌离子培养24 h后在高浓度锌离子刺激下OE组细胞的存活率相比NC组即出现明显的降低。选取MTT结果具明显改变的锌离子浓度用于后续实验,经细胞周期分析发现ZIP14过表达的细胞处于G2/M期的比例远高于NC组,该现象在锌离子的刺激下效果更具明显性,表明ZIP14的过表达可使HCC细胞被明显阻滞在G2/M期,从而阻止细胞进入下一个细胞周期的循环,进而发挥对BEL-7404细胞增殖的抑制作用(在外源锌离子的刺激抑制作用的基础上)。
ZIP14的过表达对HCC细胞迁移与侵袭的能力亦具有影响,我们的实验结果显示,BEL-7404细胞迁移与侵袭率随培养环境锌离子浓度的提高而呈现降低的趋势,而OE组迁移与侵袭的细胞数明显低于NC组,提示ZIP14的过表达可明显抑制BELE-7404细胞的迁移与侵袭能力,推测这与ZIP14的过表达有助于锌离子的转运,从而进一步促进细胞浆内锌的积聚,导致锌对HCC细胞的毒性作用增强有关。
综上所述,本课题组从mRNA与蛋白表达两个层面均验证了ZIP14在HCC组织中存在明显的低表达。而ZIP14的过表达有助于抑制HCC细胞的活力、迁移与侵袭能力,并使细胞周期被阻滞在G2/M期,且这种抑制作用随着外源性锌离子浓度的提高表现得更为明显;这种通过上调锌转运蛋白表达以促进细胞内锌的积聚,从而抑制HCC细胞生物学行为的方式,为HCC治疗新靶点的选择与相关研究的开展提供了新的视角。

