淹水胁迫对不同抗性甜玉米自交系幼苗生长及生理特性的影响
(华南农业大学农学院,广东省植物分子育种重点实验室,广州 510640)
甜玉米,作为普通栽培玉米的胚乳突变型亚种,果蔬兼用。由于富含各种氨基酸、维生素、膳食纤维等营养保健成分,随着经济发展和人类保健意识增强,人们对甜玉米的需求不断增加,世界甜玉米生产得到了飞速发展。然而随着全球气候变化日益加剧,涝渍灾害已经成为限制甜玉米生产的重要非生物逆境胁迫因素之一[1]。
关于涝渍胁迫对甜玉米影响的相关研究已有报道,僧姗姗等研究表明,淹水胁迫下,玉米品种的根干重明显下降,且随着淹水天数的增长,根干重降低的幅度增大,同时还发现玉米植株受淹水胁迫后从形态和生理上对淹水胁迫产生一定的适应性,如茎伸长生长,茎基部有不定根生成[2]。梁哲军等研究发现,淹水会导致玉米根系不定根的大量产生,光合色素总含量下降[3]。Blikhina等认为,在低氧条件或者再通氧环境下,植物组织细胞会形成过多的活性氧(ROS)[4]。
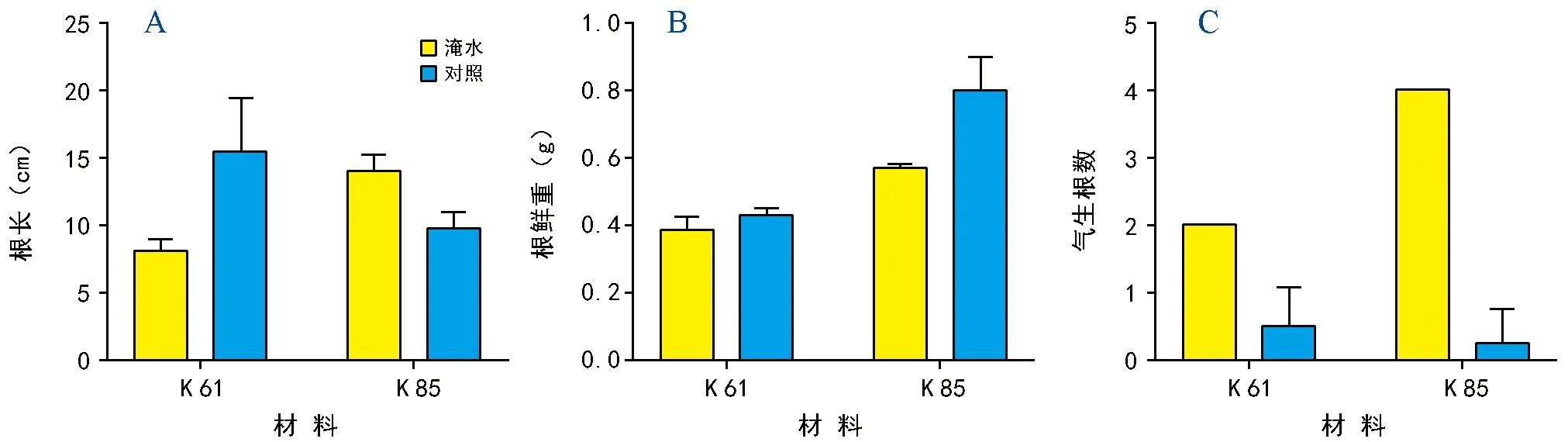
注:每个柱均表示均值±标准差。下同。图1 淹水胁迫对根长、根鲜重、气生根的影响
ROS能够改变细胞膜的特性,这会降低水分的转运进而造成渗透胁迫,同时也会过量产生过氧化物自由基,进一步引起脂质过氧化及光合作用能力的减弱。Colmer等研究发现,玉米植株体内存在着非酶体系抗氧化剂和保护酶体系来保护细胞免受ROS的伤害[5]。涂攀峰等对甜玉米幼苗进行淹水处理发现,淹水后叶片保护酶(SOD、POD)活性较对照升高,玉米不同基因型或同一基因型在不同生育时期的耐渍能力存在差异[6]。
当今对于玉米逆境的研究主要集中在普通玉米及逆境对叶片生长发育的影响,而逆境对甜玉米及其根系的生长发育影响的报道较少。因此,本研究主要以耐渍性存在明显差异的2个甜玉米自交系品种为材料,对涝渍前后甜玉米幼苗的表型和保护酶活性的变化进行研究,旨在探讨玉米耐渍性与表型及保护酶之间的关系,为耐渍性品种选育提供参考。
1 材料与方法
1.1 试验材料
供试材料选用不同耐渍性甜玉米自交系为K 61(敏感型)和K 85(耐渍型),由华南农业大学甜玉米杂种优势利用实验室提供。
1.2 试验方法
1.2.1生长环境与淹水处理
选取K 85与K 61的种子各15粒种植于长18.5 cm,宽13 cm,高8 cm的发芽盒内,每盒包含60目的石英砂2.5 kg,同时施以300 mL的无菌水。然后将其放入光照培养箱内。培养条件为:14 h与10 h昼夜循环,白天温度26 ℃,夜间22 ℃,光照强度为18 000 lx。试验重复3次,采用随机区组设计。在2叶1心期,保留6株生长一致的幼苗进行淹水处理,水面维持在石英砂上面2 cm。同时进行平行对照组试验。
1.2.2表型测定
在淹水胁迫6 d后,测量2个材料的苗高、根长、茎鲜重、根鲜重、气生根数,此外将茎和根分别置于牛皮纸袋中,于105 ℃下杀青2 h后于70 ℃下烘至恒重,用万分之一天平称量。
1.2.3超氧化物歧化酶(SOD)与过氧化物酶(POD)的测定
在淹水处理2,4 d和处理6 d后,分别取对照和处理样本的根系,准确称量后在液氮中研磨成粉末,按重量(g)∶体积(mL)=1∶4的比例,加入4倍体积的磷酸缓冲液(0.1 mol/L),迅速研磨成匀浆,匀浆离心15 min,取上清液待测。SOD与POD的测定根据相应的试剂盒说明进行(南京建成生物工程研究所),每项分析进行3次生物学重复。
1.2.4数据处理
采用GraphPadPrism 7软件和Excel 2010软件对表型数据进行基本的统计分析,包括均值(Mean)和标准差(SD)等相关性分析。
2 结果与分析
2.1 淹水胁迫下K 85与K 61根系的差异
根系对玉米的生长发育起着重要的作用,它是受淹水胁迫影响最直接的器官。如图1 A所示,淹水处理6 d后,K 61的根长短于对照组,而K 85的根长则长于对照组。表明淹水胁迫对K 61的根长具有显著的抑制作用。图1 B表明,淹水对甜玉米根鲜重影响较大,无论耐渍还是敏感材料。淹水能极显著的促进气生根的产生且K 85产生气生根数目较K 61更多(图1 C)。
2.2 淹水胁迫下K 85与K 61地上部分的差异
淹水处理6 d后,甜玉米自交系K 61与K 85的茎长较对照组略微下降(图2 A),表明茎长受淹水胁迫影响较小;对于茎鲜重而言,淹水胁迫下K 61较对照组茎鲜重表现为下降趋势,而K 85的茎鲜重在淹水处理下则表现出上升趋势(图2 B)。由图2可以发现,淹水胁迫会抑制甜玉米自交系茎长的增加,对K 61的茎鲜重也有抑制作用,对K 85的茎鲜重则无抑制作用。
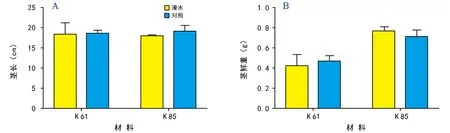
图2 淹水胁迫对茎长、茎鲜重的影响
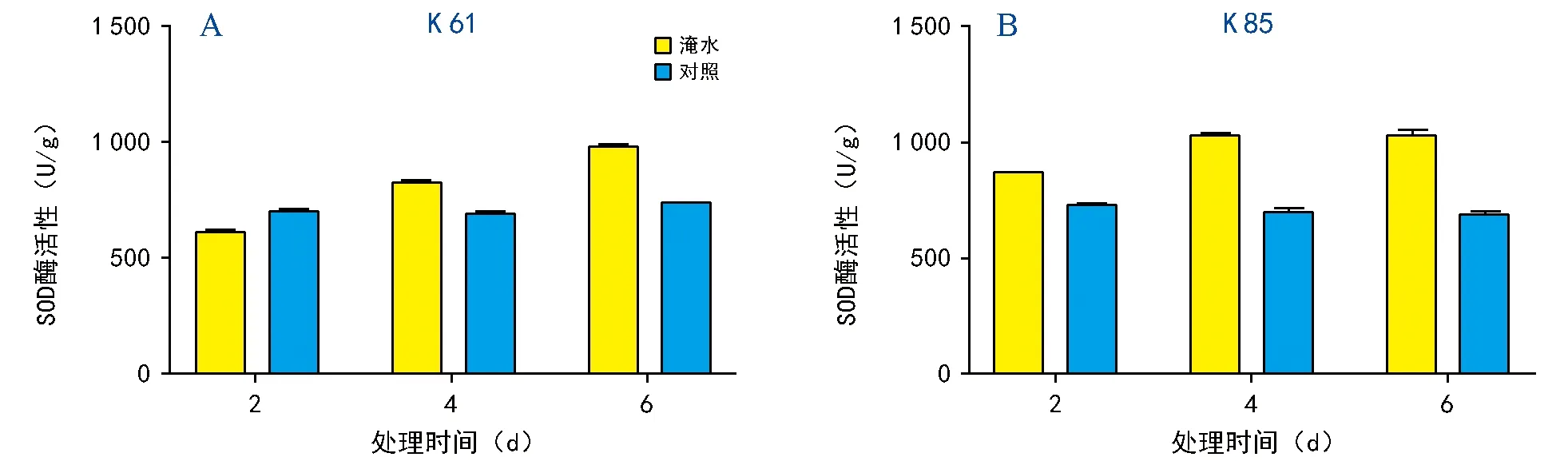
图3 淹水胁迫对根系SOD酶活性的影响

图4 淹水胁迫对根系POD酶活性的影响
2.3 淹水胁迫下K 85与K 61根系SOD活性的差异
为了分析K 85与K 61在淹水胁迫后根系的SOD酶活性的差异,分别测量了处理2、4 d和处理6 d后幼苗根系在淹水处理和正常条件下SOD酶活性(图3)。K 61在淹水处理2 d后SOD酶活性低于对照组;淹水4 d时,其SOD酶活性较对照组增加19.5%;淹水第6天,K 61的SOD酶活性比对照组增加33.29%。在K 85中,淹水2 d后,SOD酶活性较对照组增加15.9%;随后淹水处理4 d,SOD酶活性进一步增加,较对照组增加达47.1%;淹水处理第6天,K 85的SOD酶活性变化不明显。结果说明,K 61随淹水时间的增加会使根系SOD酶活性不断增加;K 85的SOD酶活性先随淹水时间的增加而增大,随后趋于稳定。
2.4 淹水胁迫下K 85与K 61根系POD活性的差异
如图4所示,K 61在淹水2 d后酶活性较对照组降低6.29%,且随淹水时间的增加,其POD酶活性变化不明显,表明淹水胁迫对K 61根系POD酶活性的抑制较小。K 85淹水2 d后其酶活性低于对照组,在淹水第4天其酶活性较淹水第2天明显上升,且高于对照组,淹水胁迫6 d后,POD酶活性与淹水第4天相似。结果表明,K 85根系POD酶活性在淹水胁迫下比K 61反应更敏感。
3 讨论与结论
植物淹水后其组织中有氧代谢功能会急剧下降。大部分情况下,植物缺氧会对植物根部造成直接影响,对地上部造成间接影响。在本研究中,涝渍处理6 d后涝敏感型的K 61根长显著下降,而耐渍较好的K 85根长显著增加;在淹水胁迫下,K 61和K 85的根鲜重均受到影响;K 61与K 85气生根数目在淹水处理后均较对照组数量更多,且耐渍材料K 85的气生根数比K 61增加更多。地上部分在淹水胁迫后,K 61的茎长受到的影响不大,茎鲜重则受到一定抑制;K 85的茎长略微下降而茎鲜重有所升高。
由于根系氧气含量的下降,植物有氧呼吸受阻,植物要生存必须维持一定的能量代谢水平,而无氧呼吸会产生大量的活性氧[7]。活性氧会破坏脂类、蛋白质、核酸等大分子物质,最终导致植株代谢混乱,甚至死亡[8]。在正常情况下,植物体内存在一套保护系统来清除多余的活性氧,以减轻对细胞膜的伤害。活性氧的清除系统也称为抗氧化系统,主要由抗氧化酶和抗氧化物质组成。当植物处于逆境时,植物可以通过提高抗氧酶的活性来提高活性氧的清除能力[9]。其中超氧化物歧化酶(SOD)和过氧化物酶(POD)是主要的抗氧化酶。本研究中,淹水胁迫使自交系K 61和K 85的SOD酶活性升高,表明淹水胁迫提高了SOD酶性的活性,但2个自交系存在明显差异,这与僧珊珊等[10]的研究结果相近;K 61的SOD酶活性在淹水处理第2天时低于对照组,在淹水处理第4天和第6天SOD酶活性则高于对照组,且随着处理时间的增加SOD酶活性呈上升趋势;K 85淹水处理后酶活性一直高于对照组,且随胁迫时间的增加其酶活性先上升后趋于稳定。表明两者在淹水胁迫下抵御活性氧毒害能力有较大差异。对于过氧化物酶POD而言在本试验中发现,在淹水胁迫下K 61的POD酶活性随淹水时间的增加均受到一定抑制,而K 85则在淹水胁迫4 d后表现出酶活性增加,表明两自交系在淹水胁迫下POD酶活性也存在差异。姜华武等[11]研究认为,在淹水胁迫下自交系的POD酶活性均受抑制,但不同耐渍性品种根系中POD酶活性受抑制程度不同;但姜华武等研究表明,耐渍材料在受淹水胁迫后POD酶活性会有所上升而敏感材料则表现为酶活性下降[11],与本研究结果相似。

