胃幽门螺杆菌感染后Semaphorin 5A致胃癌可能机制的研究
刘涛 李睿 龚琳 李庚 潘国庆★
胃癌是当今世界范围内最常见的恶性肿瘤之一,全球每年约有70 万人因胃癌死亡,5年生存率不良,其在全球恶性肿瘤中发病率位于男性第四位和女性第五位,死亡率居于男性第三位和女性第五位,严重地危害着人类的健康[1]。有研究发现神经导向分子5A(semaphorin 5A,sema5a)于胃癌中高表达且参与胃癌的形成和转移[2-3],其在肠型胃癌中表达强阳性率为73.4%,而肠型胃癌与幽门螺杆菌(helicobacter pylori,Hp)感染密切相关,提示sema5a基因的表达可能与Hp 感染相关[4-5]。Hp感染被认为是胃癌发病最重要的高危因素[1,6],但其通过何种途径刺激相关基因表达而导致胃癌发生的机制至今不明确。本文通过检测sema5a在人胃癌组织及Hp 感染后胃癌细胞株中的表达情况,以探讨sema5a与Hp 感染间的关系及Hp 感染后sema5a致胃癌的可能机制。
1 材料与方法
1.1 主要实验材料与试剂
SGC7901 胃癌细胞株购自上海柯雷生物科技有限公司,幽门螺杆菌26695 菌株购自美国ATCC公司,RPMI1640 培养基购自美国Hyclone 公司,胎牛血清购自杭州四季青生物工程材料有限公司,AnaeroPack 微需氧产气袋及培养罐购自日本三菱气体公司,抗GADPH 抗体购自美国Sigma Aldrich公司,抗MMP9 抗体购自美国Cell Signaling Technology 公司,抗sema5a 抗体购自美国R&D system公司,PVDF 膜、ECL 超敏发光液购自德国Merck公司,24 孔transwell 购自美国costar 公司,基质胶购自美国BD 公司。电泳仪购自美国Bio-Rad 公司,转膜仪购自北京六一生物科技有限公司,数码凝胶显像设备购自上海天能科技有限公司。
1.2 人胃癌组织样品
收集本院2016年1月至2017年12月术后病理诊断为胃腺癌的胃癌标本50 例。所有患者术前未接受化疗或放疗。胃癌及癌旁组织均来源于术后10%甲醛固定24 h 以内标本,取材后常规固定脱水,石蜡包埋保存待作免疫组织化学检测。
1.3 细胞及细菌共培养
人胃中高分化腺癌细胞株SGC7901 使用添加10%无菌胎牛血清、1%链青霉素双抗的RPMI1640培养基置于培养瓶中于37℃,5%二氧化碳浓度培养箱内培养,培养2~3 天后传代。Hp26695 菌株种植于含5%无菌脱纤维羊血的经过高压灭菌哥伦比亚琼脂培养基,于微需氧培养罐使用微需氧产气袋置于37℃培养箱培养。培养基经高压灭菌后自然冷却至50 度时添加脱纤维羊血及多粘菌素B(250 U/L),万古霉素(6 mg/L),两性霉素(2 mg/L),TMP(5 mg/L),混匀后浇板。将长成菌落的Hp 悬浮于含3%胎牛血清的1640 培养基中,测定OD660,1 OD660=1×108菌落形成单位(CFU)。按胃癌细胞于Hp 菌落之比为1∶50 共培养0 h、12 h、24 h,另按1∶0、1∶50、1∶100 共培养12 h,PBS 清洗5 次,收集细胞提取蛋白。
1.4 免疫组织化学法检测人胃癌组织中sema5a的表达情况
将组织块切成3 μm 的切片,常规脱蜡至水。以EDTA 为抗原修复剂高压抗原修复。用3%浓度的双氧水封闭10 min,在磷酸盐中洗3 次,每次3 min。添加一抗前PBS 清洗3 遍,每遍3 min。去除多余的PBS,在室温下用抗sema5a 单抗(R&D system)孵育2 h。在PBS 中洗3 次每次3 min 后,用辣根过氧化物酶标记的二抗室温孵育1 h。继续在PBS 中冲洗3 次每次3 min,加入DAB 染液至显色后清水冲洗。常规脱水、透明。苏木精复染后中性树胶封片。Image J 测量平均光密度值。
1.5 免疫印迹检测SGC7901 细胞株中sema5a 及基质金属蛋白酶9 表达情况
使用RIPA 裂解液将待测蛋白调整至相同浓度待用。将等量蛋白加入到10%浓度SDS-PAGE胶上样孔中。电泳2 h 后半干转移法恒流转移1 h后将凝胶上的蛋白转移至PVDF 膜上。用含5%BSA 的TBST 室温封闭1.5 h 后按照分子量剪下膜与抗sema5a,基质金属蛋白酶9(matrix metalloproteinase-9,MMP9)及GADPH 抗体进行孵育,4℃过夜。一抗孵育结束后TBST 洗3 次,每次10 min。接着在室温下与辣根过氧化物酶标记的二抗孵育1 h,孵育结束后TBST 洗3 次每次10 min。去掉多余的TBST 后在膜上滴加ECL 发光液发光,于数码凝胶分析系统采集曝光数据,Image J 图形处理软件分析目标条带。
1.6 细胞侵袭实验
将共培养的SGC7901 细胞用PBS 洗5 遍后待用。按1∶8 比例用无血清Ham's RPMI1640 培养基稀释基质胶,混匀后吸取100 μL 添加到Transwell 小室中,37℃温箱成胶1 h 后取出,于下室添加500 μL 含10%胎牛血清的RPMI1640 培养基,上室加入无血清RPMI1640 培养基重悬的SGC7901 细胞,放入37℃培养箱内。36 h 后取出。无菌棉签拭去小室上层的细胞,2%多聚甲醛固定小室下层5 min。PBS 清洗后苏木素染色5 min,再次PBS 清洗。高倍镜下随机选取5 个视野拍照,Image J 软件计数后取平均值。
1.7 统计学分析
所有结果均以均值±标准差表示。用SPSS 21.0 软件进行数据处理,使用两独立样本t检验评价Hp 阴性及阳性标本间差异。免疫印迹(Western blotting,WB)及侵袭实验结果使用单因素ANOVA方差分析,P<0.05 被认为具有统计学意义。
2 结果
2.1 胃癌组织中Hp 的感染与sema5a 表达有关
50 例胃癌组织蜡块的免疫组化及Giemsa 染色结果显示,Hp 感染阳性率为54.9%(28/50)。图1B、C 所示,胃癌组织中sema5a 于Hp 感染阳性患者的癌细胞细胞质及细胞膜上呈阳性表达;而Hp感染阴性患者的胃癌组织中sema5a 表达要明显低于感染阳性样本。如表1所示,Hp 感染阳性胃癌组织中sema5a 的平均光密度为(0.80±0.11),明显高于Hp 阴性胃癌组织中的(0.43±0.07),差异有统计学意义(P<0.001)。
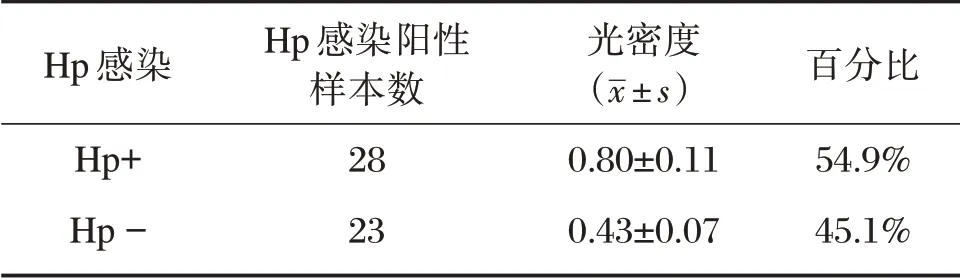
表1 Hp 感染情况及sema5a 表达平均光密度Table 1 Hp infection and AO of sema5a
2.2 Hp 感染对胃癌细胞株SGC7901 中sema5a 及MMP9 蛋白表达的影响
结果如图2所示,随着Hp 感染时间的增加,sema5a 及MMP9 的表达具有不同的上升幅度(P<0.001)。与此同时,当Hp 共培养浓度增加时,sema5a 及MMP9 的表达同样也得到了促进。
2.3 Hp 感染对SGC7901 侵袭能力的影响
SGC7901 与Hp 以不同比例共培养12 h 后结果如图3所示。随着Hp 浓度的增加,侵袭过小室的SGC7901 细胞数量也得到了逐步提高;以1∶50和1∶100 比例共培养的SGC7901 侵袭性细胞数分别是1∶0 共培养SGC7901 细胞的2.18 倍和3.13倍,差异有统计学意义(P<0.001)。
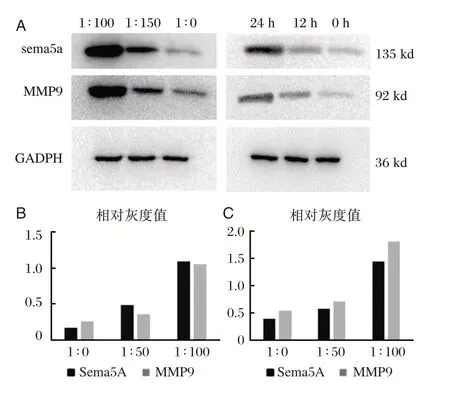
图2 sema5a、MMP9 在胃癌细胞株SGC7901 中的表达Figure 2 Expression of sema5a and MMP9 in gastric cancer cell line SGC7901
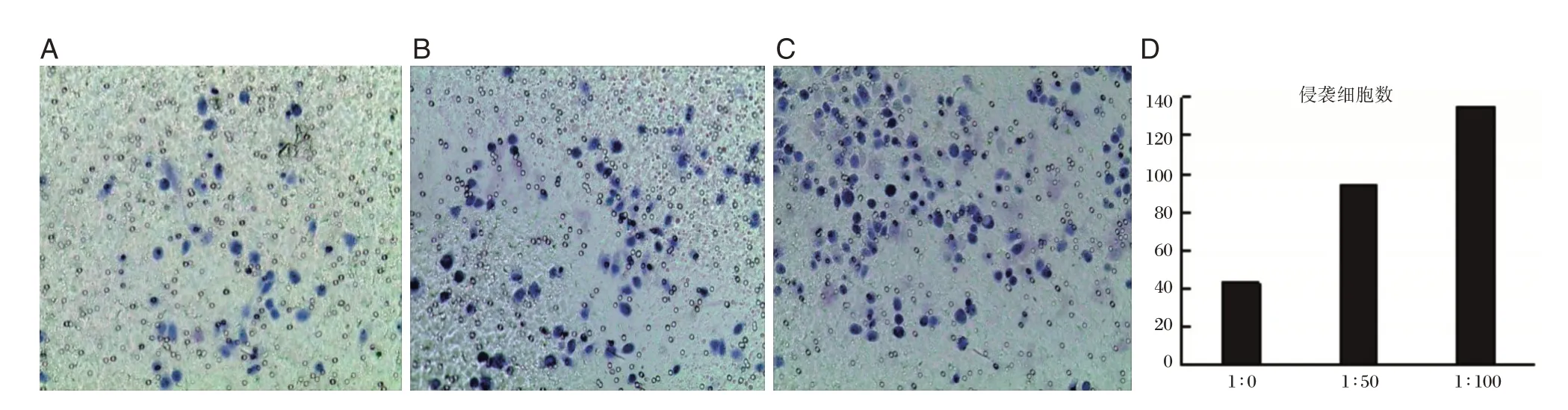
图3 与Hp 共培养后SGC7901 侵袭能力(苏木素染色,500×)Figure 3 Invasive ability of SGC7901 after incubate with Hp(hematoxylin staining,500×)
3 讨论
根据全球癌症状况最新数据显示,胃癌仍是目前严重威胁人类健康的疾病之一,5年生存率低于30%[7],但其发病机制尚不完全明确。已有研究表明Hp 感染与胃癌发生、发展密切相关[8],其感染阳性的胃癌组织中存在某些相关蛋白的表达上调,被认为与Hp 共同促进胃癌的发生、发展,影响预后相关[9-10]。本研究通过检测50 例确诊为胃癌的阳性标本中sema5a 的表达情况、sema5a 和MMP9 蛋白在Hp 感染后的胃癌细胞株中表达情况及Hp 感染对胃癌细胞株SGC7901 侵袭能力的影响,旨在阐明sema5a与Hp 感染间的关系及Hp感染后sema5a致胃癌的可能机制,为探索胃癌的发病机制提供新线索。
胃癌的发生、发展与多因素相关[11]。sema5a属于Semaphorins 家族,一种广泛表达的分泌和膜相关蛋白,最初的研究认为该蛋白参与中枢神经系统发生,被定义为轴突导向因子,参与神经系统的生长发育[12]。近年来有研究表明Semaphorins分子参与细胞迁移和肿瘤生长,且在多种肿瘤组织中表达,参与肿瘤的发生与形成并调控其进程[13]。本研究中sema5a 在胃癌组织表达结果显示其在Hp 感染阳性的胃癌组织中呈阳性表达明显高于Hp 阴性的胃癌组织中,结果与同类研究结果一致[14],表明sema5a 蛋白的高表达可能与胃癌的发生、发展相关。同时,本研究对Hp 感染的胃癌细胞株SGC7901 中检测结果显示sema5a 和MMP9 蛋白随着Hp 感染时间的增加,其表达均有不同程度的上升与Pan 等[15]的研究结果一致,推测sema5a 在胃癌组织中的高表达与胃癌的侵袭、转移呈正相关。此外,有研究表明sema5a 可通过plexin-B3 受体及PI3K/AKT 通路激活MMP9 的表达从而增强肿瘤细胞的转移及侵袭能力[16]。MMP9 可通过破坏基膜使肿瘤细胞能够更轻易的穿过组织而进一步达到促进肿瘤侵袭转移的作用[17],在本研究结果中MMP9 蛋白随着Hp 感染时间的增加表达上调,或许与该蛋白的肿瘤侵袭转移作用相关。然而MMP9 表达的上调是因Hp 感染引起还是由上调的sema5a 引起,进而激活相关信号通路,增强胃癌细胞的侵袭及迁移能力,目前尚未明确,需要进一步完善实验来证明。癌细胞的侵袭和转移是胃癌死亡率居高不下、难以根治的重要原因,因此,本研究还对Hp感染后的胃癌细胞SGC7901 侵袭能力进行了观察,结果显示胃癌细胞侵袭能力随着Hp 浓度的增加而增强,该结果与吕汪霞等[18]的研究结论一致。而李一鑫等[19]对118 例胃癌样本研究结果显示局部癌组织中Hp 的感染量和患者的中位生存时间以及预后呈负相关,这项研究结果恰恰支持了本研究关于Hp 感染导致胃癌细胞侵袭度增加的结论。
胃癌的发生是多基因、多因素引起的复杂的病理过程,其发生伴随着许多相关基因和蛋白水平的改变,其中部分基因能够促进胃癌的形成和发展或者促进肿瘤细胞的增殖、生长和转移[20],但至今对胃癌转移的具体作用机制尚未彻底阐明。因此,本研究通过对Hp 感染与sema5a之间的关系进行研究从而探索二者在胃癌发生发展过程中的可能联系和机制。目前,已陆续有研究证实sema5a与胃癌的相关性[14-15],相信随着研究的不断深入,sema5a可能成为Hp 相关性胃癌的早期诊断标记物,为Hp 相关性胃癌的治疗和诊断提供理论依据。

