AChE在小鼠皮肤切创愈合过程中的时序性表达及分布
赵建新 ,金馨 ,黄俊杰 ,姚艺 ,喻林升 ,范琰琰
(1.温州医科大学法医学系,浙江 温州 325035;2.温州医科大学司法鉴定中心,浙江 温州 325035;3.温州医科大学司法鉴定科学技术研究所,浙江 温州 325035)
胆碱能系统主要由4部分构成:乙酰胆碱(acetylcholine,ACh);烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor,nAChR)和毒蕈碱型乙酰胆碱受体(muscarinic acetylcholine receptor,mAChR);胆碱乙酰转移酶(choline acetyltransferase,ChAT);乙酰胆碱酯酶(acetylcholinesterase,AChE)[1]。胆碱能系统最初被认为存在于神经系统和神经肌肉接头,ACh可以作为一种经典的神经递质介导神经信号的传递。然而,近年来发现,胆碱能系统普遍存在于非神经元型细胞和皮肤组织,ACh可以通过自分泌、旁分泌或内分泌方式调节非神经元型细胞的活动,发挥广泛的生物学效应[1]。研究结果[2-3]表明,巨噬细胞(Mφ)表达α7烟碱型乙酰胆碱受体(α7nAChR),ACh作用于α7nAChR抑制了Mφ释放促炎性细胞因子,这种抗炎效应被称为“胆碱能抗炎通路”。在皮肤创口愈合期间,ACh及其受体密切参与炎症反应、肌成纤维细胞分化及纤维性修复的调节[1,4-8]。
研究[9-11]发现,胆碱能系统中的AChE广泛存在于单核巨噬细胞、淋巴细胞、树突细胞、造血细胞、成骨细胞、内皮细胞、成纤维细胞及星形胶质细胞等非神经元型细胞。AChE可以水解ACh,使ACh失去抗炎作用。AChE抑制剂毒扁豆碱显著提升了ACh的抗炎作用,抑制Mφ释放促炎性细胞因子[12]。而microRNA-132也可通过抑制AChE mRNA的翻译间接促进ACh的抗炎作用[9,12-13]。此外,AChE与成纤维细胞的迁移密切相关[10]。上述研究结果提示,AChE可能参与创口愈合的炎症反应和纤维性修复进程。故本研究拟检测AChE在皮肤创口愈合期间的时序性表达和分布特征,旨在探讨AChE在创口愈合过程中的作用及其作为创口形成时间推断参考指标的可行性。
1 材料与方法
1.1 小鼠切创模型制作及分组
成年雄性小鼠(C57BL/KsJ)45只,8~10周龄,体质量25~30 g,被随机分为8个切创组和1个对照组,每组5只。切创组小鼠使用2.5%水合氯醛溶液腹腔注射(0.012 mL/g)麻醉后,在背部剃毛,乙醇消毒,使用手术刀片在小鼠背部皮肤正中切割一条长1.0 cm的全层纵向切口。待小鼠复苏后分笼饲养,注意保持创口干燥,避免感染。切创组分别于伤后6h、12h、1d、3d、5d、7d、10d、14d过量麻醉处死小鼠,取创口及周围2.0cm×1.5cm大小的皮肤标本。将皮肤标本均等分为两份,一份用于制作石蜡切片进行免疫组织化学染色;另一份中一部分用于提取蛋白进行Western印迹法检测,剩余的置于-80℃冰箱备用。对照组小鼠不进行创口切割,过量麻醉处死后,取相同部位同等大小的皮肤标本进行检测。
本实验经温州医科大学伦理委员会审核通过,符合《实验动物 福利伦理审查指南》要求。
1.2 免疫组织化学染色
将小鼠皮肤样本放入由磷酸盐缓冲液(phosphate buffered saline,PBS)配制的4%多聚甲醛溶液中进行固定,固定后进行冲水、脱水、透明、浸蜡及包埋,用石蜡切片机制成5μm厚的连续切片[切片使用3-氨丙基-乙氧基甲硅烷(3-amino propyl-triethoxy silane,APES)进行防脱处理]。切片烘干、二甲苯脱蜡、梯度乙醇脱苯、水化,置于3%过氧化氢溶液中室温孵育10 min灭活内源性过氧化物酶。切片经抗原修复、室温冷却后,使用牛血清白蛋白(bovine serum albumin,BSA)室温封闭2 h,滴加兔抗AChE多克隆抗体(1∶500,美国Thermo Fisher Scientific公司),保湿盒中4℃孵育12h,PBS洗涤3次,滴加辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔 IgG(北京中杉金桥生物技术有限公司)室温孵育20min。PBS洗涤3次,使用二氨基联苯胺(diaminobenzidine,DAB)试剂盒进行显色,苏木素复染细胞核。另使用PBS代替一抗作为阴性对照,未见假阳性染色。毗邻切片常规进行苏木素-伊红(hematoxylin-eosin,HE)染色,观察创口的组织学形态。
显微镜下在创口及其周边区随机选择10个高倍视野(×400),计数AChE阳性细胞数和总细胞数,包括多形核白细胞(polymorphonuclear leukocyte,PMN)、单个核细胞(mononuclear cell,MNC)及成纤维样细胞(fibroblastic cell,FBC)。统计平均每个视野PMN、MNC和FBC总的阳性细胞数和阳性细胞率(阳性细胞率=阳性细胞数/总细胞数)。
1.3 双重免疫荧光染色
为了鉴定AChE是否被Mφ和肌成纤维细胞(myofibroblast,MyFb)表达,对切片进行双重免疫荧光染色。切片脱蜡、水化、抗原修复后,BSA室温封闭2h。滴加兔抗AChE多克隆抗体(1∶200,美国Thermo Fisher Scientific公司)和鸡抗F4/80多克隆抗体(1∶100,英国Abcam公司)在保湿盒中4℃孵育12h,或滴加兔抗AChE多克隆抗体(1∶200)和羊抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)多克隆抗体(1∶100,英国Abcam公司)在保湿盒中4℃孵育12h。PBS洗涤3次。滴加Alexa Fluor 555标记的驴抗兔IgG(1∶200,美国Thermo Fisher Scientific公司)及Alexa Fluor 488标记的驴抗鸡IgG(1∶100,美国Jackson ImmunoResearch公司)室温下孵育1 h,或Alexa Fluor 555标记的驴抗兔IgG(1∶200)及Alexa Fluor 488标记的驴抗羊IgG(1∶200,美国Thermo Fisher Scientific公司)室温下孵育1h。PBS洗涤3次,用Hoechst 33258复染细胞核,用PBS配制的50%甘油封片。以PBS代替一抗作为阴性对照。
正置荧光显微镜下在创口及其周边区随机选择10个高倍视野(×400)进行观察、拍照和分析。统计F4/80阳性细胞(Mφ)、F4/80和AChE双阳性细胞、α-SMA阳性细胞(MyFb)、α-SMA和AChE双阳性细胞在每个视野的平均数量,计算AChE在Mφ和MyFb中的阳性率。
1.4 蛋白制备及Western印迹法检测
冰上使用洁净灭菌的小剪刀将皮肤样本剪碎,加入含有蛋白酶抑制剂的细胞裂解液(sc-24948,美国Santa Cruz Biotechnology公司),组织匀浆,4℃下以12000×g离心10min,离心3次,取上清液,二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,将所有样本配制成相同浓度。加入5×蛋白上样缓冲液,100℃蛋白变性10min。上样总蛋白量为30μg,在分离胶浓度为12%的十二烷基硫酸钠-聚丙烯酰胺凝胶中电泳分离(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),之后将蛋白转印到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜(美国Millipore公司)上。用含有聚山梨酯的三羟甲基氨基甲烷缓冲盐-吐温20(tris buffered saline with tween-20,TBST)洗涤3次,完成后,5%脱脂牛奶室温封闭2 h,兔抗 AChE 多克隆抗体(1∶1 000,美国 Thermo Fisher Scientific公司)4℃孵育12h。TBST洗涤3次,用HRP标记的山羊抗兔IgG(1∶10 000,英国Biorbyt公司)室温孵育2 h。TBST洗涤3次,增强化学发光(enhanced chemiluminescence,ECL)法发光。用Scion Image图像分析软件测定各条带的光密度值,以βactin作为内参,计算AChE蛋白表达的相对水平(AChE与β-actin光密度的比值)。
1.5 数据处理
数据采用±s表示,使用SPSS 19.0软件进行统计学分析。采用单因素方差分析进行组间比较,检验水准α=0.05。
2 结 果
2.1 免疫组织化学染色结果
在未损伤的对照组皮肤,AChE弱表达于表皮、毛囊、皮脂腺、血管内皮、真皮中固有细胞及皮下肌层。伤后6h,少量浸润的PMN表达AChE;伤后12h,创口区域见较多的PMN和少量的MNC表达AChE;伤后1~3d,大量浸润的MNC呈现AChE的阳性染色;伤后5~14d,创口区域的AChE阳性细胞以FBC为主,另可见MNC、新生血管的内皮细胞及再生的表皮表达AChE。结果见图1。
和对照组相比,AChE在各切创组总的阳性细胞数和阳性细胞率均增加,于伤后6 h开始增多,伤后1d达到峰值(表1)。
2.2 双重免疫荧光染色结果
在对照组皮肤,真皮内见少量细胞呈现AChE和F4/80(Mφ标记物)的阳性染色,表明真皮内固有的Mφ表达AChE。在各切创组中,大部分AChE阳性的MNC表达F4/80。伤后1 d,大量AChE阳性的Mφ聚集在创口区域(图2),随着损伤时间的延长,创口内表达AChE的Mφ逐渐减少。
和对照组相比,各切创组AChE阳性Mφ数及AChE在Mφ中的阳性率于伤后6h开始增多,于伤后1d达到峰值(表2)。
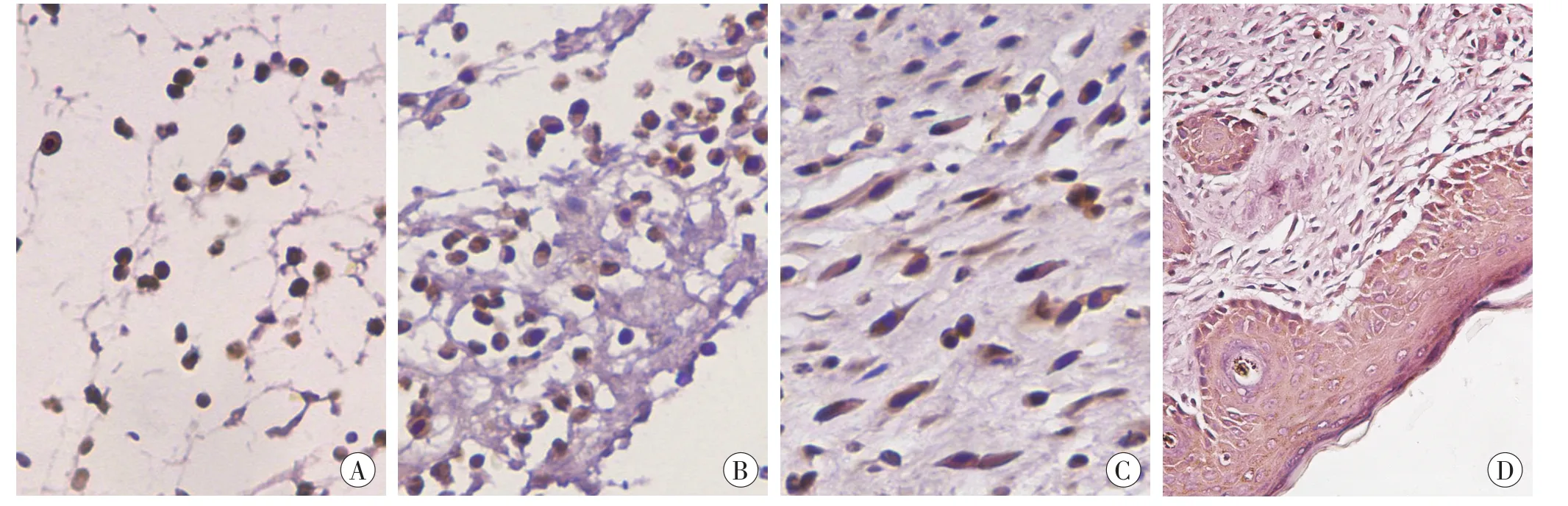
图1 小鼠皮肤创口愈合过程中AChE的免疫组织化学染色结果(×400)
表1 各组小鼠AChE总阳性细胞数和阳性细胞率(n=5,±s)
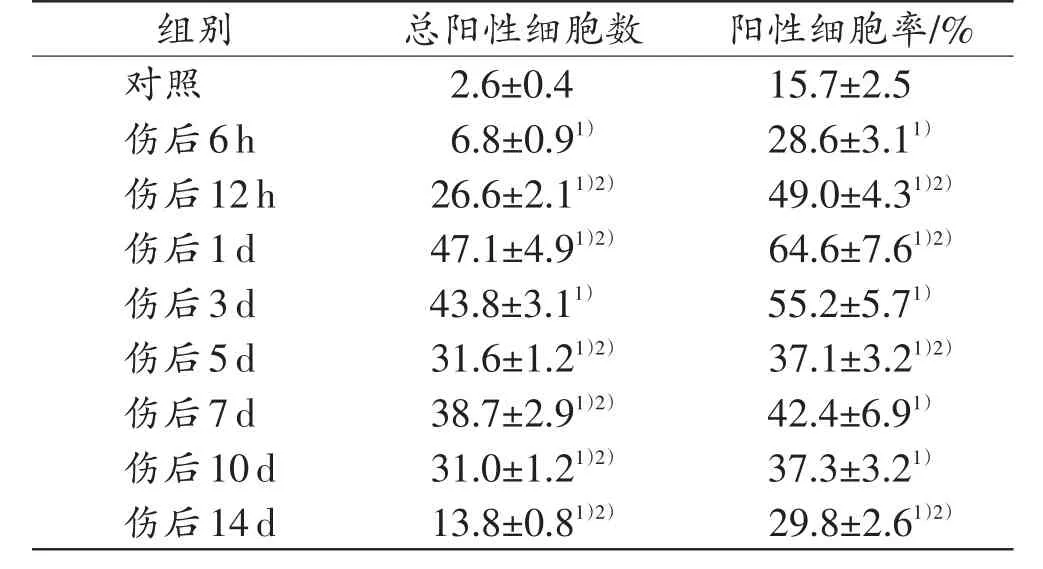
表1 各组小鼠AChE总阳性细胞数和阳性细胞率(n=5,±s)
注:1)与对照组比较,P<0.05;2)与相邻上组比较,P<0.05
组别对照伤后6h伤后12h伤后1d伤后3d伤后5d伤后7d伤后10d伤后14d总阳性细胞数2.6±0.4 6.8±0.91)26.6±2.11)2)47.1±4.91)2)43.8±3.11)31.6±1.21)2)38.7±2.91)2)31.0±1.21)2)13.8±0.81)2)阳性细胞率/%15.7±2.5 28.6±3.11)49.0±4.31)2)64.6±7.61)2)55.2±5.71)37.1±3.21)2)42.4±6.91)37.3±3.21)29.8±2.61)2)
表2 各组小鼠AChE阳性Mφ数及Mφ阳性率(n=5,±s)
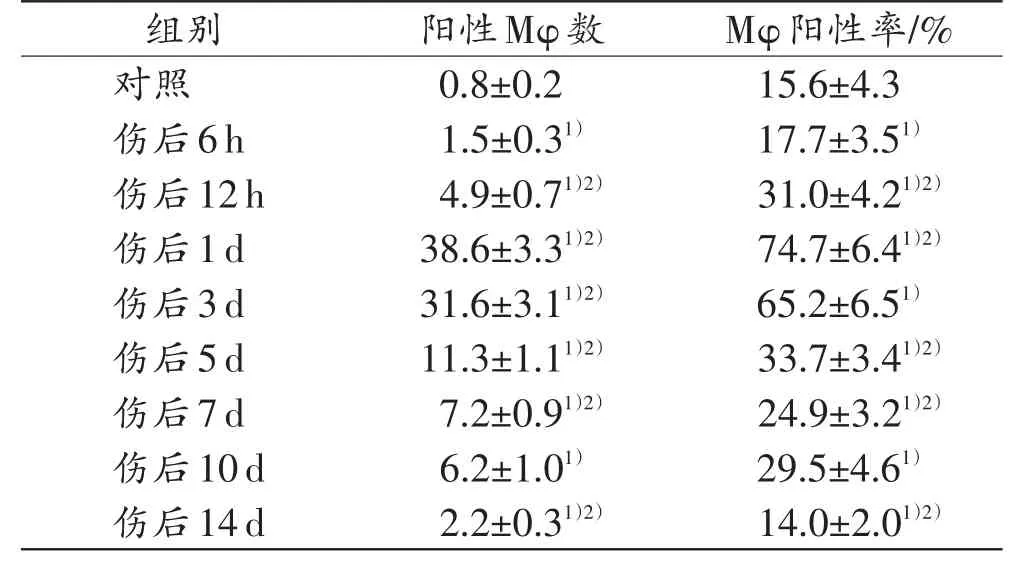
表2 各组小鼠AChE阳性Mφ数及Mφ阳性率(n=5,±s)
注:1)与对照组比较,P<0.05;2)与相邻上组比较,P<0.05
组别对照伤后6h伤后12h伤后1d伤后3d伤后5d伤后7d伤后10d伤后14d阳性Mφ数0.8±0.2 1.5±0.31)4.9±0.71)2)38.6±3.31)2)31.6±3.11)2)11.3±1.11)2)7.2±0.91)2)6.2±1.01)2.2±0.31)2)Mφ阳性率/%15.6±4.3 17.7±3.51)31.0±4.21)2)74.7±6.41)2)65.2±6.51)33.7±3.41)2)24.9±3.21)2)29.5±4.61)14.0±2.01)2)
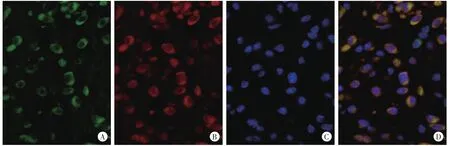
图2 伤后1d小鼠皮肤创口F4/80和AChE的免疫荧光染色结果(×400)
在对照组皮肤,α-SMA(MyFb标记物)阳性染色出现在真皮内血管壁的平滑肌,未见表达α-SMA的FBC。在各切创组中,大部分AChE阳性的FBC表达α-SMA,表明AChE表达于MyFb。AChE阳性的MyFb于伤后3d开始出现在创口区域,于伤后7d达到峰值(图3),此后逐渐减少。结果见表3。
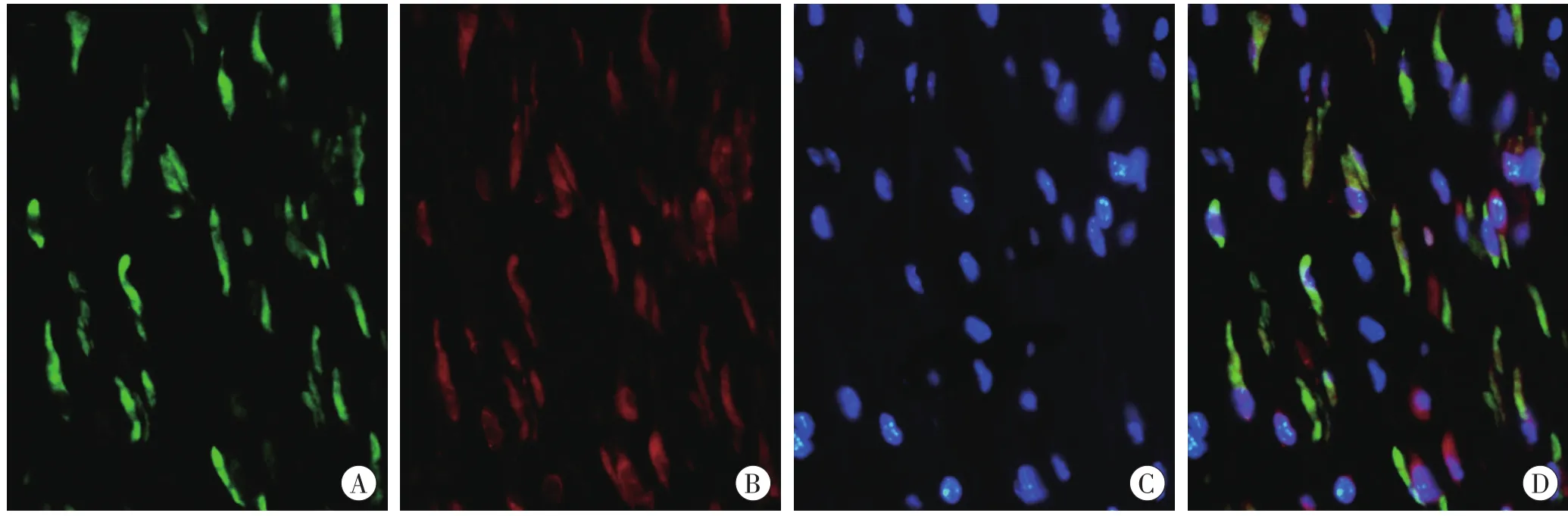
图3 伤后7d小鼠皮肤创口α-SMA和AChE的免疫荧光染色结果(×400)
表3 各组小鼠AChE阳性MyFb数及MyFb阳性率(n=5,±s)
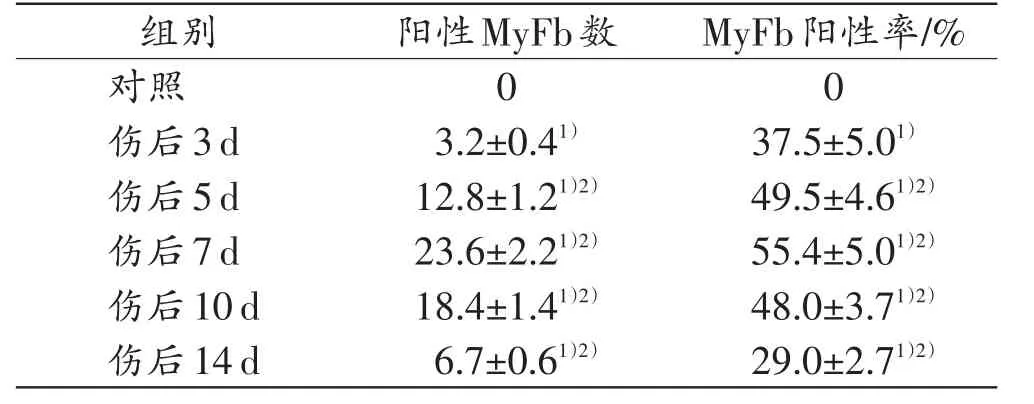
表3 各组小鼠AChE阳性MyFb数及MyFb阳性率(n=5,±s)
注:1)与对照组比较,P<0.05;2)与相邻上组比较,P<0.05
MyFb阳性率/%0 37.5±5.01)49.5±4.61)2)55.4±5.01)2)48.0±3.71)2)29.0±2.71)2)组别对照伤后3d伤后5d伤后7d伤后10d伤后14d阳性MyFb数0 3.2±0.41)12.8±1.21)2)23.6±2.21)2)18.4±1.41)2)6.7±0.61)2)
2.3 Western印迹法检测结果
在对照组和各切创组均可见AChE的表达条带,相对分子质量为68000(图4)。创口形成后AChE表达水平呈现一定的时序性变化(表4)。和对照组相比,AChE在各切创组的表达水平均增高,于伤后1 d达峰值,此后下降,于伤后7d达到第2个峰值。伤后6h、1d、3d、7d、10d AChE的表达水平与相邻上组比较,差异均有统计学意义(P<0.05)。
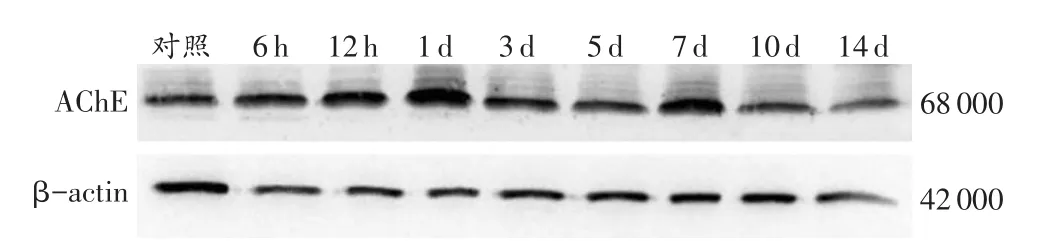
表4 各组小鼠皮肤创口AChE蛋白的相对表达量(n=5,±s)
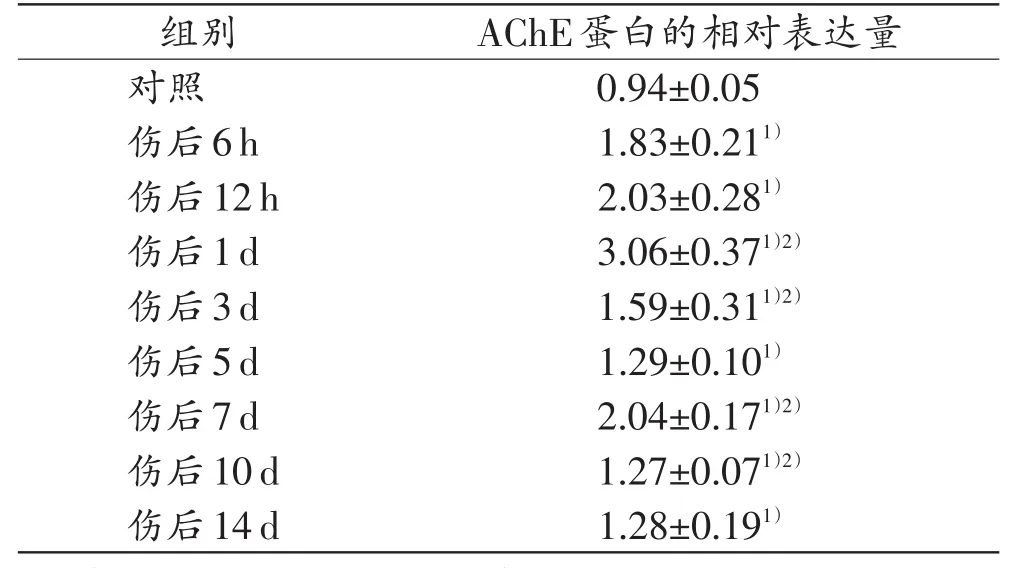
表4 各组小鼠皮肤创口AChE蛋白的相对表达量(n=5,±s)
注:1)与对照组比较,P<0.05;2)与相邻上组比较,P<0.05
AChE蛋白的相对表达量0.94±0.05 1.83±0.211)2.03±0.281)3.06±0.371)2)1.59±0.311)2)1.29±0.101)2.04±0.171)2)1.27±0.071)2)1.28±0.191)组别对照伤后6h伤后12h伤后1d伤后3d伤后5d伤后7d伤后10d伤后14d
3 讨 论
皮肤创口愈合过程可分为炎症期、增殖期和组织再塑期,需要不同类型细胞分泌多种细胞因子及生物活性分子,精细地相互作用,协同完成修复[14]。炎症反应、成纤维细胞增殖和迁移、血管形成及表皮再生是创口修复过程中必不可少的事件。本研究发现,皮肤创口愈合期间,AChE广泛表达于PMN、Mφ、MyFb、新生血管内皮及再生的表皮,提示AChE可能深度参与皮肤创口愈合的调节。
胆碱能系统包含ACh、乙酰胆碱受体、ChAT和AChE。近年来研究证实,胆碱能系统不仅存在于神经系统,也存在于非神经元型细胞和组织[1]。炎症细胞拥有完整的胆碱能系统,可以自身合成ACh[15]。ACh作用于Mφ的α7nAChR可抑制促炎性细胞因子的释放,而AChE可以通过水解ACh终止其作用[2-3,12]。前期研究结果[16]显示,在骨骼肌挫伤后浸润的Mφ表达α7nAChR,提示胆碱能系统可能参与伤后炎症反应的调节。此外,ACh可以调控皮肤创口修复[4-7]。在皮肤创口愈合期间,α7nAChR被证实表达于创口内的Mφ和MyFb[8]。本研究与前期研究结果一致,表明皮肤创口区域的Mφ和MyFb也表达AChE,提示AChE可能参与皮肤创口愈合期间炎症反应和纤维性修复的调节。
在法医学领域,经常使用组织病理学方法及免疫组织化学染色技术推断创口形成时间,较多生物学指标的免疫组织化学染色结果为损伤时间推断提供了有价值的参考依据[14,17]。然而,一些学者认为免疫组织化学染色阳性结果的分析易受主观因素的影响,不能完全保证其精确性[18]。因此,近年来Western印迹法被应用于损伤时间推断[16,18-19]。本研究的免疫组织化学染色结果显示,AChE表达于PMN、MNC及FBC,在各切创组总的阳性细胞数和阳性细胞率均高于对照组,于伤后6h开始增多,伤后1d达到峰值;伤后1~10 d创口总阳性细胞数大于30,伤后1~3 d总阳性细胞数大于40,伤后1d总阳性细胞数大于45;伤后1~3d创口的总阳性细胞率大于50%,伤后1d总阳性细胞率大于60%。AChE和F4/80双重免疫荧光染色结果显示,AChE阳性Mφ数及AChE在Mφ中的阳性率于伤后1 d达到峰值;伤后1~5 d阳性Mφ数大于10,伤后1~3 d阳性Mφ数大于30,伤后1 d阳性Mφ数大于35;伤后1~3 d Mφ阳性率大于60%,伤后1 d Mφ阳性率大于70%。AChE和α-SMA双重免疫荧光染色结果显示,AChE阳性的MyFb于伤后3d开始出现在创口区域,于伤后7 d达到峰值;伤后5~10 d阳性MyFb数大于10,伤后7~10d阳性MyFb数大于15,伤后7d阳性MyFb数大于20;伤后5~10d MyFb阳性率大于45%,伤后7 d MyFb阳性率大于55%。本研究免疫组织化学染色和双重免疫荧光染色结果表明,AChE在皮肤创口愈合期间的表达具有一定的时间规律性,AChE在Mφ和MyFb中的表达高峰可为早期创口及修复期创口形成时间的推断提供参考依据。此外,本研究进一步使用了Western印迹法检测AChE蛋白表达的相对水平。AChE蛋白表达水平的变化趋势与免疫组织化学染色及双重免疫荧光染色的结果基本一致。和对照组相比,AChE在各切创组的蛋白表达水平均增高,于伤后1d达到峰值,此后下降,于伤后7d达到第2个峰值。本研究结果提示,AChE的Western印迹法检测可成为免疫组织化学染色及双重免疫荧光染色检测的补充手段,3种检测方法相互印证,可以使分析结果更加客观,缩小损伤时间推断的误差。
本研究结果证实,皮肤创口愈合期间AChE表达上调。皮肤损伤后,AChE时序性表达于PMN、Mφ、MyFb、新生血管内皮及再生的表皮,提示其可能参与创口愈合的炎症反应和纤维性修复的调节。此外,联合使用免疫组织化学染色、双重免疫荧光染色和Western印迹法检测AChE的表达,可为创口形成时间的推断提供参考依据。然而,本研究仅提供了动物实验数据,且未对损伤14d后创口的AChE表达进行观察。对于法医学实践应用,仍需收集不同损伤时间点的人体损伤样本进一步研究。

