静脉血栓形成时间推断的法医学研究进展
王林林 ,张富源 ,梁雪莹 ,王昌亮 ,4,赵锐 ,官大威
(1.中国医科大学法医学院 法医司法鉴定中心,辽宁 沈阳 110122;2.智慧检务创新研究院 智慧司法鉴定联合实验室,辽宁 沈阳 110122;3.中国医科大学临床三系,辽宁 沈阳 110122;4.辽宁省人民检察院,辽宁 沈阳 110032)
肺栓塞(pulmonary embolism,PE)是内源性或外源性栓子阻塞肺动脉引起肺循环障碍的一组疾病,包括肺血栓栓塞症(pulmonary thromboembolism,PTE)、脂肪栓塞综合征、羊水栓塞、空气栓塞、肿瘤栓塞等。PE中尤以来自静脉系统或右心的血栓阻塞肺动脉导致的PTE最为常见,占PE的绝大多数,通常所称的PE即为PTE[1]。深静脉血栓形成(deep venous thrombosis,DVT)是引起PTE的主要血栓来源,90%以上的DVT发生于下肢或者骨盆深静脉[2]。鉴于DVT与PET在发病机制上的相互关联性,临床上将其统称为静脉血栓栓塞症(venous thromboembolism,VTE)[1]。
PTE是常见猝死原因之一,其致死率为心血管系统疾病的第三位,仅次于冠心病和脑卒中[3]。近年来,国内外统计数据表明,PTE导致的猝死案例约占法医学实践中同期尸体检验案例总数的1%~5%[2,4-7]。对于PTE致死案例的法医学鉴定,通过详细的尸体解剖,在肺动脉及其分支内检查到血栓,可在下肢、骨盆等深静脉内追溯到血栓来源,结合案情及临床资料,排除中毒及其他致死性疾病与损伤后,可以得出死亡原因鉴定意见[8-9]。真正的难题是对于一些机体受创伤后因PTE死亡,或是以非血栓相关疾病收治入院期间因PTE死亡的案例,需要法医病理学工作者分析创伤或医疗行为与PTE发生之间的因果关系,以进行事故责任的认定[2,10]。要解决这一难题,需要认定创伤发生或医疗干预与血栓形成在时间上是否存在相关性。创伤或医疗干预的发生时间多有准确、客观的记录,因此,解决这一问题的关键就在于对血栓形成时间的准确判定上。本文就静脉血栓形成时间的法医学研究进展进行综述,以期为相关案例的鉴定提供参考。
1 静脉血栓形成时间推断的理论基础
血栓形成是血液在流动状态下,由于血小板的活化和凝血因子激活而发生的异常凝固过程。1856年,德国生理学家VIRCHOW首次提出了血栓形成的三因素学说[11]:血流瘀滞、静脉壁损伤及血液高凝状态。外力作用致内皮损伤后,内皮下带负电荷的胶原暴露,激活凝血因子Ⅻ而启动内源性凝血进程。同时内皮下组织因子释放,激活凝血因子Ⅶ而启动外源性凝血进程[11]。近年来研究发现,免疫细胞介导的无菌性炎症在静脉血栓形成过程中发挥重要推动作用,并提出了免疫性血栓形成学说(immunothrombosis)[12]。当血管损伤或者血流瘀滞时,内皮细胞被激活,释放Weibel-Palade小体,Weibel-Palade小体内储存的血管性血友病因子(von Willebrand factor,vWF)和P选择素(P-selectin)表达至内皮细胞表面。vWF可以黏附并激活血小板,血小板激活后释放硫醇型高迁移率族B1(high mobility group B1,HMGB1)蛋白促进白细胞募集,募集而来的单核细胞通过P选择素糖蛋白配体1(P-selectin glycoprotein ligand 1,PSGL1)与内皮细胞激活后释放的P-选择素作用结合至内皮细胞表面,随后通过提供组织因子促进外源性凝血进程。中性粒细胞通过PSGL1与内皮细胞P选择素结合后,释放由DNA、组蛋白等构成的中性粒细胞胞外诱捕网(neutrophil extracellular trap,NET),NET中的DNA带负电,可激活凝血因子Ⅻ促进内源性凝血进程。最终,在上述凝血调控机制作用下,凝血酶原被激活,产生的凝血酶使纤维蛋白原转变为不可溶性纤维蛋白,与局部聚集的血小板、白细胞、红细胞等共同构成血栓[13-16]。
血栓形成后,纤溶系统激活,血浆中的纤溶酶原在组织型纤溶酶原激活物(tissue-type plasminogen activator,tPA)和尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator,uPA)作用下发生有限水解而激活为纤溶酶。在纤溶酶作用下,纤维蛋白和纤维蛋白原被分解成可溶性小肽而促使血栓溶解。若纤溶系统的活力不足,血栓长时间不被溶解,则由内皮细胞、成纤维细胞自血管壁向血栓内长入,形成肉芽组织逐渐取代血栓,这一过程称为血栓机化。血栓机化过程中,新生的内皮细胞覆盖于血栓内由于组织干燥收缩产生的裂隙上,形成迷路状相互沟通的管道,使血栓上下游的血流得以部分地沟通,这种现象称为再通[17-19]。单核细胞在血栓溶解过程中发挥重要作用,可通过释放uPA和基质金属蛋白酶(matrix metalloproteinase,MMP)和多种炎症因子等促进血栓溶解,并通过诱导内皮祖细胞募集促进血管新生[20-21]。
血栓的形成、溶解及机化再通是一个复杂的动态变化过程,需要多种效应细胞及其释放的调节因子共同参与,这些活性成分的时序性表达与血栓形成时间具有相关性,是法医学研究中进行静脉血栓形成时间推断的理论基础。通过系统检测这些活性成分的时序性表达规律,筛选出与静脉血栓形成时间相关性好的生物学指标,并将相关研究成果应用于实践,是解决静脉血栓形成时间推断这一科学问题的基本研究思路。
2 静脉血栓形成时间推断的早期研究成果
1922年,MÖLLER[22]最先开始探讨通过红细胞形态学改变、含铁血黄素沉积等现象推测血栓形成时间的可能性。20世纪中叶以后,IRNIGER等[23-26]相继对PTE案例中的血栓形成时间进行了研究。其中尤以IRNIGER[23]的研究最为系统,具有重要的里程碑意义。IRNIGER通过将法医学实践中收集的血栓形成时间相对明确的143例PTE死亡案例,制作血栓组织切片后进行苏木素-伊红(hematoxylin-eosin,HE)染色、Van Gieson染色、Weigert弹力纤维染色、网状纤维嗜银染色、Perls含铁血黄素染色等,根据系统的形态学表现将血栓的形成时间划分为6个阶段(表1)。

表1 IRNIGER的血栓形成时间分期标准[23]
对于IRNIGER的研究成果,JANSSEN[27]认为其对血栓形成时间的阶段划分过于细致,在实际应用中需谨慎。SAUKKO等[28]综合前人研究成果,在Knight’s Forensic Pathology第3版中对静脉血栓形成时间推断提出了以下建议:(1)血小板及红细胞形态学表现难以提供有价值的信息。红细胞可于血栓形成后24~48h开始溶解形成无定形团块,但是也会有一些完整红细胞存活数周之久。(2)进行磷钨酸苏木素染色,1d时纤维蛋白可被染成淡紫色条带,4d时聚集成小团块,表现为更粗的网状条带,2周后纤维蛋白被染成深紫色,25d时开始逐渐被吸收。进行马休黄猩红蓝染色,早期被染成粉红色的纤维蛋白条带于1周左右开始被深红色替代。(3)内皮细胞增殖是反映血栓形成1周内的最好指标,内皮细胞于2d时开始萌芽,并在第1周内持续增殖。血栓周边紧靠静脉壁的裂隙内可见内皮细胞覆盖。这些新生的内皮细胞将血栓锚定在静脉壁上,是血栓再通进程的第一步。这一现象通常在第4天时比较明显。(4)胶原纤维在血栓形成后的5~10 d(甚至更长的时间)内都不会出现。成纤维细胞最早可于第2~3天开始出现,但多数于第1周后期开始出现,并于第2~4周达到高峰。弹力纤维于血栓形成28d以后才开始出现,于2个月左右达到高峰,主要分布于再通的血管壁内。(5)被Perls染液染成蓝色的含铁血黄素颗粒于血栓形成后第1周的后期开始出现,并在3周内达到高峰。(6)随着内皮细胞的生长,最早于第2天时在血栓内就可观察到毛细血管,但是直到2周后这些血管内才会有红细胞填充。在随后的3个月内,这些小的腔隙会汇合成为大的管腔。被堵塞的血管在第6~12个月会实现完全再通,但是内皮增厚及管壁内含铁血黄素沉积可能会长期存在。(7)多核细胞可于1d内出现,随后迅速消失,通常第2天时单核细胞就成为主要的白细胞成分。(8)血栓游离面被内皮细胞覆盖的过程非常迅速,可能于第1天就开始并在24~72h结束。
3 静脉血栓形成时间推断的近期研究进展
20世纪80年代以后,免疫组织化学染色、多重免疫荧光等实验技术手段发展迅速,EISENMENGER等[29]将此技术应用到法医学领域,为损伤时间推断的相关研究掀开了新的篇章。2009年,FINESCHI等和KONDO团队几乎同时发表了应用这些技术进行静脉血栓形成时间推断的专著[6,30]。FINESCHI等利用实践中收集到的140例PTE死亡案例,对血栓组织切片进行HE、Masson、PTAH、Van Gieson、Von Kossa和Perls染色,以及纤维蛋白原、CD61(血小板)、CD45(白细胞)、CD15(中性粒细胞)、CD68(单核细胞)的免疫组织化学染色。其研究结果也表明,IRNIGER的血栓形成时间分期过于详细,并提出了新的血栓形成时间分期标准(表2)[6]。这一分期标准在其团队于2011年进行的43例PTE死亡案例中得到了进一步验证[31]。
KONDO团队在皮肤损伤愈合时间推断的研究领域具有很深的造诣,鉴于血栓形成后机化再通过程与皮肤损伤愈合中肉芽组织形成过程的相似性,其团队从2009年开始,在前期皮肤损伤时间推断研究的基础上,开展了静脉血栓形成时间推断的系列研究,并取得了丰厚的研究成果[30,32-38]。他们利用小鼠下腔静脉结扎模型诱导形成深静脉血栓,于造模后1、3、5、7、10、14和21d取材,制作血栓组织切片,通过免疫组织化学染色及多重免疫荧光技术检测白细胞、内皮祖细胞、纤维细胞等一系列效应细胞及其分泌的活性物质的动态表达规律,其研究成果汇总如表3。

表2 FINESCHI等的血栓形成时间分期标准[6]
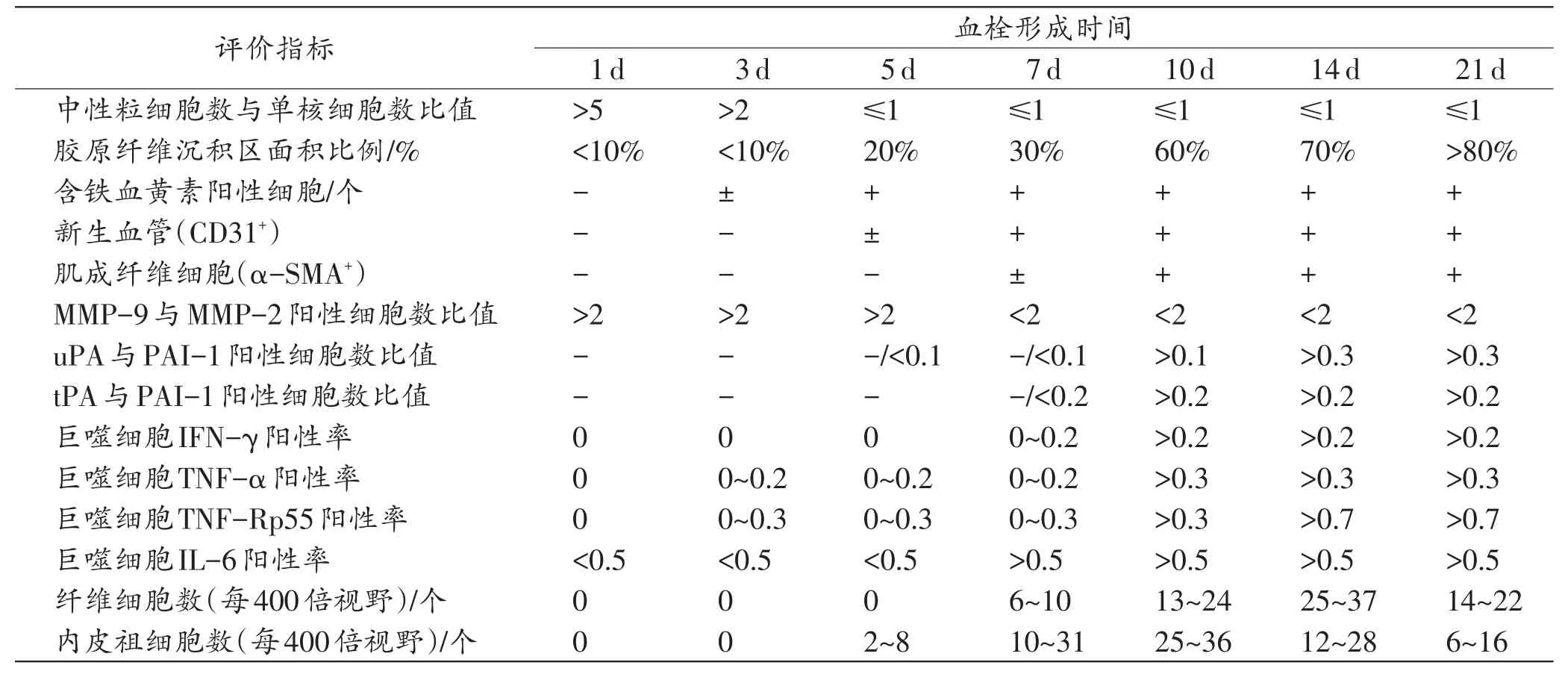
表3 KONDO团队的研究成果汇总[30,32-38]
国内法医学领域,张国忠团队近年来率先通过建立大鼠下腔静脉部分结扎(狭窄)模型诱导形成深静脉血栓,对血栓组织切片进行HE染色、Perls染色、Von Kossa染色以及CD61、α-SMA和CD34免疫组织化学染色等展开了静脉血栓形成时间推断的相关研究[39]。其研究结果表明:术后3h可见CD61阳性血小板并于术后1 d达高峰;术后3 d含铁血黄素开始析出,靠近血管壁的血栓组织边缘内可见α-SMA阳性成纤维细胞及少量CD34阳性血管内皮细胞;术后1周见钙盐析出,CD34阳性新生血管形成。此外,王英元、孙俊红团队也通过建立大鼠下腔静脉结扎模型对DVT的发生、发展机制进行了研究[40]。其研究发现,与对照组相比,术后3d的血栓组织内检测到了差异表达的22个microRNA和487个mRNA,且经生物信息学分析发现,这些microRNA和mRNA很大一部分与内皮细胞功能相关。该研究成果一方面与IRNIGER研究发现的内皮细胞在血栓形成1周内的动态变化相印证,另一方面,也提示利用基因组学技术进行血栓形成时间推断可获得大量数据信息,发展前景广阔。
4 静脉血栓形成时间推断研究成果综合比较与法医学实践应用参考
如上所述,针对静脉血栓形成时间推断这一难题,国内外法医病理学家相继展开了系列研究。IRNIGER[23]和FINESCHI等[6]的研究成果最有应用指导价值。他们通过对法医学实践中收集到的大量人体血栓栓塞案例标本进行系统组织病理学评价,先后提出了各自的血栓形成时间分期标准。IRNIGER的早期研究成果是基于HE、Van Gieson、Perls等一些经典的病理学染色技术得出的,实践操作相对简单,但是在白细胞胞体皱缩、血栓开始发生透明变性等形态学改变的判定上没有客观的度量标准。其研究结果对血栓分期划分详细(6个阶段),但是不同阶段划分在时间跨度上具有较大重叠性。FINESCHI的研究在HE、Van Kossa、Perls等染色的基础上,进一步应用免疫组织化学染色技术对血小板、中性粒细胞、单核细胞、纤维蛋白等进行特异性标记,并观察其形态学变化,结果更为客观,但是其对血栓所处阶段的划分相对笼统(仅分为3个阶段),在实际应用中精确性不够。IRNIGER和FINESCHI等的分期标准都是基于血栓与血管内皮分界情况、血栓内白细胞形态、内皮细胞增殖与毛细血管新生以及血栓机化等组织病理学变化建立的,但是同一现象所对应的血栓形成时间判定结果并不一致。IRNIGER指出,血栓形成3~8 d时发生内皮细胞增生并向血栓内迁移,而FINESCHI等则认为内皮细胞增生在血栓发生第2周时才开始出现。产生这种差异的一个重要原因是被研究案例的确切血栓形成时间并不明确,研究者是结合患者的临床资料对其血栓形成时间作出一个相对准确的推测,在这个过程中可能存在主观判断差异。
近年来,鼠下腔静脉结扎模型在深静脉血栓发生、溶解机制相关研究中应用广泛,该模型诱导的静脉血栓与人深静脉血栓的动态变化规律的相似性得到了普遍认可[15]。利用动物模型进行血栓形成时间研究的一个重要优势在于其血栓形成时间明确,所获得的血栓早期动态变化规律准确性高、重复性好。KONDO团队与张国忠团队利用这一优势分别开展了静脉血栓形成时间推断的基础研究[30,32-39]。其研究发现的鼠深静脉血栓形成3~5 d时开始出现含铁血黄素沉积,5~7d时开始出现血管新生与钙盐沉积等结果,与IRNIGER利用人体标本获得的研究结果具有很好的相似性,这表明基于动物实验获得的基础研究成果具有良好的转化应用前景。KONDO团队与张国忠团队在研究中利用不同白细胞的比例关系[30]、胶原纤维沉积区面积占血栓组织面积比例[33]、新生血管腔面积占原血管腔面积比例[39]等量化指标进行血栓形成时间推断,较IRNIGER和FINESCHI等利用的“大量白细胞浸润、胶原纤维开始沉积、毛细血管新生明显”等形态学指标更为客观,在将来的成果转化中应加以推广应用。目前,已有除了借鉴IRNIGER、FINESCHI等的分期标准外,还参考KONDO团队提出的利用中性粒细胞与单核细胞比例关系进行静脉血栓形成时间推断的案例报道[41-42]。利用动物模型进行静脉血栓形成时间推断研究具有结果稳定、可重复性好的优点,但需要注意的是,动物模型中形成的血栓体积较小,其血栓机化及完全再通的速度更快,通常1个月即可完成,因此对于一些可以反映血栓形成时间1周以上的指标,必须经过人体样本验证方可证实其实际应用价值。此外,还需注意的是,张国忠团队研究发现CD34阳性血管内皮细胞与α-SMA阳性成纤维细胞最早于血栓形成3d时开始出现[39],而KONDO团队研究发现其分别于血栓形成5 d及7 d时才开始出现[34]。产生这一差异的部分原因可能与KONDO团队使用小鼠进行研究,而张国忠团队使用的是大鼠有关。还有一个不可忽视的因素是,KONDO团队采用的是下腔静脉完全结扎模型,模拟的是血管内皮受损合并血流瘀滞时血栓的发生过程,而张国忠团队采用的是下腔静脉部分结扎(狭窄)模型,模拟的是血流缓慢时的血栓的发生过程[43]。若进一步实验能够证实血栓发生始动因素的差异会影响其随后的发展变化进程,那么在将来利用人体标本进行的后续研究中,需考虑将创伤因素(如骨折、挤压伤等)与非创伤因素(如长期卧床、肢体固定等)引发的血栓进行分组探讨的必要性。
基于IRNIGER、FINESCHI、KONDO团队的研究结果,参考SAUKKO和KNIGHT[28]的建议,结合本课题组在实践工作中遇到的多例相关案件的鉴定经验,笔者在此尝试提出一个综合的静脉血栓形成时间分期标准(表4),以期为相关案例的鉴定提供参考。

表4 静脉血栓形成时间分期标准
5 小结与展望
PTE是法医学实践中常见的猝死原因之一。对于PTE致死案件的法医学鉴定,不仅需要通过详细的尸体解剖检验及实验室辅助检查明确死亡原因,还需要对导致PTE的静脉血栓形成时间进行判断,以评判创伤或医疗干预与静脉血栓发生的先后顺序。若创伤或医疗干预的发生时间晚于静脉血栓的形成时间,则其不应为机体死亡负主要责任。若创伤或医疗干预的发生时间早于静脉血栓的形成时间,还需考虑血栓形成的个体易感因素,综合评价导致静脉血栓形成的创伤因素、个体因素以及医源性因素的比重,以进行事故责任的划分。此种情况下,于会永等[44]参考国内外文献绘制的深静脉血栓形成评价量表具有重要参考意义。在法医学实践中需要注意,血栓与静脉管壁间的黏附程度以及血管内皮细胞的增殖、迁移状态是反映血栓形成时间的重要指标,因此不可以单纯通过检查肺动脉内栓塞的栓子而对血栓形成时间作出评判。在解剖中应详细探寻血栓的来源,尤其是在DVT好发的骨盆和下肢深静脉,并提取检材。静脉血栓的形成是一个循序渐进的过程,其内部不同片层的血栓形成时间不尽相同,因此在找到导致PTE的血栓源头后,还需对残留的血栓进行头、体、尾分段取材,连同血管壁及血管外组织一并取下,通过实验室检查对静脉血栓的形成时间作出综合性评判。
在法医学领域,静脉血栓形成时间推断是损伤时间推断这一重要科学问题的分支,研究的核心内容也是通过一系列生物学标志物的时序性变化规律推测血管损伤、血栓形成的时间区间。早在20世纪20年代就有学者开始关注这一问题,但是多年来该领域的研究进展相对缓慢。目前已有的研究成果中,对血栓形成时间的阶段划分跨度偏大,需要进一步细化才能更好地应用于法医学实践。近年来,深静脉血栓动物模型的建立和广泛应用极大地增进了人们对血栓形成及溶解机制的认知,以氧化应激、炎症反应、细胞焦亡等为代表的生物学事件在静脉血栓发生发展过程中的重要性日益凸显。以此为契机,深入探讨相关调控因子的动态表达规律,有望为静脉血栓形成时间的法医学推断提供新的参考指标。在技术层面,光谱分析、质谱成像以及基因组学、蛋白组学、代谢组学等技术的快速发展为法医学损伤时间推断带来了新的机遇。通过多技术联合应用,将得到的大数据进行人工智能分析以获取更加精确的损伤时间推断结果是本领域的前沿发展方向。这一趋势同样适用于深静脉血栓形成时间的研究,通过多组学技术联合使用,系统检测血栓组织内mRNA、microRNA、蛋白质、小分子代谢物的动态变化图谱,结合血栓组织的光谱吸收峰数据和分子空间分布特征信息,进行人工神经网络、随机森林、偏最小二乘回归分析等人工智能算法分析,有望得到更加精确的血栓形成时间推断结果。以上述研究思路为导向,深入开展静脉血栓形成时间的研究,相信未来本领域的研究成果必将会有一个质的飞跃,并将助力于“精准法医学损伤时间推断”这一目标的实现。

