日本血吸虫外源性短肽干预小鼠巨噬细胞极化
(南华大学衡阳医学院病原生物学研究所,湖南省特殊病原体防治重点实验室,湖南省分子靶向新药研究合作创新中心,湖南 衡阳 421001)
肝纤维化是血吸虫病最严重的免疫病理损害[1-2]。巨噬细胞的极化在纤维化形成和发展中发挥关键作用。作者前期研究发现,日本血吸虫体表特异性结合短肽ZLW[3],可降低SmAP 酶活性[4-5],抑制肝纤维化,干预宿主巨噬细胞的极化。本实验力图通过研究ZLW-SmAP-腺苷三者之间的关系,验证ZLW干预宿主巨噬细胞极化状态的分子机制。
1 材料与方法
1.1 材料
小鼠巨噬细胞RAW264.7细胞系购于中国科学院上海细胞研究所;ZLW多肽由浙江昂拓莱司生物技术有限公司合成;阳性钉螺购于岳阳市血吸虫病防治所;昆明小鼠购于同济大学实验动物中心;腺苷ELISA检测试剂盒购于上海江莱生物有限公司;qRT-PCR试剂盒购于天根生化有限公司;引物由上海生工有限公司合成;全自动酶标检测仪为BIO-TEK美国宝特公司;凝胶图像分析系统为BIO-RAD美国伯乐公司;荧光定量PCR仪为瑞士罗氏生物有限公司。
1.2 日本血吸虫碱性磷酸酶的分离
根据参考文献[6],略加改进,利用正丁醇-硫酸铵法提取虫体碱性磷酸酶:日本血吸虫常规感染小鼠取虫体1 g,洗涤后,加入3 mL 0.05 mol/LTris-HCl匀浆l min,4 ℃过夜后加入预冷的正丁醇0.6 mL,37 ℃保温30 min后,放置冰箱内10 h,室温下离心 4 000 r/15 min,取上清;在其上清液中加入硫酸铵,取0.35 ~0.70饱和度盐析物,溶于0.05 mol/L的Tris-HCl缓冲液(pH 7.5)中,充分透析后离心;用0.05 mol/L的Tris-HCl缓冲液(pH 7.5)洗脱,每管收集1 mL; BCA法检测蛋白浓度,并检测其酶活。
1.3 ELISA检测各刺激因子最佳浓度
将细胞浓度调整为5×104,接种在24孔板内,加入不同浓度梯度的单磷酸腺苷(1.5 mmol/L、2 mmol/L、2.5 mmol/L、3 mmol/L),培养24 h,收集上清,ELISA检测iNOS以及Arg1的OD值,明确其最佳浓度;将最佳浓度的单磷酸腺苷与不同浓度梯度的碱性磷酸酶(0.9 mmol/L、1 mmol/L、1.1 mmol/L、1.2 mmol/L)共同培养细胞,同法检测碱性磷酸酶最佳浓度;最佳浓度的碱性磷酸酶、单磷酸腺苷与不同浓度梯度的多肽(0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L)共同培养细胞,检测多肽的最佳浓度。
根据单磷酸腺苷、碱性磷酸酶及多肽的最佳浓度,ELISA分别测定A2a受体抑制剂、A2a受体激动剂、A2b受体抑制剂及A2b受体激动剂等各刺激因子的最佳浓度。
1.4 干预分组
调整细胞浓度,接种于24孔板内,待细胞生长到80%时,加入最佳浓度的刺激因子进行孵育。实验分组为:碱性磷酸酶+单磷酸腺苷+多肽组、碱性磷酸酶+单磷酸腺苷+多肽+A2a受体抑制剂组、碱性磷酸酶+单磷酸腺苷+多肽+A2a受体激动剂组、碱性磷酸酶+单磷酸腺苷+多肽+A2b受体抑制剂组 、碱性磷酸酶+单磷酸腺苷+多肽+A2b受体激动剂组,分别设置对照组。
1.5 Western blot检测一氧化氮合酶和精氨酸酶1的蛋白表达水平
各实验组干预24 h后,TBS洗涤三遍,加入裂解液80 μL,裂解30 min,用细胞刮将细胞刮下来,4 ℃12 000 r/5min。吸取上清保存。取上述40 μL样品,按4∶1比例与5×SDS 上样缓冲液混匀,100 ℃煮沸后变性10 min。进行聚丙烯酰胺凝胶电泳,随后进行半干转膜,恒流0.05A,时间为40 min,将胶转移到PVDF膜上。转膜成功后,用含有5%脱脂奶粉的封闭液,4 ℃封闭过夜。用(1∶1 000)稀释鼠抗iNOS以及Arg1,37 ℃培养箱内孵育2 h。用含0.05% Tween-20的缓冲液洗膜6次,去除残留的一抗。按照同样的方法孵育二抗(1∶5 000),37 ℃孵育1~2 h,TBST洗膜6次,滤纸吸干,滴加显影液,拍照,用条带密度定量蛋白表达量。
1.6 ELISA检测细胞培养上清中腺苷的含量
ZLW处理24 h后,吸取上清再加样,加入酶标试剂37 ℃条件下温育60 min,洗涤后显色,加入终止液,在450 nm波长下依序测量各孔的吸光度。
1.7 对硝基苯磷酸二钠法检测碱性磷酸酶酶活
取0.1 mL 20 mol/L的对硝基苯磷酸二钠,加入1.8 mL 0.1 mol/L Na2CO3-NaHCO3(pH 9.7)缓冲液,混匀后于37 ℃下预热 5~10 min,再加入100 μL SmAP液,37 ℃反应10 min后立即加入1 mL 0.5 mol/L的NaOH停止酶促反应,于405 nm处测吸收值,按公式计算酶活(U/mL):酶活= OD405nm/(18.8×103×反应时间)×103×测定液体积/酶液体积×稀释倍数。
1.8 qRT-PCR检测细胞内一氧化氮合酶和精氨酸酶1的mRNA转录水平
利用PrimerPremier5.0软件设计引物,iNOS上游引物;GCAGAGATTGAGGCCTTGTG,下游引物:GGGTTGTTCTGAACTTCCAGTC。Arg1上游引物:A GACAGCAGGGAGGTGAAGAG,下游引物:CGAAGCAAGCAAGGTTAAAGC。β-Actin上游引物:GTCGTACCACAGGCATTGTGATGG,下游引物:GCAATGCCTGGGTACATGGTGG。常规方法提取各小组的总RNA后,检测其RNA的纯度,将其反转录成cDNA,随后根据PCR试剂盒说明书进行聚合酶链式反应。
1.9 硝酸还原酶法测定细胞上清中一氧化氮的含量
取各小组100 μL细胞培养上清,按照硝酸还原酶法试剂盒,进行孵育,以Bio-Rad 450酶标仪550 nm波长测定其吸收值。
1.10 免疫荧光检测细胞表面标志,鉴别M2型巨噬细胞
常规细胞爬片后,TBS缓冲液清洗3遍,加入4%多聚甲醛液置于4 ℃冰箱固定30 min,每孔加入200 μL含0.1%Triton的PBS,常温透膜10 min。TBS缓冲液清洗10 min,用含10%FBS的培养基37 ℃封闭1h,巨噬细胞及M2型巨噬细胞表面标记分子CD68、CD206抗体37 ℃孵育2 h,进行荧光二抗37 ℃1h孵育,洗涤,荧光显微镜镜检。
1.11 统计学分析
采用SPSS 13.0软件进行方差分析,所有数据均用均数±标准差表示,组间的比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 成功分离日本血吸虫碱性磷酸酶
实验结果显示,常规方法提取碱性磷酸酶后,BCA法检测其蛋白浓度为600 mg/L,对硝基苯磷酸二钠法检测SmAP酶活,于405 nm处测吸收值,其酶活为1.2 U/mL。
2.2 各刺激因子最佳浓度
ELISA结果显示,单磷酸腺苷干预正常的小鼠巨噬细胞24 h后,iNOS及Arg1的OD值在2.5 mmol/L浓度时出现了峰值,其最佳浓度为2.5 mmol/L(图1)。同法测得碱性磷酸酶最佳浓度为1.1 mmol/L;多肽最佳浓度为0.6 mmol/L。三者确定了最佳浓度后,A2a受体激动剂干预24 h,其最佳浓度为8 μmol/L,A2a受体抑制剂最佳浓度为4 μmol/L, A2b受体激动剂最佳浓度为8 μmol/L,A2b受体抑制剂最佳浓度为8 μmol/L(图1)。
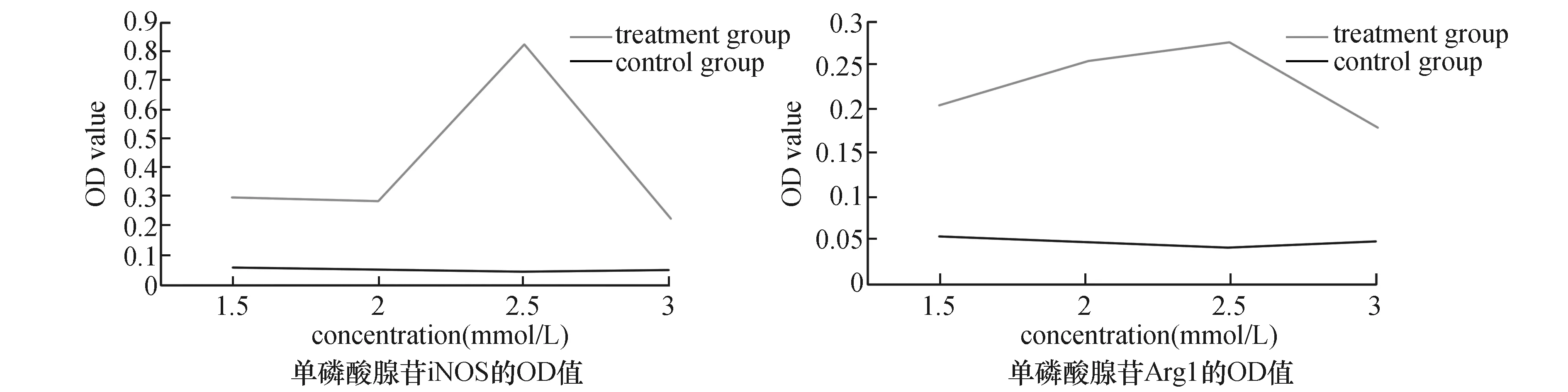
图1 ELISA测定各刺激因子最佳浓度
2.3 多肽干预后对细胞内一氧化氮合酶和精氨酸酶1的蛋白表达水平的影响
根据最佳浓度,添加碱性磷酸酶+单磷酸腺苷+多肽干预24 h后,Western blot结果示:与对照组相比,碱性磷酸酶+单磷酸腺苷+多肽组iNOS蛋白表达水平增加,Arg1的蛋白表达水平下降(图2)。
2.4 多肽干预后对细胞培养上清中腺苷的影响
ELISA结果显示,与对照组相比,碱性磷酸酶+单磷酸腺苷+多肽组腺苷浓度明显下降(P<0.01,图3)。

图2 Western blot检测iNOS和Arg1的蛋白表达水平

图3 ELISA法检测细胞培养上清中腺苷的含量(n=3)与对照组比较,*P<0.01
2.5 多肽干预后对碱性磷酸酶酶活的影响
与对照组相比,碱性磷酸酶+单磷酸腺苷+多肽组碱性磷酸酶的活性明显降低(P<0.01,图4)。

图4 对硝基苯磷酸二钠法检测SmAP酶活(n=3)与对照组比较,*P<0.01
2.6 多肽干预后对细胞内一氧化氮合酶和精氨酸酶1的mRNA转录水平的影响
qRT-PCR结果显示,与对照组相比较,碱性磷酸酶+单磷酸腺苷+多肽+A2a受体激动剂(CGS21680)小组的iNOS的mRNA相对表达水平下调(P<0.01),碱性磷酸酶+单磷酸腺苷+多肽+A2b受体激动剂(Bay60-6583)小组的Arg1的mRNA相对表达水平显著上升(P<0.05,图5)。
2.7 多肽干预后对细胞上清中一氧化氮的影响
结果显示,与空白对照以及其他抑制剂、激动剂小组相比,碱性磷酸酶+单磷酸腺苷+多肽组NO含量显著上升(P<0.01,图6)。
2.8 多肽干预后对M2型巨噬细胞的影响
免疫荧光结果显示,与空白对照组相比,实验组M2型巨噬细胞数量有所下降(图7)。

图5 qRT-PCR检测细胞内iNOS和Arg1的mRNA转录水平(n=3)与对照组比较,*P<0.05A:各组iNOS的mRNA转录水平(与对照组相比,P<0.01); B:各组Arg1的mRNA转录水平(与对照组相比,P<0.05)

图6 硝酸还原酶法检测细胞上清中NO的含量(n=3)与空白对照以及其他抑制剂、激动剂小组相比,*P<0.01
3 讨 论
在日本血吸虫所导致的肝纤维化研究中发现,由经典途径激活的巨噬细胞(classicallyactivated macrophages,CAMφ,即M1型巨噬细胞),提高关键酶一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达,改善肝纤维化[7-8];经替代途径激活的巨噬细胞(alternatively activated macrophages,AAMφ,即M2 型巨噬细胞)产生的关键酶精氨酸酶 1(arginase1,Arg1),为肝星状细胞(hepatic stellate cell,HSCs)的增殖提供更多的多胺[9],从而促进肝纤维化。为明确ZLW抑制日本血吸虫宿主巨噬细胞M2极化的分子机制,在小鼠巨噬细胞体外培养中,单独加入ZLW后,两个关键酶iNOS及Arg1的表达没有改变,可见ZLW不能直接干预宿主巨噬细胞的极化。

图7 免疫荧光鉴别M2型巨噬细胞
前人的研究已经证明,腺苷对巨噬细胞的抗炎作用与促炎细胞因子、趋化因子和一氧化氮释放的抑制以及IL-10产生的增加有关,这些作用由A2a和A2b腺苷受体介导,巨噬细胞膜上的腺苷受体A2aR可抑制M1型极化,A2bR可促进M2型极化[10]。在不同的组织研究中发现[11-12],A2aR在巨噬细胞中的表达有助于小鼠肺纤维化的进展,与真皮成纤维细胞结合则促进皮肤纤维化的形成;A2bR也在不同细胞类型上鉴定出各种促纤维化活性,具有调节成纤维细胞和巨噬细胞促纤维化活性的能力。腺苷的前体为单磷酸腺苷(AMP),而日本血吸虫碱性磷酸酶(Schistosome Membrane Alkaline Phosphatase,SmAP)可以激活宿主巨噬细胞膜表面腺苷前体单磷酸腺苷(AMP)[13-14];前期本课题小组实验也证明了ZLW作用后,SmAP活性下降[4]。为此,在小鼠巨噬细胞体外培养中,单独加入AMP或SmAP,经ZLW的作用也无明显的变化,由此可知ZLW不能直接干预巨噬细胞的极化,也不能通过AMP干预巨噬细胞的极化;然而当培养基中同时加入AMP和SmAP,经ZLW作用后,Arg1的表达下调,iNOS增加(图2,图5),细胞培养上清中腺苷的合成减少(图3),碱性磷酸酶酶活下降(图4),NO含量上升(图6),免疫荧光结果显示,实验组M2型巨噬细胞数量有所下降(图7)。由此可见ZLW必须通过调控SmAP的活性,间接抑制宿主巨噬细胞的M2极化状态。
由于A2a受体激动剂能减轻炎症的损伤,A2b受体拮抗剂可以抑制炎症细胞的活性,其激动剂在腺苷以及衍生物的抗炎机制中起着非常重要的作用[15-17]。因此为了进一步验证A2aR、A2bR对巨噬细胞极化、炎症因子产生及纤维化的影响,本实验在处理组中分别添加了两种受体的激动剂以及抑制剂(图5)。结果显示A2bR促进巨噬细胞M2极化,A2aR抑制巨噬细胞M1极化,抑制了NO的产生,证明ZLW可以通过激活巨噬细胞膜的腺苷受体,干预巨噬细胞的极化,从而影响纤维化的发生发展。

