全局转录机制工程法筛选丁醇耐受大肠杆菌及性质
司海明 , 韩瑞枝 , 许国超 , 董晋军 , 倪 晔 *
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院 江苏 无锡214122)
现代工业飞速发展的同时,随之出现了一系列问题,例如化石燃料(煤炭、石油等)极度消耗,环境污染日益加剧,雾霾现象愈发严重。为此,人们将关注焦点逐渐从化石能源转移至生物能源的开发和利用上,例如利用微生物生产乙醇和丁醇等生物燃料。但是,大多数有机溶剂对微生物细胞生长有抑制作用。它们能够破坏细胞膜、改变胞内pH、引发胞内离子和代谢物质的丢失和蛋白的错误折叠,导致细胞受损甚至死亡[1]。因此,构建具有较高有机溶剂耐受性的微生物菌株对生物能源的工业化生产具有重要意义。丁醇作为一种新型的、可再生的生物燃料,具有热值高,腐蚀性小和抗爆性好等优点[2-4]。传统的丁醇生产菌株梭菌因其培养方式严格厌氧,代谢调控复杂,分子操作困难[5-7],严重限制了微生物工业生产丁醇的经济性。大肠杆菌因其遗传背景清晰,分子操作简单,更有利于应用于丁醇的工业生产。但是由于大肠杆菌的溶剂耐受性较低,在体积分数1%丁醇压力下就停止生长[8]。因此提高大肠杆菌的丁醇耐受性是提高丁醇产量的前提。
传统研究中,人们通过有机溶剂驯化,物理或化学诱变的方法获得溶剂耐受性菌株,但是这些方法耗时耗力而且获得的效果也微乎其微[9-10]。随着后基因组时代的发展,众多研究者更多地采用代谢工程手段以及从基因组全局水平出发研究微生物表型与基因组转录之间的关系。2006年,Alper等首次提出全局转录调控机制 (global transcription machinery engineering,gTME)的概念,指出全局转录因子可以直接或者间接的调控大肠杆菌内大多数基因的转录水平[11]。近年来,有一些通过对全局转录因子操纵来改造微生物表型的报道。有报道通过对全局转录因子cAMP受体蛋白(CRP)进行随机突变得到能够耐受体积分数1.2%丁醇的大肠杆菌[12]。Hong等对大肠杆菌全局转录因子Hha突变来调控生物被膜的形成,从而降低微生物的致病性[13]。也有研究者通过对Saccharomyces cerevisiae中全局转录因子spt15进行突变,提高酵母菌株对木糖的耐受及利用率[14]。σ70全局转录因子作为大肠杆菌RNA聚合酶的一个亚基,其突变能够影响RNA聚合酶对启动子的识别,从而对大肠杆菌基因组中上千个基因的转录水平进行调控[15-16]。Alper等通过突变大肠杆菌全局转录因子σ70的编码基因rpoD,将大肠杆菌的乙醇耐受性提高至70 g/L[17]。
作者通过随机突变全局转录因子σ70筛选获得一株能够耐受体积分数2%丁醇的大肠杆菌E.coli JM109/pHACMB8,其携带有rpoD突变基因B8,命名为突变株B8。该突变株也能够耐受多种不同毒性的有机溶剂,如异丁醇,乙醇,环己烷,甲苯。通过比较对照菌株E.coli JM109/pHACMWT和突变株B8的生理特性,发现突变菌株B8较对照菌株E.coli JM109/pHACMWT胞内的丁醇含量降低,且具有较好的低pH耐受性。此外,向培养基中添加Mg2+有助于提高突变株B8对丁醇的耐受性。该研究为选育具有耐丁醇表型的微生物菌株奠定了基础并提供了理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和培养基 菌株:E.coli JM109为本实验室保藏;质粒:携带了野生型rpoD基因的pHACM质粒由清华大学于慧敏教授惠赠。
LB培养基:胰蛋白胨10 g/L,酵母浸粉5 g/L,NaCl 10 g/L,固体培养基添加琼脂20 g/L。必要时添加氯霉素 34 μg/mL。
LBGMg:在 LB培养基中添加10 mmol/L的MgSO4和1 g/L的葡萄糖。
1.1.2 酶、试剂、引物及相关试剂盒 正丁醇:购于国药集团;质粒小量抽提试剂盒、胶回收试剂盒、DNA Marker、高保真酶:购自TaKaRa公司;随机突变试剂盒(GeneMorph II Random Mutagenesis Kit):安捷伦科技有限公司;引物由上海捷瑞生物工程有限公司合成;测序由赛音生物技术(上海)有限公司完成。实验中所用引物为p-rpoD-F5′-AACCTAGGAGCTCTGATTTAACGGCTTAAGTGCCG AAGAGC-3′和 p-rpoD-R5′-TGGAAGCTTTAACG CCTGATCCGGCCTACCGATTA-3′。
1.2 方法
1.2.1 σ70随机突变库的构建 利用随机突变试剂盒,以携带有rpoD基因的质粒pHACM为模板,以p-rpoD-F、p-rpoD-R为引物对rpoD (编码σ70转录因子)进行随机突变。PCR条件为:95℃ 5 min,95℃ 30 s,57℃ 1 min,72℃ 2 min, 反应 30个循环后72℃再延伸10 min。对突变后的rpoD片段经凝胶电泳后切胶回收,以纯化后的rpoD片段为引物对pHACM进行全质粒大引物PCR。反应结束后向PCR产物中加入DpnI酶消化模板质粒,PCR产物经凝胶电泳后切胶回收。回收后的质粒按照常规热激方法,转入E.coli JM109感受态细胞中,同时将未突变的质粒转化E.coli JM109感受态细胞后获得的菌株作为对照菌。37℃后培养1.5 h后涂布氯霉素固体平板中培养至单菌落出现,即获得rpoD随机突变库。随机挑取10个单菌落于液体LB/Cm培养基中,37℃过夜培养,分别提取其质粒并送至测序公司进行rpoD基因测序,将测序结果与野生型rpoD进行序列比对,初步计算突变库中rpoD的突变率。
1.2.2 丁醇耐受突变株的筛选 第一轮筛选:为获得一株具有较高丁醇耐受的大肠杆菌突变株,将1.2.1中构建的随机突变库中的单菌落接种于含有LB/Cm液体培养基的24深孔板中,当OD660≈0.2时,向培养基中加入体积分数0.5%丁醇,继续培养8 h后分别测定菌体在OD660时的浓度。选取OD660较高的前10株突变株进行复筛,复筛过程中以体积分数0.1%的梯度不断提高培养基中丁醇的体积分数,直到获得一株具有最高丁醇耐受性的菌株D3。提取其质粒进行测序,然后重新转入E.coli JM109感受态细胞中,验证其最大丁醇耐受体积分数。
第二轮筛选:为进一步提高大肠杆菌的丁醇耐受性,以携带有rpoD突变基因D3的质粒为模板,按照1.2.1的方法再次构建随机突变库,按照一轮筛选的方法进行二轮筛选,直至获得一株最高丁醇耐受性的突变株B8,提取其质粒进行测序。
1.2.3 突变株B8丁醇耐受性评估及验证 评估:以体积分数1.2%作为培养基中丁醇的起始体积分数,并按体积分数0.1%梯度逐步提高培养基中的丁醇体积分数,直至B8菌浓不再增加,从而确定其对丁醇的极限耐受体积分数。
验证:对筛选获得的丁醇耐受突变株提取质粒,重新转化E.coli JM109细胞中,以未突变的菌株作为对照,在体积分数2%丁醇下37℃培养,每小时检测OD660,验证菌株的丁醇耐受能力,以排除驯化的影响。
1.2.4 丁醇耐受突变株B8对其他有机溶剂的耐受性 取过夜培养的菌液按2%的接种体积分数转接于LB/Cm液体培养基中,待OD660约为0.2时,分别向液体培养基中添加不同体积分数的异丁醇、乙醇、环己烷、甲苯,37℃继续培养8 h后,分别测定含不同有机溶剂培养基中的菌体浓度(OD660)。
1.2.5 胞内丁醇含量的测定 将生长至对数期的对照菌株E.coli JM109/pHACMWT和突变菌株B8在体积分数0.8%丁醇的LB液体培养基中培养1.5 h。取菌液以8 000 r/min,4℃离心10 min,再用20 mmol/L磷酸缓冲液(pH 7.0)洗涤细胞一次,离心获得湿菌体。用750 mg/L的溶菌酶进行破壁后,离心取上清液2 μL,进行气相检测。气相条件为:安捷伦气相色谱仪配合PEG20M毛细管柱 (30 m×0.32 mm×0.5 μm);N2作为载气; 柱温从60℃升至120℃,10℃/min,再以15℃/min的速度升至190℃,保留10 min。胞内丁醇含量以μg/mg湿细胞表示。
1.2.6 突变株B8对不同pH的耐受 将过夜培养的对照菌株E.coli JM109/pHACMWT和突变菌株B8按2%的接种体积分数分别转接于不同pH的LB/Cm液体培养基中,继续培养8 h后测定对照菌株和突变菌株的OD660值。
1.2.7 Mg2+对B8耐受性的影响 将过夜培养的对照菌株E.coli JM109/pHACMWT和突变菌株B8按2%的接种体积分数分别转接于LBG/Cm和LBGMg液体培养基中,待OD660约为0.2时,分别向液体培养基中添加体积分数0.5%的丁醇。通过每小时测定OD660的值检测菌株的生长情况。
2 结果与分析
2.1 σ70随机突变库的构建
利用随机突变试剂盒,对质粒pHACM上携带的rpoD(σ70的编码基因)进行随机突变。结果见图1(a)。在2 000 bp处有条带,符合rpoD片段的理论值大小。对rpoD片段纯化回收,以此为引物,pHACM为模板进行大质粒PCR,获得大小为6 000 bp的片段,结果如图1(b)。对获得的质粒用DpnI酶消化后,热转至E.coli JM109感受态细胞,通过LB/Cm平板筛选获得约106基因突变库。随机挑取10株菌进行测序,结果显示全部突变,所构建的突变库的突变率为2~7个核苷酸突变/基因。

图1 随机突变后的rpoD片段和全质粒扩增后的pHACM-rpoD质粒的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of rpoDMand pHACM-rpoDM
2.2 丁醇耐受突变株的筛选
为了有效提高大肠杆菌对丁醇的耐受性,我们进行了两轮随机突变。在第一轮突变过程中,从483突变株中筛选获得10株在体积分数0.5%丁醇压力下生长较快的菌株(OD660>1.0)。对这10株菌进一步丁醇梯度筛选(体积分数0.1%梯度逐步提高),结果显示当丁醇体积分数达到1.2%时,突变株D3长势最好,OD660达到了0.76,其他9株突变株和对照菌株OD660均低于0.6(图2(a))。 提取突变株D3的质粒,经测序发现rpoD基因中两个碱基发生了突变,相应的氨基酸突变为I41L、P97Q。
为了获得更高丁醇耐受性的大肠杆菌,我们以突变株D3的质粒为模板,进行第二轮突变。在483突变株中有8株菌的OD660明显高于其他突变株。将这8株菌在丁醇体积分数0.1%梯度递增的液体培养基中培养,发现B8在体积分数1.2%丁醇下OD660达到了 1.4,其他菌株 OD660<1.0(图 2(b))。 同时提取了突变株B8的质粒进行测序,发现在前面氨基酸突变的基础上,又增加了E57D这个位点的突变,即现在所得突变株突变位点为:I41L、E57D、P97Q。

图2 第一轮和第二轮筛选获得的丁醇耐受突变株在体积分数1.2%丁醇下的生长情况Fig.2 Cell growth of high butanol tolerant mutants in1.2%butanol afterthe first and second round screening
2.3 突变株B8对丁醇极限耐受体积分数实验
为了进一步确定丁醇耐受突变株B8对丁醇的极限耐受体积分数。我们将携带有野生型rpoD的对照菌株E.coli JM109/pHACMWT和突变株B8分别在体积分数1.2%~2.2%丁醇递增的培养基中,37℃培养8 h,测定各体积分数下菌株的OD660值,见图3。发现当丁醇体积分数达到2.0%时,B8的OD660达到0.372,随着丁醇体积分数的增加,B8停止生长,而对照菌株在体积分数1.2%的丁醇中就已经停止生长,表明我们筛选到的突变株B8最高能够耐受体积分数2.0%的丁醇,比对照菌株丁醇耐受性提高了近一倍。同时为了排除溶剂驯化造成的影响,我们提取质粒,重新转入E.coli JM109感受态细胞中,并与对照菌株同时在含有体积分数2%丁醇的LB/Cm培养基中培养8 h,测定它们的生长曲线,见图4。结果表明,B8的生长情况明显好于对照菌株,排除了丁醇驯化的影响。先前研究报道,Bui等人通过突变人工转录因子ATF结合过表达细胞膜相关基因的方法将大肠杆菌丁醇耐受性提高到体积分数2.0%[18]。这与我们筛选的菌株耐受体积分数相当,但是本研究的方法更加简单、快速,省去了繁杂的菌株构建过程。
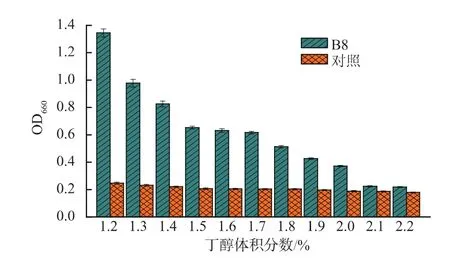
图3 突变株B8丁醇耐受体积分数测定Fig.3 Butanol tolerance assay of mutant B8
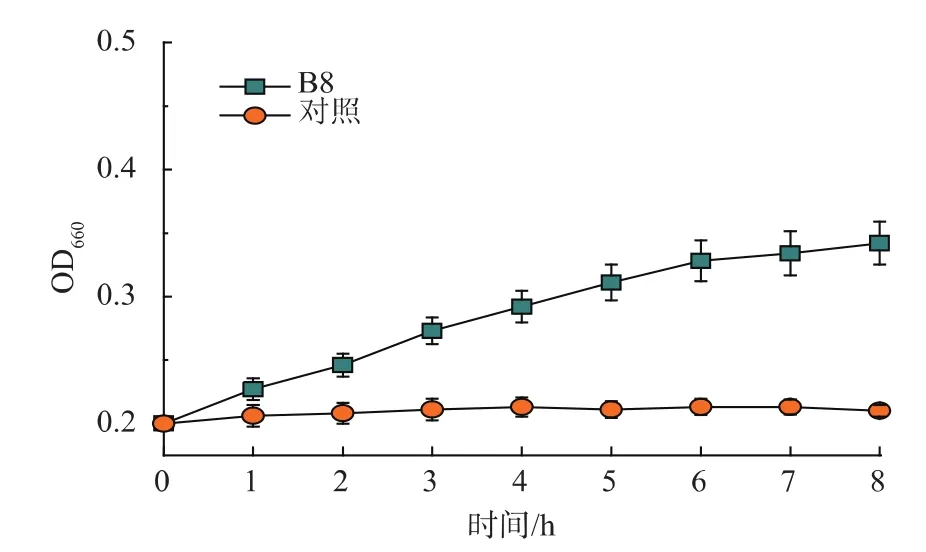
图4 对照菌株E.coli JM109/pHACMWT和突变株B8在体积分数2%丁醇下的生长情况Fig.4 Growth curve of WT and mutant B8 in 2%butanol
2.4 B8对其他有机溶剂的耐受性
突变株B8对丁醇表现出了较好的耐受性,为了验证该突变株是否对其他有机溶剂也具有较好的耐受性,我们通过向培养基中添加毒性程度不同的有机溶剂来证明该菌株的溶剂耐受性,结果见图5。突变株B8对异丁醇、乙醇、环己烷、甲苯的最大耐受体积分数分别为3%、8%、4%和0.3%。而对照菌株在体积分数1%的异丁醇、3%乙醇、1%环己烷和0.15%甲苯中就停止生长,表明我们筛选获得的突变株不仅能够耐受丁醇,对其他有机溶剂的耐受性也有明显的提高,说明该突变株对丁醇耐受机制与对其他溶剂的耐受机制存在共性。先前也有研究表明,大肠杆菌中与丁醇耐受相关基因对乙醇、异丁醇同样有较好的耐受性[19]。这对利用耐受菌株在不同的两相生物催化体系中的应用具有重要意义。

图5 突变株B8对异丁醇、乙醇、环己烷、甲苯的耐受性Fig.5 Solvent tolerance of mutant B8 towards isobutanol,ethanol,cyclohexane and toluene
2.5 E.coli JM109/pHACMWT和突变菌株B8胞内丁醇体积分数的测定
为进一步探究突变株B8丁醇耐受性提高的原因,我们比较了对照菌株E.coli JM109/pHACMWT和突变株B8在体积分数0.8%在丁醇胁迫下胞内丁醇质量分数的变化。我们发现,在37℃培养1.5 h后,B8胞内丁醇的质量分数为1.29 μg/mg,明显低于对照菌株2.86 μg/mg。由于丁醇能够透过细胞膜进入细胞,不仅对细胞膜具有严重的破坏性,而且可以破坏细胞内代谢平衡,对细胞具有致命的杀伤力[20]。实验结果表明,突变株B8对丁醇有更好的抵御能力,这也是突变株对丁醇具有较高耐受性的原因之一。
2.6 E.coli JM109/pHACMWT和突变菌株B8对不同pH耐受的比较
细胞会产生大量能量来抵御外界有机溶剂的压力[21],且通过电子传递链产生ATP的同时会产生大量的H+,细胞会将这些H+排除体外以维持胞内代谢平衡,致使细胞生长环境的pH会降低。因此我们通过比较对照菌株和突变株B8在不同pH下的生长情况来进一步说明B8丁醇耐受性提高的原因。如图6所示,除pH 3.5时对照菌株和突变株B8生长完全受到抑制外,在其他pH环境下B8的生长状况都明显好于对照菌株。pH为5时,B8的OD660达到了1.8,表明在酸性条件下突变株B8的生长情况良好。进一步表明B8能够更好的适应在抵御压力过程中所造成的胞内和胞外的变化。

图6 突变株B8在不同pH下的生长情况Fig.6 Growth of mutant B8 underdifferent pHs
2.7 Mg2+对菌株耐受性的影响
早期研究发现,Mg2+能够提高P.putida对有机溶剂的耐受能力,于是我们测定了Mg2+对大肠杆菌突变株B8的耐受性的影响。结果见图7。突变株B8和对照菌株在体积分数0.5%丁醇压力下,Mg2+的添加均能提高菌株对丁醇的耐受。在培养10 h后,突变株B8的 OD660由不加 M2+条件下的2.45提高至2.81。Mg2+可以与细胞表面的电负性的脂多糖LPS螯合,从而减少了细胞膜组分间的电子斥力,使得细胞外膜变的更加稳定,从而更有效的抵抗外界有机溶剂对细胞的破环[22-23]。

图7 Mg2+对突变株B8和对照菌株耐受性的影响Fig.7 Effect of Mg2+on butanol tolerance of B8 and WTstrains
3 结 语
大肠杆菌作为一种常用的平台工程菌株,遗传背景清楚,分子操作相对简单,更有利于工业应用。利用全局转录机制工程来筛选丁醇耐受性菌株作为一种快速有效的方法,为研究细胞复杂生理现象奠定了基础。作者采用随机突变全局转录因子σ70的方法筛选获得了一株能够耐受体积分数2%丁醇的大肠杆菌突变株B8,并对照菌株E.coli JM109/pHACMWT和突变株B8与丁醇耐受相关的性质进行了研究,初步探讨了大肠杆菌丁醇耐受性提高的原因。本研究为有效提高微生物菌株的丁醇耐受性提供了实验依据和理论基础。

