通过提高胞内辅酶水平促进L-苯甘氨酸的合成
刘巧利, 杨套伟, 周俊平, 徐美娟, 张 显, 饶志明
(江南大学 生物工程学院,江苏 无锡214122)
L-苯甘氨酸是一种手性芳香族非天然氨基酸,是合成多种β-内酰胺类抗生素及抗癌药物紫杉醇的重要前体物质[1-4],在医药产业中具有广泛的应用价值。目前主要通过化学方法合成[5],但是化学合成法反应条件剧烈、工艺复杂、副产物较多、产品光学纯度不够,且反应中需用到大量有机试剂和剧毒物质,严重污染环境。通过生物催化法合成L-苯甘氨酸,不仅反应条件温和,绿色环保,而且由于酶的底物特异性和立体选择性,副产物较少,产品可以达到光学纯度,易于分离,可直接用于药物的合成[6]。因此,建立高效的生物催化方法在L-苯甘氨酸的工业生产中具有重要的研究意义。
在之前的研究中,通过在大肠杆菌E.coli BL21(DE3)中共表达来源于蜡样芽孢杆菌的亮氨酸脱氢酶(LeuDH)和来源与博依丁假丝酵母的甲酸脱氢酶(FDH)构建胞内辅酶再生体系,利用重组菌E.coli BL21/pETDuet-ldh-fdh作为催化剂,实现了从苯乙酮酸到L-苯甘氨酸的全细胞转化合成[7]。在类似的全细胞转化体系中,添加胞外辅酶(NAD+)可以有效地提高转化速率[8-9],说明在脱氢酶过表达的情况下,胞内环境存在辅酶供应不足的问题,因此提高胞内辅酶(NAD(H))水平是进一步提高反应速率的有效策略之一。
大肠杆菌中NAD(H)合成途径分为从头合成途径和补救合成途径,见图1。其中烟酸转磷酸核糖基酶(NAPRTase)是补救合成途径的限速酶[10]。通过加强表达NAD(H)合成途径中的关键酶和培养基中添加合成前体物质可有效提高胞内NAD(H)的含量[11]。Berrios-Rivera等[12]在大肠杆菌中表达鼠伤寒沙门氏菌 Salmonella typhimurium来源的NAPRTase基因 (pncB)使胞内NAD+、NADH和总NAD(H)分别提高了 81.8%、29.8%和 41.7%,证明NAPRTase的过表达可有效促进胞内NAD(H)的合成。Witholts等[13]在大肠中过表达自身来源的NAPRTase时,胞内NAD(H)总量提高了5倍。Heuser F等[14]在E.coli中分别过表达 NAPRTase和NAD+合酶时(NAD+Syn),胞内 NAD(H)的总量分别提高了两倍,当同时过表达这两个关键酶基因pncB和nadE时,菌株胞内NAD(H)总量提高了7倍,有效提高了全细胞催化合成(R)-甲基-3-羟基丁胺的反应速率,说明和NAPRTase一样,NAD+Syn也是NAD(H)补救合成途径的限速酶。张鑫等[15]通过在E.coli中过表达pncB和nadE,使全细胞转化合成1,4-丁二醇的转化率提高了13.03%,产物得率提高了40.9%。另外,穆晓清等[16]通过在大肠杆菌中共表达pncB和nadE,在培养基中添加前体物质烟酸(NA)有效地促进了胞内NAD+的合成。
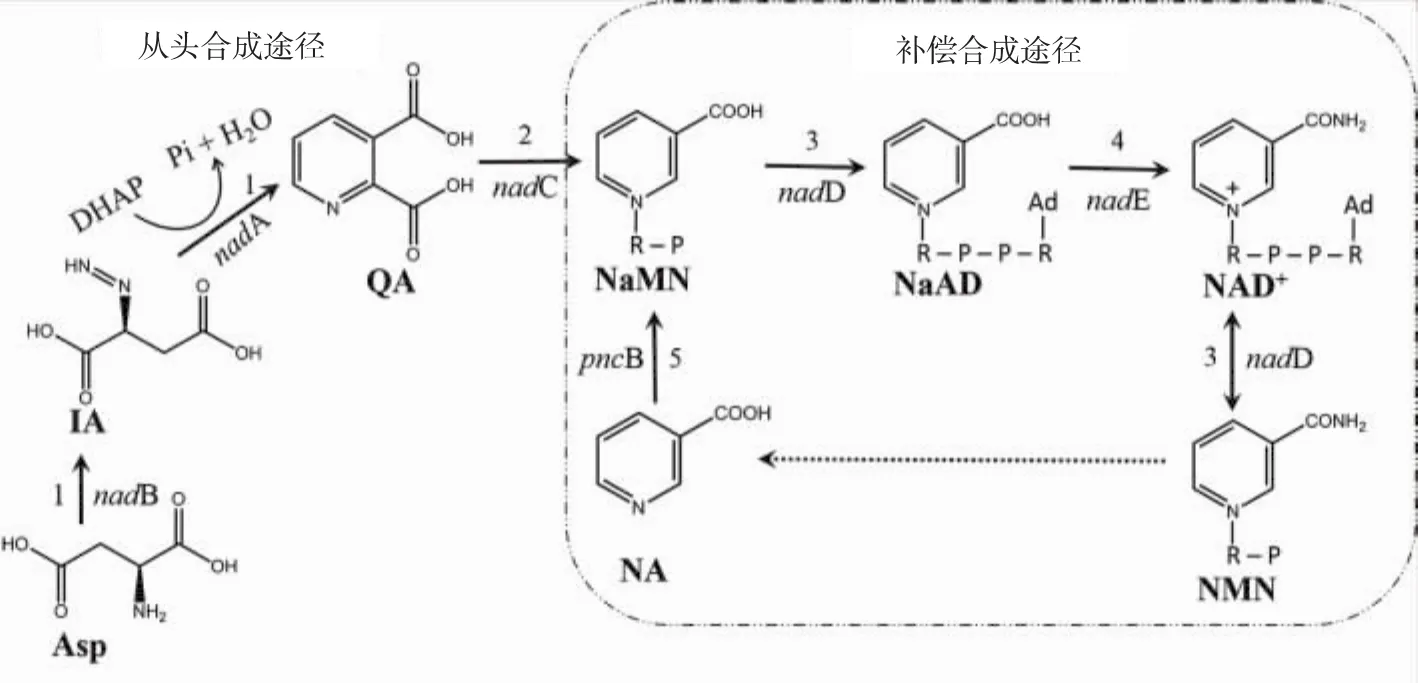
图1 大肠杆菌中辅酶NAD+的从头合成途径及和补救合成途径Fig.1 De novo synthesis pathway and salvage synthesis pathway of coenzyme NAD+in E.coli
基于以上的研究,作者拟在实验室前期构建保藏的L-苯甘氨酸催化合成菌株E.coli BL21/pETDuet-ldh-fdh中共表达NAPRTase和NAD+Syn的编码基因pncB和nadE,并在发酵培养基中添加NA,以期提高重组大肠杆菌胞内NAD(H)的质量摩尔浓度,进而提高全细胞转化苯乙酮酸合成L-苯甘酸的转化效率。
1 材料与方法
1.1 菌株与质粒
本研究所用菌株与质粒见表1。

表1 本研究所用的菌株、质粒和引物Table 1 Strains,plasmids and primers used in this work
1.2 主要试剂与仪器
DL-苯甘氨酸标准品 (纯度>98.5%,D型和L型的比例为1∶1)、苯乙酮酸标准品(纯度>98.5%)以及NAD+、NADH:均购自Sigma Aldrich公司;分子生物学工具酶、DNA Markers:均购自TaKaRa公司;基因组提取试剂盒、DNA回收试剂及质粒提取试剂盒:均购自上海捷瑞生物工程有限公司;辅酶I NAD(H)含量测定试剂盒:购自索莱宝公司;引物合成与核酸序列测定:由上海金唯智生物工程公司完成;其他试剂均购自国药集团。PCR仪:购自 Bio-Rad公司;UVP凝胶成像仪:购自英国UVP有限公司;高速冷冻离心机:购自 HITACHI公司;超声破碎仪:购自SONICS公司;高效液相色谱仪:购自Agilent公司;色谱柱:C18、C8及有机酸柱均购自DIMARK公司。
1.3 重组质粒的构建
根据NCBI中公布的E.coli BL21(DE3)来源的NAPRTase基因 pncB(GenBank 登录号:8113566)和NAD+Syn基因 nadE(GenBank 登录号:8179982)序列设计引物,以E.coli BL21(DE3)基因组为模板,进行PCR扩增,PCR产物pncB和nadE经过试剂盒纯化后,分别连接至克隆载体pMD18-T,转化E.coli JM109,通过氨苄青霉素(Amp)平板筛选阳性转化子,提质粒酶切验证,并进行测序鉴定。目的基因分别与表达载体pACYCDuet-1连接,构建重组质粒pACYCDuet-pncB和 pACYCDuet-nadE,转化 E.coli BL21(DE3)得到重组菌E.coli BL21/pACYCDuetpncB和E.coli BL21/pACYCDuet-nadE,通过氯霉素(Cm)平板筛选阳性转化子。两基因依次连接载体可得重组质粒pACYCDuet-pncB-nadE,转化重组菌E.coli BL21/pETDuet-leudh-fdh,通过Amp/Cm双抗平板筛选阳性转化子,验证正确即得到双质粒共表达重组菌 E.coliBL21/pETDuet-ldhfdh&pACYCDuet-pncB-nadE。
1.4 重组菌的培养及诱导
LB种子培养基:蛋白胨 10 g/L,酵母粉 5 g/L,NaCl 10 g/L,pH 7.0。
发酵培养基:蛋白胨 12 g/L,酵母粉 24 g/L,甘油 5 g/L,KH2PO42.31 g/L,K2HPO412.54 g/L。
各重组菌按照1%的接种体积分数转接入10 mL含相应抗性的种子培养基,37℃、180 r/min下培养10 h。种子液再按照1%的接种体积分数接入发酵培养基,37℃下培养,至菌体OD600为0.3~0.5,加入异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度为 0.5 mmol/L,24 ℃、160 r/min诱导 12 h。
发酵培养基中NA的添加:NA用蒸馏水配成5 g/L的添加液,通过过滤除菌,并低温冷冻保藏,在IPTG诱导培养时加入发酵培养基。
1.5 酶活测定
4℃下离心发酵菌液(8 000 r/min离心5 min),并用0.1 mol/L的磷酸缓冲液(pH 7.0)洗涤细胞两次后,按照10倍浓缩的比例用缓冲液重新悬浮菌体,低温下对菌体进行超声破碎,12 000 r/min离心20 min,得到破碎上清粗酶液,用于SDS-PAGE分析及酶活测定。LeuDH和FDH酶活测定分别参考Ansorge[17]和 Zheng 等[18]的报道,NAPRTase 和 NAD+Syn的酶活测定参考Heuser F等[14]的报道。蛋白质质量浓度检测采用Bradford法[19],以牛血清蛋白BSA为标准品。
1.6 胞内NAD(H)质量摩尔浓度测定
发酵培养基培养各E.coli菌株至对数中后期,取培养液用于测定胞内NAD+和NADH质量摩尔浓度。分别用酸性和碱性提取液提取样品中NAD+和NADH,NADH通过PMS的递氢作用,还原氧化型噻唑蓝(MTT)为甲瓒,在570 nm下检测吸光值;而NAD+可被乙醇脱氢酶还原为NADH,进一步采用MTT还原法检测。
具体操作步骤参考试剂盒说明书及相关参考文献[20-21]。
1.7 细胞浓度及全细胞催化活性的测定
取1 mL菌液用蒸馏水适当稀释,用紫外分光光度计测稀释菌液600 nm下的吸光度 (OD600),细胞干重(DCW)可通过以下公式计算[22]:
DCW(g/L)=0.444 2×OD600-0.021
在全细胞转化中,细胞催化活性定义为反应初始时每克干细胞每分钟催化合成L-苯甘氨酸的量。在全细胞转化反应持续30 min时取样,4℃、10 000 r/min下离心5 min以终止反应,上清液经稀释通过HPLC检测L-苯甘氨酸的产量,用于计算细胞催化活性。
1.8 全细胞法催化合成L-苯苷氨酸
底物苯乙酮酸30 g/L溶于0.1 mol/L pH 7.5的磷酸缓冲液,滴加50%的NH3·H2O使其溶解,同时加入2.4 g甲酸铵及体积分数5%的甘油,最后加入全细胞催化剂 5 g/L(DCW),转化体系为20 mL,置于磁力搅拌器上进行转化,控制温度为30℃,pH 8.0,转速160 r/min,反应过程中通过滴加50%的NH3·H2O或20%的甲酸来调节反应体系的 pH。L-苯甘氨酸的产量及ee值通过HPLC检测,具体方法参考Cheng等[23]的检测方法。
2 结果与讨论
2.1 NAPRTase和NAD合酶基因的克隆及共表达
以大肠杆菌E.coli BL21(DE3)基因组为模板,分别利用引物对P1/P2和P3/P4进行PCR扩增,PCR产物分别为1 203 bp和828 bp,经测序鉴定与NCBI数据库报道pncB和nadE序列一致,通过限制性酶切法将目的基因与表达载体pACYCDuet-1连接,构建重组表达载体,酶切及PCR验证结果见图2,证明NAPRTase和NAD+Syn的重组共表达载体pACYCDuet-pncB-nadE构建成功。将经过诱导培养的各重组菌及原始菌分别超声破碎并离心后,取上清液进行SDS-PAGE分析及酶活测定。SDSPAGE分析结果见图3。
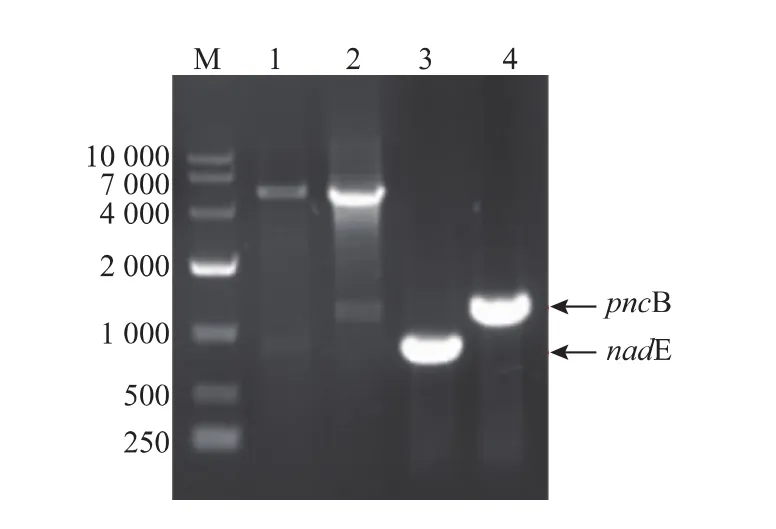
图2 重组载体pACYCDuet-pncB-nadE酶切及PCR验证Fig.2 Restriction and PCR validation of recombinant vector pACYCDuet-pncB-nadE
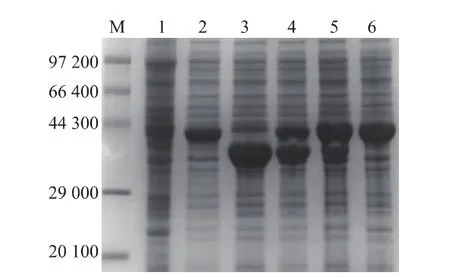
图3 各重组菌的SDS-PAGE分析Fig.3 SDS-PAGE analysis of the recombinant strains
在单表达及单质粒共表达时NAPRTase和NAD+Syn分别在44 100和30 400处有明显的表达条带,在双质粒共表达时,LeuDH、FDH和NAPRTase的相对分子质量差异较小,均位于为40 000附近,因此在共表达SDS-PAGE分析时三者无法区分,NAD+Syn有明显的表达条带,说明通过该双质粒表达系统成功实现了 LeuDH、FDH、NAPRTase和NAD+Syn在E.coli中的共表达。分别测各重组菌粗酶液酶活,以原始菌表达空载pETDuet-1作为对照,结果见表2。重组菌E.coli BL21/pETDuet-ldh-fdh LeuDH酶活为18.78 U/mg,是对照的300多倍,FDH酶活为0.34 U/mg,对照组未检测到FDH酶活;重组菌 E.coli BL21/pACYCDuet-pncB NAPRTase酶活为 2.12 U/mg,是对照的14倍,重组菌 E.coli BL21/pACYCDuetnadE NAD+Syn酶活为1.24 U/mg,是对照的41倍,说明 NAPRTase和NAD+Syn在 E.coli BL21(DE3)中成功过表达。对重组菌E.coli BL21/pETDuetldh-fdh&pACYCDuet-pncB-nadE的酶活分析发现,LeuDH和FDH的酶活与单质粒菌株E.coli BL21/pETDuet-ldh-fdh的酶活差异不明显,而NAPRTase及NAD+Syn的酶活却明显低于重组菌E.coli BL21/pACYCDuet-nadE,但高于对照组,酶活结果与蛋白质表达情况一致,说明该双质粒表达体系中各酶均可以有效表达,且重组质粒pACYCDuet-pncB-nadE的表达对参与转化的LeuDH和FDH的表达影响不大,可能的原因是pET质粒的ColE1复制子强度大于pACYC质粒的p15A复制子[24]。
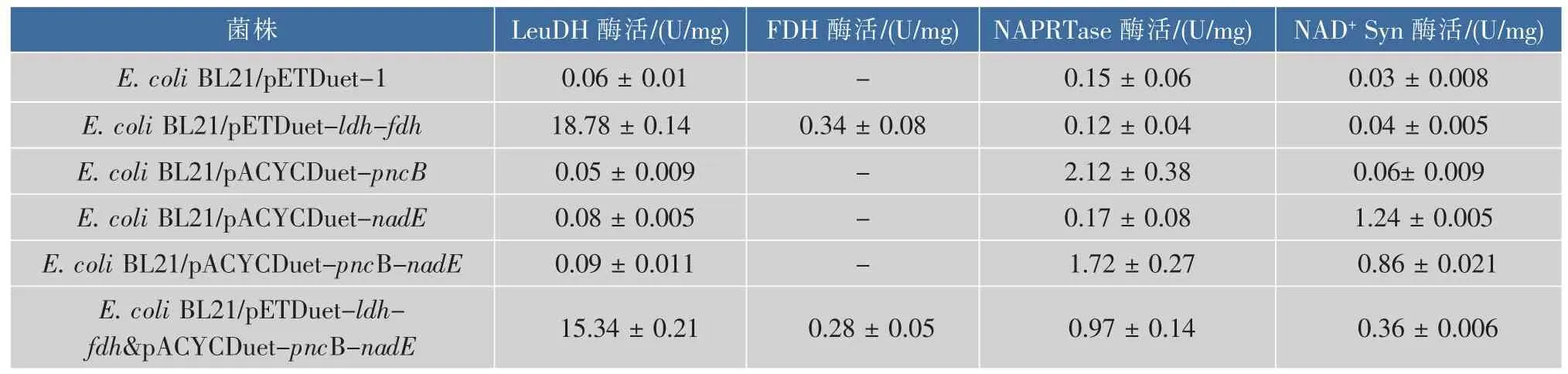
表2 不同菌株的酶活Table 2 Enzyme activities in different strains
2.2 NAPRTase和NAD合酶的表达对菌体生长及胞内辅酶的影响
各重组菌株经37℃活化后,于24℃下诱导培养12 h,首先通过紫外分光光度计测其细胞浓度(OD600),并计算细胞干重,之后收集菌体检测胞内NAD(H)质量摩尔浓度,结果见表3。基因pncB和nadE在大肠杆菌中的过表达分别使提高胞内NAD(H)质量摩尔浓度提高了86.3%和59.3%,当两者共表达时则提高了2.92倍,双质粒重组菌E.coli BL21/pETDuet-ldh-fdh&pACYCDuet-pncB-nadE胞内NAD(H)质量摩尔浓度较重组菌E.coli BL21/pETDuet-ldh-fdh提高了2.35倍,但是NADH/NAD+的值在各重组菌中波动不大,说明pncB和nadE的过量表达均可促进胞内NAD+的合成,使得胞内NAD(H)质量摩尔浓度显著提高,并不会造成胞内氧化还原态失衡,且两者对NAD+合成的促进作用具有累加效应。另外,pncB和nadE过表达的重组菌生物量均不同程度地高于对照菌株,说明胞内NAD(H)质量摩尔浓度的提高对细胞生长具有一定的促进作用,可能是因为胞内NADH质量摩尔浓度的提高增加了细胞生长的能量供给。
2.3 烟酸质量浓度对菌体生长及胞内辅酶的影响
为了进一步提高胞内辅酶水平,在发酵培养基中添加不同质量摩尔浓度的NAD+补救合成途径前体物质NA,分别测定重组菌E.coli BL21/pETDuetldh-fdh&pACYCDuet-pncB-nadE细胞浓度与胞内NAD+质量摩尔浓度,结果见图4。当NA质量浓度≤20 mg/L时,胞内NAD+质量摩尔浓度随NA质量浓度的增加而提高,当NA质量浓度为20 mg/L,胞内NAD+质量摩尔浓度最高为25.2 μmol/g DCW,比不添加NA时提高了2.42倍,当NA质量浓度继续增加时,NAD+质量摩尔浓度则逐渐下降,说明过量的NA不利于NAD+的合成。同时考察了NA质量浓度对菌体生长的影响,当NA质量浓度<20 mg/L时,菌体量随NA质量浓度的增加而增加,可能与胞内NAD+质量摩尔浓度的增加相关,但是当NA质量浓度进一步增加时,菌体生长明显受到抑制,说明过量的NA不利于菌体的生长和胞内辅酶水平的提高,因此发酵培养基中NA的最佳添加质量浓度为20 mg/L。同时发现NA的添加对重组菌E.coli BL21/pETDuet-ldh-fdh胞内NAD+质量摩尔浓度没有显著的提高作用,说明胞内辅酶水平的提高是胞外NA的添加和胞内pncB、nadE过表达共同作用的结果。
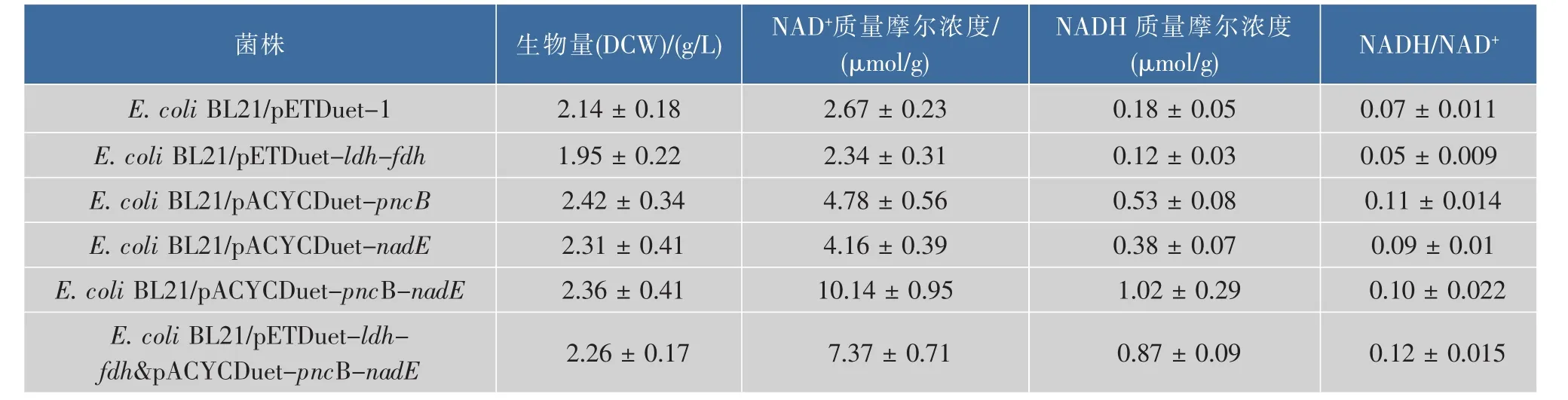
表 3 各重组菌的生长情况及胞内NAD(H)含量测定Table 3 Growth and intracellular NAD(H)concentration of different recombinant strains
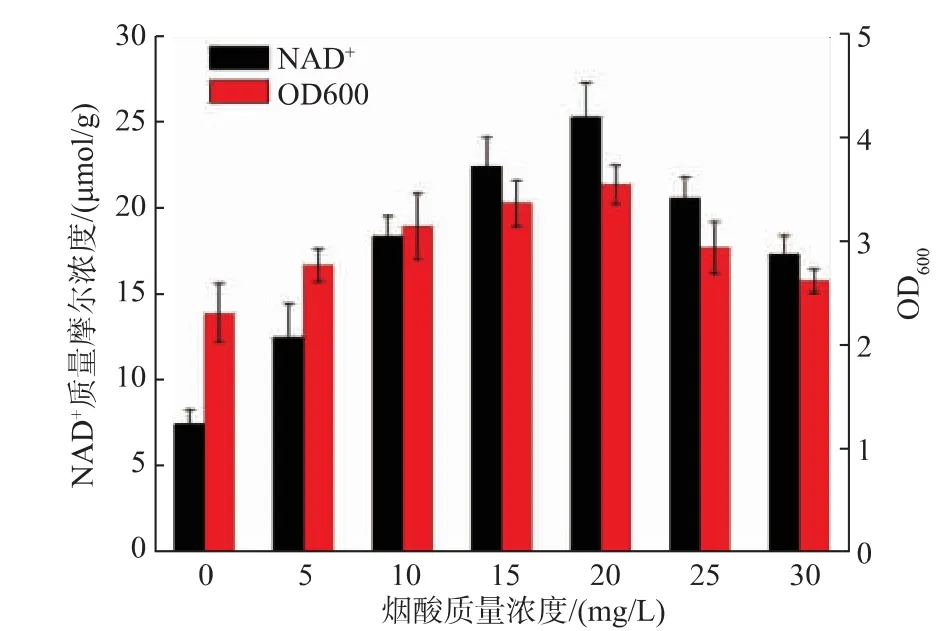
图4 烟酸质量浓度对菌体生长及胞内NAD+摩尔浓度的影响Fig 4 EffectofNA concentration on growth and intracellular NAD+concentration
2.4 胞内辅酶水平对全细胞转化的影响
将重组菌E.coli BL21/pETDuet-ldh-fdh和E.coli BL21/pETDuet-ldh-fdh&pACYCDuet-pncB-nadE分别活化,并分别转接于添加20 mg/L的NA和不添加NA的发酵培养基中进行诱导,4℃离心,收集菌体用于L-苯甘氨酸的转化合成,分别检测不同菌株于不同培养基条件下的细胞催化活性,结果见图5(a)。在发酵培养基中未添加NA时,重组菌E.coli BL21/pETDuet-ldh-fdh&pACYCDuet-pncB-nadE的细胞催化活性比菌株E.coli BL21/pETDuetldh-fdh提高了56.5%,而当发酵培养中添加20 mg/L NA时,前者的细胞催化活性进一步提高了34.2%,而后者则提高不明显,这与pncB和nadE的过表达及发酵培养基中NA的添加对胞内辅酶水平的调节作用一致,说明胞内pncB和nadE的过表达及胞外NA的添加共同通过提高胞内辅酶水平来提高细胞催化活性。分别以不添加NA诱导的菌株E.coli BL21/pETDuet-ldh-fdh和添加NA诱导的菌株E.coli BL21/pETDuet-ldh-fdh&pACYCDuet-pncB-nadE为全细胞催化剂,在底物质量浓度为30 g/L,细胞质量浓度为5 g/L(DCW)的条件下,进行L-苯甘氨酸的转化反应,结果见图5(b)。与单质粒表达菌株相比,双质粒菌株全细胞转化苯乙酮酸的转化率提高了36.6%,L-苯甘氨酸的产量从16.7 g/L提高至23.9 g/L,说明胞内辅酶水平的提高可以显著提高全细胞催化活性,最终提高全细胞转化效率和L-苯甘氨酸的产量。
3 结 语
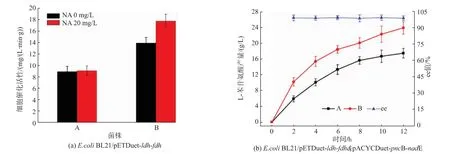
图5 胞内辅酶水平提高对全细胞转化的影响Fig.5 Effect of intracellular cofactor level on the whole cell biotransformation
在重组大肠杆菌中过表达NAPRTase和NAD+Syn的编码基因pncB和nadE,不仅可以有效地促进胞内NAD+的合成,提高胞内辅酶水平,并对菌体生长具有一定的促进作用,且两者对NAD+合成的促进作用具有累加效应。发酵培养基中添加20 mg/L的NAD+补救合成途径前体物质NA使得胞内辅酶水平进一步提高,最终将重组菌E.coli BL21/pETDuet-ldh-fdh&pACYCDuet-pncB-nadE用于全细胞转化合成L-苯苷氨酸,其细胞催化活性和转化率分别比重组菌E.coli BL21/pETDuet-ldh-fdh提高了94%和36.6%,说明在辅酶依赖型的全细胞转化体系中,胞内辅酶水平的提高可以有效地提高转化效率。

