胰腺腺鳞癌2例报告及文献综述
季月辉,王小明
目前,胰腺癌的发病率正在逐渐上升,严重威胁着人们的健康,作为病死率较高的恶性肿瘤之一,5年生存率小于5%[1-3]。其中胰腺腺鳞癌(adenosquamous carcinoma,ASC)则较少见,胰腺腺鳞癌又称腺棘癌(adenoacanthoma)、黏膜表皮样癌(mucoepidermoid),是侵袭性强的胰腺恶性肿瘤,约占胰腺外分泌肿瘤的1%~4%[4]。笔者收集了2例经病理确诊的胰腺腺鳞癌的临床资料。结合相关文献进行分析讨论,旨在提高认识及诊治水平。
1 资料与方法
1.1 一般资料分别收集皖南医学院弋矶山医院肝胆外科2014年3月和2015年1月收治的胰腺腺鳞癌2例临床病例资料,均经手术后病理证实,其中男女各1例。病例1:女性,47岁,首要症状是反复上腹部胀痛不适20余天。体格检查主要为上腹部轻压痛,无明显反跳痛,未触及肿块。术前主要的血生化及血清学肿瘤标志物结果为:清蛋白(ALB):34.8 g/L,丙氨酸氨基转移酶(ALT):34 U/L,天冬氨酸氨基转移酶(AST):26 U/L,总胆红素(TBil):23.43μmol/L,直接胆红素(DBil):11.39 μmol/L,淀粉酶(AMY):6.0 U/L,癌胚抗原(CEA):6.81 μg/L(0~5 μg/L),糖类抗原199(CA199)82.54 U/mL(0~37 U/mL)。术前腹部增强CT示:胰腺头部占位。后行腹部磁共振成像(MRI)示:胰头钩突增大,其内信号不均匀,考虑癌可能,伴胆道系统扩张,积气,胰管扩张(图1)。病例2:男性,51岁,系因上腹部不适伴巩膜黄染、尿黄1周余入院。入院后主要的体格检查为上腹部深压痛,无反跳痛,未触及肿块。术前主要的血生化及血清学肿瘤标志包括TP:64 g/L,ALB:37.3 g/L,TBil:182.75 μmol/L,DBil:107.66 μmol/L,CEA:3.02 μg/L(0~5 μg/L),CA199:137.62 U/mL(0~37 U/mL),术前MRCP提示:胆道系统扩张,至胆总管下端变细,胰腺头部信号不均(图2A和图2B)。术后复查腹部CT示:腹部术后改变,胰头切除,局部结构紊乱,胰周可见轻度渗出积液影(图2C)。本研究符合《世界医学协会赫尔辛基宣言》相关要求,病人或近亲属均签署知情同意书。

图1 胰腺腺鳞癌病例1影像图:A为术前CT;B为术前MRI

图2 胰腺腺鳞癌病例2影像图:A为术前MRCP;B为MRCP胆管成像;C为术后CT
1.2 治疗方法两例病人入院后完善相关检查,均行手术治疗。其中病例1行完全腹腔镜下胰十二指肠切除术,术后第3天查腹腔引流管内引流液AMY不高,病人无明显发热,术后第7天经腹腔引流管注入造影剂,未见腹腔弥漫及肠管显影(图3A)。病例2因癌肿较大与血管粘连较密切,行腹腔镜辅助下胰十二指肠切除术,术后第3天查腹腔引流管引流液AMY偏高,无明显发热,术后第13天经左侧腹腔引流管注入造影剂,造影剂进入腹腔弥漫,未见明显肠管显影,未见胰瘘,术后一月余腹腔包裹性积液从切口溢出,为胆汁样,查AMY不高,后经腹腔冲洗后愈合(图3B)。两例术后均行吉西他滨+氟尿嘧啶+四氢叶酸法化疗,每周1次,4周为一个周期。其中病例1共化疗了6个周期,病例2共化疗了3个周期。

图3 胰腺腺鳞癌病例1(A)和病例2(B)术后经腹腔引流管造影情况
2 结果
2.1 术后病理两者术后病理均确诊为胰腺腺鳞癌,肿瘤组织既可见导管腺癌成分又可见鳞状细胞成分,部分癌组织排列成不规则腺管样结构,部分癌巢可见角化珠。具体如下:
病例1术后病理示:胰腺腺鳞癌:腺癌中分化30%,鳞癌高中分化占70%,肿瘤直径约4.5 cm,神经见侵犯,脉管见侵犯,十二指肠壁、胆总管及胆囊、标本上下切缘及胰腺切缘均未见癌侵犯(图4A),免疫组织化学标记结构为:AE1/AE3(+)、P63(+)、P40(+)、CK7:部分(+)、CK20部分(+)、CEA(+)、CA199(+)、Ki-67:40%(+)(图5)。
病例2术后病理示:胰腺腺鳞癌(腺癌细胞约占30%,鳞癌细胞约占70%),癌肿大小约 4.2 cm×3.5 cm×2.8 cm,癌组织侵及十二指肠黏膜层,神经见侵犯,脉管内未见癌栓,标本切缘未见癌累及,胰腺周围找见淋巴结4枚,未见癌转移,网膜组织未见癌累及。免疫组织化学标记结果为:AE1/AE3(+)、MEA(+)、P63(+)、P40(+)、CK7:部分(+)、CK20部分(+)、CEA(+)、CA199(+)、Ki-67:40%(+)(如图4B和图6)。

图4 胰腺腺鳞癌病例1(A)和病例2(B)术后病理图(HE染色×400)
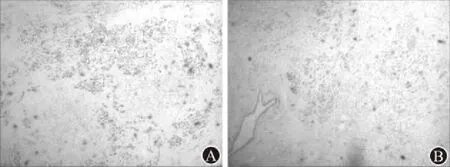
图5 胰腺腺鳞癌病例1术后病理免疫组化:A为P63(×100);B为Ki-67(×100)
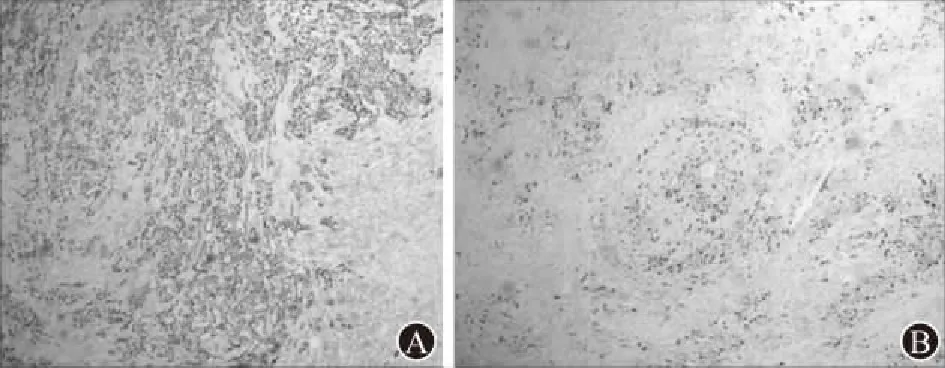
图6 胰腺腺鳞癌病例2术后病理免疫组化:A为P63(×100);B为Ki-67(×100)
2.2 术后随访及预后术后每个月均对病人进行随访。其中病例1自2014年3月收治随访至2016年1月因肿瘤复发死亡。病例2自2015年1月收治随访至2015年11月因肝脏多发转移于术后第10个月死亡。
3 讨论
胰腺腺鳞癌是临床上少见的恶性肿瘤之一,是由腺癌和鳞癌成分混合形成。有学者认为在胰腺腺鳞癌中,鳞状上皮占比≥30%[5]。与导管腺癌相比,其预后更差[6]。目前其形成主要有3种学说[7-8]:(1)慢性胰腺炎反复刺激或肿瘤阻塞导致胰腺导管上皮发生鳞状上皮化生形成鳞癌;(2)干细胞分化学说:干细胞可同时分化出腺上皮和鳞状上皮细胞;(3)碰撞学说:腺癌组织和鳞癌组织恰好在某一时刻同时出现,两种癌组织混合在一起。本研究中1例术中发现肿瘤侵犯血管,并与周围组织粘连较重。腹腔镜下难以剥离癌肿,遂行中转开腹手术。胰腺腺鳞癌较导管腺癌预后不佳的原因之一在于其呈侵袭性生长,早期出现淋巴结转移、血管侵犯[9-10]。宋彬等[11]研究指出该病术后中位生存期为6个月,少数病人生存期超过1年。
胰腺腺鳞癌病人可无明显症状,可出现黄疸,部分病人仅有腹胀不适症状。其术前诊断困难,因穿刺活检难度大且有胰瘘、损伤腹腔大血管的风险,并发症多。目前主要靠手术后病理确诊,此时病人也已手术完,大多处于中晚期。经查阅相关文献,鳞癌较腺癌易发生坏死,可形成空洞,腺体分泌黏液,故可形成囊腔,内可含囊液。粘液的密度稍高于水,在CT,MRI等影像学上可呈现囊样密度影和强化不等的囊壁,以此可作为胰腺腺鳞癌术前诊断的重要线索[12-13]。另外CT,MRI等影像学检查还可以评估癌肿大小和浸润深度。
综上所述,定期体检,早期发现,早期诊断,早期治疗是预防的关键。目前手术仍是提高病人生存时间和改善病人生活质量的治疗方法[14-15],术后应辅以化疗和放疗来提高疗效。但即使对病人进行根治性手术,病人的生存率和预后并未得到明显改善。常见于术后肿瘤的复发或肝脏、腹腔的转移加速了病人的死亡。笔者近3年来仅仅收集了2例胰腺腺鳞癌病人,由于样本量较少,得到的结论尚不够完善。未来我们需要更多的样本来进一步总结规律和经验,提高胰腺腺鳞癌诊断和治疗水平。

