吴茱萸碱、小檗碱对SGC-7901/DDP耐药性及耐药相关蛋白的影响*
孙梦瑶,王丹丹,吴秋雪,倪振华,汤庆丰**
(1.上海中医药大学附属普陀医院 上海 200062;2.上海中医药大学交叉科学研究院 上海 201203)
胃癌是临床常见的消化系统恶性肿瘤,其发病率和死亡率均较高,据统计,全球每年胃癌死亡病例约为70万例,在恶性肿瘤中高居第2位[1]。胃癌目前总体治疗效果不理想,5年生存率低于30%[2]。手术切除是治疗胃癌的首选方法,但手术切除仅适用于胃癌早期患者。由于胃癌起病隐匿,很多患者确诊时已经处于晚期。化疗是当前临床治疗肿瘤的重要手段。然而,长期化疗出现的肿瘤多药耐药(multidrug resistant,MDR)严重影响了胃癌治疗效果[3]。因此,探索新的逆转化疗耐药、提高化疗药物敏感性的药物具有重要意义。
肿瘤多药耐药是多种基因调控、多种途径联合作用的网络化调节的结果。肿瘤细胞可通过不同途径导致MDR的产生,且单个MDR细胞也可同时存在多种耐药性的机制[4]。现有的针对特定靶点的经典的化学逆转剂如P-gp抑制剂奎尼丁等在与抗肿瘤药物联合用药时通常会产生严重的副作用,限制了其临床应用[5]。随着中药抗肿瘤研究的发展,传统中药提取物和中药单体作为MDR的逆转剂得到了广泛关注。中药提取物和中药单体不仅既有多靶点的特性使其具备抗肿瘤活性又兼具逆转耐药作用,还具有低毒的独特优势,从而为MDR提供了新的治疗途径[6]。例如人参皂苷Rg3是从我国传统中药人参中提取的单一成分,对结肠癌、肝癌多种恶性肿瘤均具有显著抑制作用。人参皂苷Rg3不仅具有显著的抗癌效果[7,8],还可与常规的治疗方式联用起到增效减毒,逆转化疗耐药和提高患者免疫力等作用[9,10]。Zhi Zhen Fang提取物可抑制Hedgehog信号通路逆转结肠癌化疗耐药[11]。
左金丸是中医经典方剂,出自元代著名医家朱丹溪《丹溪心法·火方》,方中黄连六两、吴茱萸一两,常用于胃部疾病[12]。现代药理研究表明,左金丸具有抑制胃癌细胞增殖、诱导胃癌细胞凋亡等作用[13-15]。除此之外,研究发现左金丸可通过调节Cofilin-1的线粒体转位增加胃癌顺铂耐药细胞对DDP的敏感性[15]。然而,尽管左金丸对胃癌顺铂耐药具有明显的抑制作用,但其目前存在药效物质基础及分子机制不明确的情况,限制了左金丸在临床胃癌治疗中的广泛应用。很多研究表明黄连和吴茱萸中所含的吴茱萸碱与小檗碱具有多种抗肿瘤作用,包括抑制肿瘤细胞生长、诱导肿瘤细胞凋亡、减少肿瘤的恶性转化和转移等[16-18]。联合使用这两种成分在胃癌中有明显的协同抗肿瘤细胞增殖与转移的效果[19]。不仅如此,吴茱萸碱、小檗碱可通过诱导活性氧(reactive oxygen species,ROS)、促进凋亡对多种人类肿瘤细胞具有放化疗增敏作用[20,21]。然而,吴茱萸碱、小檗碱对胃癌顺铂耐药的抑制作用尚不清楚。因此,本文旨在探讨吴茱萸碱和小檗碱单用及合用对胃癌耐药细胞DDP敏感性的影响及其可能的机制,以期为临床胃癌的防治提供一定的线索。
1 材料与方法
1.1 材料
吴茱萸碱、小檗碱(成都瑞芬思生物科技有限公司);DDP(美国Sigma公司);DMSO(美国Sigma公司);RPMI 1640(美国Hyclone公司);胎牛血清(FBS)(美国Gibco公司);青链霉素(美国Invitrogen公司);Trypsogen-EDTA(0.25%)(美国Invitrogen公司);磷酸缓冲盐溶液PBS(美国Hyclone公司);细胞冻存液(美国Invitrogen公司);CCK-8(日本同仁公司);RIPA组织细胞快速裂解液(上海碧云天生物技术有限公司);BCA蛋白浓度测定试剂盒(美国Thermo公司);PVDF膜(美国Millipore公司);蛋白预染Marker(加拿大Fermentas公司);Anti-P-gp(ab103477)、MRP(ab24102)、Caspase-3(ab13847)、Caspase-9(ab52298)(英 国Abcam公司);Anti-GAPDH(5174)(美国CST公司)。羊抗兔HRP标记二抗、羊抗小鼠HRP标记二抗(上海碧云天生物技术有限公司);ECL发光液(美国Millipore公司)。
1.2 仪器
CO2恒温培养箱(美国Thermo公司);生物安全柜(Haier公司);倒置相差显微镜(德国Leica公司);离心机(德国Eppendorf公司);微量移液器(德国Eppendorf公司);电子天平(Sartorius公司);酶标仪(美国Bio-rad公司);制冰机(美国Thermo公司);电泳仪(美国Biorad公司);电泳槽(美国Bio-rad公司);转膜仪(美国Bio-rad公司);Western blotting成像系统(上海天能科技有限公司)。
1.3 方法
1.3.1 细胞培养
采用逐步递增DDP浓度的方法诱导人胃癌耐药细胞SGC7901/DDP。细胞所用培养基为90%RPMI 1640、10%FBS、1%双抗和800 ng·mL-1DDP。细胞于37℃,5%CO2的培养箱中进行培养,每日观察细胞生长情况,取生长状态良好的细胞用于实验。
1.3.2 药物处理
吴茱萸碱、小檗碱,DMSO配制储备液,混合均匀后,过滤器过滤。给予药物处理时,用细胞培养基将药物储备液稀释成所需浓度。
1.3.3 CCK-8实验
将处于对数生长期的细胞经胰蛋白酶消化,显微镜下计数后以5×104个·mL-1的细胞密度铺于96孔细胞培养板。实验分为对照组、DDP组、吴茱萸碱+DDP组、小檗碱+DDP组及吴茱萸碱+小檗碱+DDP组。每组设置6个平行孔,以100 L培养液做空白对照,37℃培养过夜。CCK-8实验检测开始时,按1∶10体积比混合CCK-8和无血清培养基RPMI-1640,在每待测孔中加入100 L,继续在37℃细胞培养箱内孵育1-2 h。在酶标仪450 nm波长处测定各孔吸光值(OD值),并记录每块板的数值。
1.3.4 Western blot
将需要抽提蛋白的细胞用适量预冷的1×PBS洗涤2次后,加入蛋白裂解液(含有蛋白酶抑制剂和磷酸酶抑制剂),4℃下充分裂解细胞,然后将细胞刮入离心管中,12000 rpm离心10分钟,取上清,BCA法测定蛋白质浓度。各蛋白样品加入适量上样缓冲液,95℃以上加热10分钟进行蛋白变性,贮存于-20℃或-80℃冰箱。根据目的蛋白的分子量选择下层分离胶。P-gp蛋白分子量为170 kDa,MRP蛋白分子量为190 kDa,caspase-3蛋白分子量为34 kDa,caspase-9蛋白分子量为46 kDa,GAPDH蛋白分子量37 kDa,故选用8%和10%的凝胶。将准备好的蛋白样品依次上样,每孔上样量20 g。电泳至目的蛋白可以区分即停止电泳。转膜及封闭后,孵育一抗(根据说明书稀释抗体),4℃下孵育过夜后,TBST洗脱三次,10 min·次-1。室温条件下孵育HRP标记的二抗(根据说明书稀释抗体)1-2小时,TBST洗脱三次,10 min·次-1。取适量ECL发光液显色,扫膜。
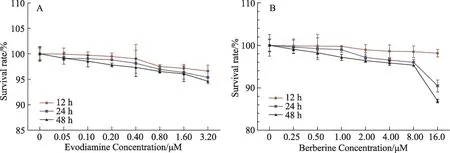
图1 吴茱萸碱、小檗碱对SGC-7901/DDP细胞活力的影响
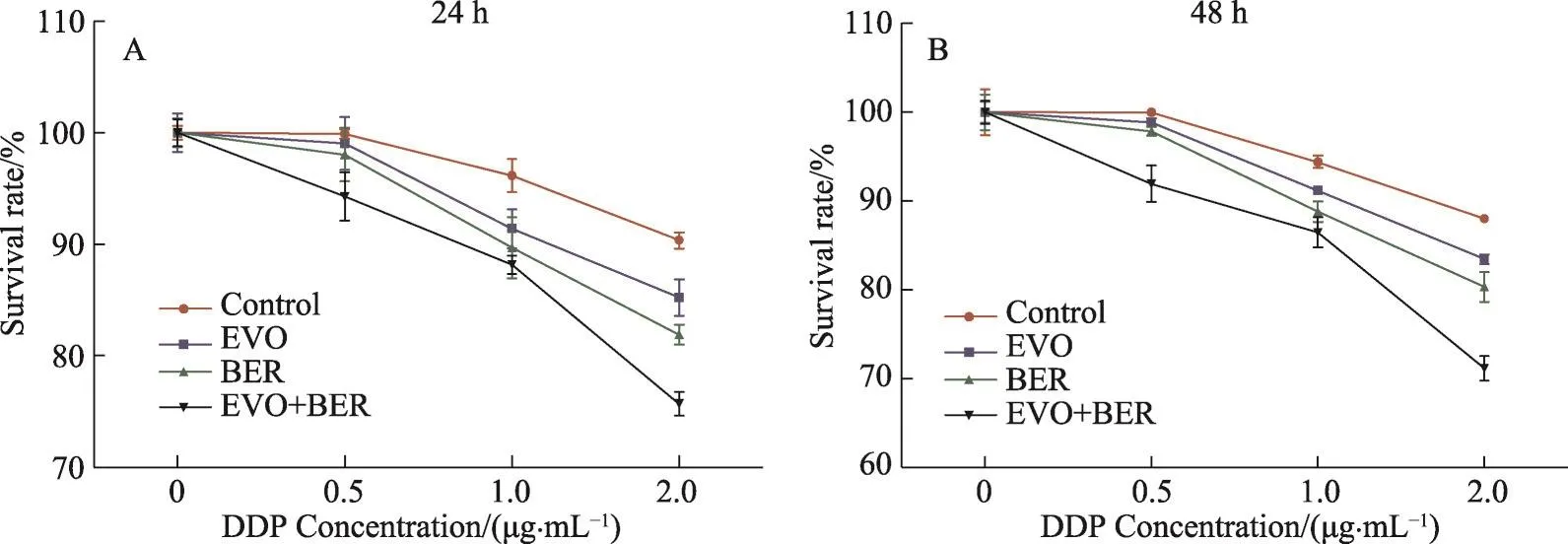
图2 吴茱萸碱、小檗碱增加SGC-7901/DDP对DDP的敏感性
1.3.5 统计学分析
实验数据均以均数±标准差表示,采用t检验比较两组间的差异,方差分析(ANOVA)进行多组间的比较。P<0.05被认为有统计学差异。采用GraphPad Prism 5.01软件进行统计分析。
2 结果
2.1 吴茱萸碱、小檗碱对SGC-7901/DDP细胞活力的影响
培养的SGC7901/DDP细胞接种于96孔板后,分别经不同浓度的吴茱萸碱(0,0.05,0.1,0.2,0.4,0.8,1.6,3.2 M)或小檗碱(0,0.25,0.5,1,2,4,8,16 M)处理,每组为6个复孔,处理时间为12 h,24 h和48 h。如图1A、B所示,CCK8实验检测SGC-7901/DDP细胞活力变化表明吴茱萸碱、小檗碱对SGC-7901/DDP细胞活力的抑制作用呈现时间-和剂量-依赖性。当药物处理时间为24 h、48 h,小檗碱组(8 M)及吴茱萸碱组(3.2 M)与对照组(0 M)相比,细胞抑制率低于5%。
2.2 吴茱萸碱、小檗碱增加SGC-7901/DDP对DDP的敏感性
选择对SGC7901/DDP细胞增殖没有显著抑制(抑制率低于5%的浓度)的吴茱萸碱(3.2 M)及小檗碱(8 M)浓度分别与顺铂(0,0.5,1,2 g·mL-1)共同孵育SGC7901/DDP细胞24 h或48 h,CCK8检测结果显示,吴茱萸碱(EVO)处理24 h后,DDP对耐药细胞株SGC7901/DDP的半数抑制浓度(IC50)由7.45 g·mL-1变为7.364 g·mL-1,EVO处理48 h后,DDP对耐药细胞株 SGC7901/DDP 的 IC50( g·mL-1)由 7.041 变为6.389。小檗碱(BER)处理24 h后,DDP对耐药细胞株SGC7901/DDP的IC50( g·mL-1)由7.45变为6.416,BER处理48 h后,DDP对耐药细胞株SGC7901/DDP的IC50( g·mL-1)由7.041变为5.862。BER和EVO联合处理24h后,DDP对耐药细胞株SGC7901/DDP的IC50( g·mL-1)由7.45变为5.065,48 h后DDP对耐药细胞株SGC7901/DDP的IC50( g·mL-1)由7.041变为4.515(图2,表1,表2)。以上结果表明吴茱萸碱、小檗碱单用或联合使用可增加人胃癌耐药细胞株SGC-7901/DDP对DDP的敏感性,吴茱萸碱和小檗碱合用增加SGC-7901/DDP对DDP的敏感性的效果显著优于二者单独使用。
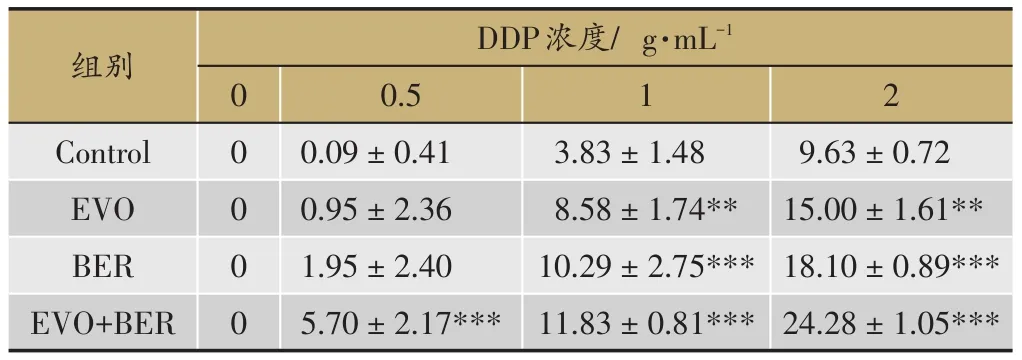
表1 处理24 h各组细胞抑制率比较(Mean±SD,n=6)
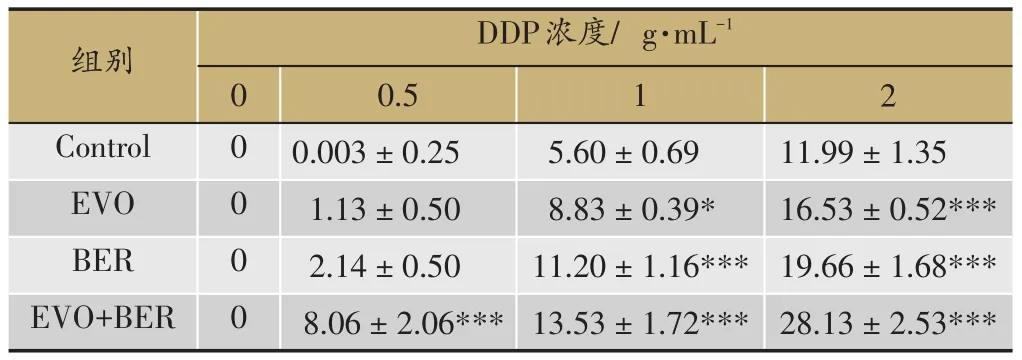
表2 处理48 h各组细胞抑制率比较(Mean±SD,n=6)
2.3 吴茱萸碱、小檗碱对SGC-7901/DDP耐药及凋亡相关蛋白表达的影响
吴茱萸碱(3.2 M)和小檗碱(8 M)分别与1 g·mL-1浓度的顺铂共同孵育SGC-7901/DDP细胞48 h,Western blot检测各组P 糖蛋白(P-glycoprotein,P-gp)、MDR 相关蛋白(multidrug resistance-associated protein,MRP)、caspase-3、caspase-9的表达。相比于Control组,DDP组P-gp、MRP蛋白的表达显著升高(图3)。而加入吴茱萸碱或小檗碱则可显著抑制DDP诱导的P-gp、MRP蛋白表达升高,并提高caspase-3、caspase-9的蛋白表达。DDP+EVO+BER组P-gp、MRP蛋白的表达显著低于DDP+EVO(P<0.001)和DDP+BER组(P<0.001),DDP+EVO+BER组caspase-3、caspase-9蛋白的表达明显高于DDP+EVO(P<0.001)和DDP+BER组(P<0.001)。
3 讨论
吴茱萸碱是来源于中药吴茱萸的天然生物碱,具有多种生物学和药理学效应。吴茱萸碱可诱导SGC7901细胞周期G2/M期阻滞、促进凋亡相关蛋白caspase-3、caspase-8、caspase-9的表达[22]。Hu等[23]发现口服吴茱萸碱能显著减小肝癌荷瘤小鼠肿瘤的大小。这一过程与吴茱萸碱激活WW结构域的氧化还原酶相关。吴茱萸碱还可通过下调MMP-9、尿激酶型纤溶酶原激活物(uPA)和uPAR的表达抑制乳腺癌细胞MDA-MB-231的迁移和侵袭[24]。更值得关注的是,吴茱萸碱对多种化疗耐药的肿瘤细胞有显著的抑制作用,吴茱萸碱联合化疗药物可极大地增强抗肿瘤作用。有研究[25]表明吴茱萸碱通过诱导G2/M期细胞周期阻滞,抑制人上皮性卵巢癌细胞和耐药性人上皮性卵巢癌细胞增殖,此外,吴茱萸碱抑制耐药卵巢癌细胞P-gp蛋白的表达和功能从而改善卵巢癌细胞化疗耐药性。体内外研究发现,吴茱萸碱还可调节NF-κB磷酸化及药物外排功能,增强奥沙利铂、长春新碱、顺铂和5-氟尿嘧啶的抗肿瘤细胞增殖活性,在一定程度上逆转肿瘤细胞的化疗抵抗[26]。

图3 各处理组P-gp、MRP、caspase-3、caspase-9蛋白的表达
小檗碱是一种植物来源的异喹啉类生物碱,由于其低毒性和抗癌特性,小檗碱具有作为化疗佐剂的潜力[27]。大量研究表明小檗碱可通过诱导caspase家族蛋白引起肿瘤细胞凋亡的发生,可上调p53蛋白阻滞肿瘤细胞周期,从而抑制肿瘤细胞增殖[28]。此外,小檗碱与长春新碱、伊立替康、顺铂等化疗药物联合用药在肿瘤治疗过程中可起到协同作用[29,30]。小檗碱联合顺铂孵育的卵巢癌耐药细胞A2780/DDP的存活率显著低于对照组。小檗碱通过上调miR-93的表达从而激活/PTEN/Akt信号通路,增强顺铂诱导的A2780/DDP细胞凋亡[31]。小檗碱还可抑制NF-κB活化增强5-氟尿嘧啶(5-FU)、阿霉素及CPT-11诱导的细胞凋亡[29,32],从而增强肿瘤细胞对化疗药物的敏感性。You等[33]发现施加小檗碱可激活SGC-7901/DDP细胞中miR-203/Bcl-w凋亡信号通路,增强胃癌顺铂耐药细胞对DDP的敏感性。
DDP是临床治疗胃癌的一线化疗药物,然而胃癌化疗DDP耐药是胃癌治疗过程中的重大挑战。在本项研究中我们发现低浓度的吴茱萸碱、小檗碱在不抑制胃癌耐药细胞增殖的情况下(抑制率低于5%)可诱导SGC-7901/DDP对DDP的敏感性,与前期研究结果一致[33]。相对于小檗碱、吴茱萸碱单独使用,本研究发现吴茱萸碱、小檗碱联合使用抑制SGC-7901/DDP铂耐药效果更佳。这也提示我们,基于中药单体化合物相互协调、互补或制约等效应,中药单体的协同使用相比于现行的单体制剂具有其独特的优势。因此,中药单体的配伍模式在肿瘤治疗方面具有较好前景。
目前关于肿瘤化疗耐药的机制研究假说主要包括药物外排增加及代谢异常,增加DNA损伤修复及减少细胞凋亡,缺氧及缺氧诱导因子-1α(HIF-1α),上皮细胞向间质细胞转化等[34]。P-gp是ATP结合性盒型转运蛋白超家族(ATP-binding cassettetransporterssuperfamily,ABC转运体)蛋白,由多药耐药基因(MDR)编码。P-gp具有能量依赖性“药泵”功能,单一药物的长期治疗可激活细胞膜P-gp的功能,将药物从脂质双分子层转运到细胞外,降低细胞内药物浓度,从而导致肿瘤多药耐药[35]。MRP是多药MDR形成机制之一,属于ABC转运体蛋白,主要通过介导抗癌药物在细胞内外的转运而形成耐药[36]。有文献报道,在人体胃癌组织的耐药组织中P-gp和MRP的阳性率明显高于药物敏感的组织,提示P-gp和MRP与胃癌的多药耐药相关[37]。因此本研究采用Western blot检测了吴茱萸碱和小檗碱对胃癌耐药细胞P-gp、MRP表达的影响。我们发现吴茱萸碱和小檗碱可显著抑制DDP诱导的P-gp、MRP蛋白表达升高。且DDP+EVO+BER组P-gp、MRP蛋白的表达显著低于DDP+EVO(P<0.001)或DDP+BER组(P<0.001)。这表明吴茱萸碱和小檗碱抑制P-gp、MRP蛋白的表达是其逆转胃癌耐药细胞化疗耐药的机制之一。除此之外,肿瘤细胞对凋亡的耐受也是MDR的重要机制之一。本研究发现,相对于DDP组,DDP+BER组和DDP+EVO组凋亡相关蛋白caspase-3、caspase-9表达显著增加,且吴茱萸碱和小檗碱联合使用下调凋亡相关蛋白caspase-3、caspase-9的效果优于单独使用。
综上所述,吴茱萸碱、小檗碱可作为中药化疗耐药逆转剂应用于胃癌化疗辅助治疗,其作用靶点广,可通过多个靶点增强胃癌耐药细胞对顺铂的敏感性,逆转胃癌顺铂耐药。此外,吴茱萸碱、小檗碱本身也具备抑制胃癌耐药细胞生长的作用,因此,其与化疗药物共同使用能更有效抑制肿瘤细胞的增殖。和以往逆转剂相比,吴茱萸碱、小檗碱作为天然产物,具有高效、低毒、作用靶点广泛的优势,且吴茱萸碱、小檗碱在胃癌顺铂耐药中起到协同抑制作用,这为治疗胃癌化疗耐药提供新的研究方向。但本研究中吴茱萸碱、小檗碱增加胃癌耐药细胞化疗敏感性的作用机制研究仍不深入,吴茱萸碱、小檗碱是否通过调节miRNA的表达影响耐药相关蛋白及凋亡相关蛋白的表达,这一作用是否涉及其它耐药机制如PI3K/Akt信号通路有待进一步研究。本研究仅限于细胞水平的观察,在体内小檗碱、吴茱萸碱是否均能提高胃癌耐药细胞对DDP的敏感性的研究有待进一步开展。

