红花蜂花粉多糖PBPC-Ⅱ结构分析及抗氧化活性
王昀 ,李月,唐春兰,孟帅磊,陈贵元 ,左绍远 *
1. 大理大学基础医学院(大理 671000);2. 武汉金域医学检验所有限公司(武汉 430000);3. 云南省昆虫生物医药研发重点实验室(大理 671000)
多糖是除了蛋白质、核酸以外的又一类重要的天然高分子化合物。与蛋白质和核酸相比,多糖的含量是最为丰富的,在动物、植物、微生物中均有分布。大量研究显示,多糖具有抗氧化、抗肿瘤、抗病毒、抗炎等生物学活性[1-4]。而近年来除了抗肿瘤活性外,多糖的抗氧化活性也成为活性药物资源研究的热点[5]。研究发现多糖的生物活性与其形态结构、相对分子质量及化学成分组成密切相关[6]。糖醛酸的含量、单糖组成、糖苷键类型直接决定真菌多糖的活性。支链的类型、聚合度、在多糖链上的分布及其取代度决定其活性的强弱[7]。目前对油菜蜂花粉多糖、山茶蜂花粉多糖、玉米蜂花粉多糖等其它植物来源的蜂花粉多糖结构研究都较多,而有关红花蜂花粉多糖的结构未见有报道。课题组在前期试验中已分离制备出红花蜂花粉总多糖(PBPC),并发现其具有抗氧化、抗菌及抗凝血等生物学活性[8-10]。试验旨在探究从前期试验制备出红花蜂花粉多糖总多糖中分离纯化出的组分Ⅱ(PBPC-Ⅱ)的相对分子质量、糖苷键的类型、单糖组成及抗氧化活性。初步分析PBPC-Ⅱ抗氧化的构效关系,以期为进一步研究PBPC-Ⅱ的抗肿瘤活性及其他药理作用提供参考依据。
1 仪器与材料
1.1 试验材料
碘、碘化钾、氯仿、三氟乙酸、盐酸羟胺、硼氢化钠、硫酸钠,维生素C,国药集团化学试剂有限公司;木糖、岩藻糖、鼠李糖、半乳糖、甘露糖、阿拉伯糖、葡萄糖、溴化钾,美国Sigma公司;DPPH,日本东京化成工业株式会社。
1.2 试验仪器
TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限公司;DBS-160电脑全自动部分收集器,上海泸西分析仪器厂有限公司;RI-502示差检测器,昭和电工科学仪器有限公司;APPS MV 10 D收集器,苏州利穗科技有限公司;Spectrum 100傅里叶变换红外光谱仪,美国Perkin Elmer公司;7890 A/5975 C气质联用色谱仪,美国Agilent公司;抑制与产生超氧阴离子自由基测定试剂盒、羟自由基测试试剂盒,南京建成生物工程研究所。
2 试验方法
2.1 β消去反应
参考文献[11]。称取5 mg干燥的 PBPC-Ⅱ,溶于5 mL 0.2 mol/L的NaOH溶液中,于45 ℃水浴3 h,在190~400 nm波长范围内进行紫外扫描。以蒸馏水作为空白对照,同法操作。
2.2 碘反应
参考文献[12]。称取干燥的PBPC-Ⅱ配制1 mg/mL的多糖溶液。取0.2 g I2和2.0 g KI,用水定容至100 mL,备用。吸取100 μL PBPC-Ⅱ溶液于白瓷板上,依次加入20 μL的碘液混匀,观察白瓷板上反应液颜色变化。另取反应液,在200~700 nm波长范围内进行紫外扫描。以蒸馏水作为空白对照,同法操作。
2.3 红外光谱分析
取适量干燥至恒重的PBPC-Ⅱ,以1∶100比例添加干燥的KBr粉末,研磨制片,在4 000~400 cm-1波长内进行红外光谱扫描分析。
2.4 单糖组成
参考文献[13]。精确称取10 mg干燥PBPC-Ⅱ,并加2 mL 4 mol/L的TFA于安瓿瓶中,N2封管,于110 ℃烘箱中水解反应6 h后,加4 mL甲醇旋干(40 ℃),重复3次至无酸味。加1 mL吡啶及10 mg盐酸羟胺,N2封管,于100 ℃水浴30 min,冷却至常温,加1 mL乙酸酐,N2封管,于100 ℃水浴30 min,冷却至常温,反应液旋干(65 ℃),溶于2 mL氯仿,加少许Na2SO4去水分,离心取有机相,0.45 μm滤过后进行GC-MS分析。同法操作各标准单糖及GC-MS分析。
GC条件:Agilent HP-5MS UI毛细管色谱柱(30 m×0.25 mm×0.25 μm),以氮气为载气,流速 1.0 mL/min,进样1 μL;程序升温,初温100 ℃,以5 ℃/min升至200 ℃,保持1 min,再以10 ℃/min 升至250℃,保持5 min,再于300 ℃运行3 min;进样口温度为250 ℃,接口温度为250 ℃;检测器,MS总离子流检测器。
MS条件:EI电离方式,电子轰击70 eV,离子源230 ℃,分流比10∶1,溶剂延迟3 min,质荷比m/z 15~550,扫描频率5 Hz,接口温度250 ℃,四级杆温度150 ℃。
2.5 试剂配制
样品液:称取适量PBPC-Ⅱ,配制成0.10,0.20,0.30,0.40和0.50 mg/mL的多糖溶液。
0.1 mmol/L DPPH:称取4 mg的DPPH,用无水乙醇定容至100 mL,于4 ℃避光,备用。
2.6 羟自由基清除作用
吸取1 mL各浓度的PBPC-Ⅱ样品液,按照羟自由基测试试剂盒的说明书方法进行操作,依次加样,测量550 nm处反应液的吸光度。以VC为阳性对照,同法操作。按式(1)计算PBPC-Ⅱ对OH的清除能力。
OH清除率能力单位(U/mL)=(Aa-Ab)/(Ac-AO)×标准品浓度×1×样品稀释倍数/测试量 (1)式中:Aa为对照管吸光度;Ab为测试管吸光度;Ac为标准管吸光度;AO为空白管吸光度;标准品浓度为8.824 mmol/L;测试量的单位为mL。
说明书上定义:在37 ℃下,反应60 s,1 mL的样液可让反应体系里的H2O2浓度下降1 mmol/L,此为一个OH清除能力单位。
2.7 超氧阴离子清除作用
吸取1 mL各浓度的PBPC-Ⅱ样品液,按照超氧阴离子自由基测定试剂盒的说明书方法进行操作,依次加样,测量550 nm处反应液的吸光度。以VC为阳性对照,同法操作。按式(2)计算PBPC-Ⅱ对O2-的清除能力。O2-清除率能力单位(U/L)=(A2-A1)/(A2-A0)×标准品浓度×1 000×样品稀释倍数/测试量 (2)式中:A1为测试管吸光度;A2为对照管吸光度;A0为标准管吸光度;标准品浓度为0.15 mg/mL;测试量单位为mL。
说明书上定义:在37 ℃下,反应40 min,反应液中1 mL的样液清除O2-,相当于1 mg VC所清除O2-的改变值为一个活力单位。
2.8 DPPH清除作用
参考文献[14]的方法。吸取2 mL各浓度的PBPC-Ⅱ样品液,依次加入2 mL的0.1 mmol/L的DPPH混匀,室温避光反应0.5 h,测517 nm处的反应液吸光度。以2 mL的纯水代替样品液为空白,VC为阳性对照,同法操作。按式(3)计算PBPC-Ⅱ对DPPH自由基的清除率。

式中:An为反应液吸光度,Am为反应液本底吸光度,Ag为空白吸光度。
3 试验结果
3.1 β消去反应
β消去反应是测定糖蛋白中糖肽键的传统方法。苏氨酸或丝氨酸与糖结合成的—O—型糖苷键可在碱性环境下被水解,发生消除反应从而产生不饱和氨基酸,引起240 nm处吸光度升高[15]。如图1所示,240 nm处的吸光度显著升高,提示PBPC-Ⅱ中具有部分—O—型糖苷键相连。

图1 PBPC-Ⅱ经NaOH作用前后的紫外扫描图
3.2 碘反应
水、PBPC-Ⅱ溶液与碘反应均呈黄色,无明显颜色变化。提示PBPC-Ⅱ中不含有α-1, 4-糖苷键。如图2所示,PBPC-Ⅱ与碘液的混合物最大吸收波长分别为365和368 nm,而565 nm处均无明显吸收峰,表明PBPC-Ⅱ可能具有较长侧链和多个分支。

图2 PBPC-Ⅱ与碘液反应的紫外扫描图
3.3 红外光谱分析
PBPC-Ⅱ红外光谱图见图3,红外信号数据见表1。据研究表明3 670~3 220,3 000~2 800,1 700~1 400及1 200~1 000 cm-1波数在多糖类的红外光谱分析中均为多糖特征吸收峰,而800~1 300 cm-1能反映出碳水化合物分子的骨架特征,可用于多糖类物质表面及空间结构鉴定[16-17]。
如图3所示,PBPC-Ⅱ在3 440 cm-1处的吸收峰是分子的氢键 O—H对称伸缩产生的振动;2 924 cm-1及2 854 cm-1是甲基上的C—H伸缩的振动峰;1 748 cm-1是羧基上C==O对称伸缩的振动峰,1 651 cm-1是羧基上C==O不对称伸缩的振动峰,提示糖链中可能含有糖醛酸;1 542 cm-1处吸收峰是胺类N—H弯曲振动,表明可能具有缀合蛋白或氨基;1 411 cm-1是C—H变角的振动峰;1 245,1 145和1 076 cm-1附近吸收峰分别是由C—O或C—C伸缩振动的产生,同时1 076 cm-1为β-半乳糖的特征吸收峰,提示糖链中可能存在半乳糖[18];1 017 cm-1处为吡喃C—O—C或C—O—H伸缩的振动产生;另外768 cm-1是吡喃环的吸收峰;897 cm-1处存在吸收峰提示多糖中β-糖苷键,且结构中含有α-D-pyranosidic(C1—H)和β-D-pyranosidic(C1—H)[19];875和813 cm-1处无明显吸收蜂,提示PBPC-Ⅱ不含甘露糖,与单糖组成结果相符。研究的样品为多糖类大分子化合物,根据IR分析得知,PBPC-Ⅱ为β构型及吡喃糖环结构且含糖醛酸的多糖。

图3 PBPC-Ⅱ红外光谱图

表1 PBPC-Ⅱ红外信号数据
3.4 单糖组成
各单糖标准品混合后分别进行糖睛乙酰化衍生后GC-MS分析操作,结果见图4。其特征离子及停留时间,见表2。依各标准单糖出峰保留时间,确定混合单糖中7类单糖的先后出峰顺序,分别为鼠李糖(Rha)、阿拉伯糖(Ara)、岩藻糖(Fuc)、木糖(Xyl)、甘露糖(Man)、葡萄糖(Glu)和半乳糖(Lac)。将多糖组分PBPC-Ⅱ水解衍生化后,同法操作上机GC-MS分析,结果见图5。
依据表2中标准单糖停留时间得知,PBPC-Ⅱ由鼠李糖、阿拉伯糖、岩藻糖、木糖、葡萄糖及半乳糖构成,摩尔比分别为1.40∶1.53∶1∶1.11∶2.79∶9.73。表明PBPC-Ⅱ组分为杂多糖。GC-MS分析提示半乳糖可能是PBPC-Ⅱ的主链构成组分,而鼠李糖、阿拉伯糖、岩藻糖、木糖及葡萄糖相对含量较少,可能是PBPC-Ⅱ的支链构成组分。

图4 混合单糖总离子流图
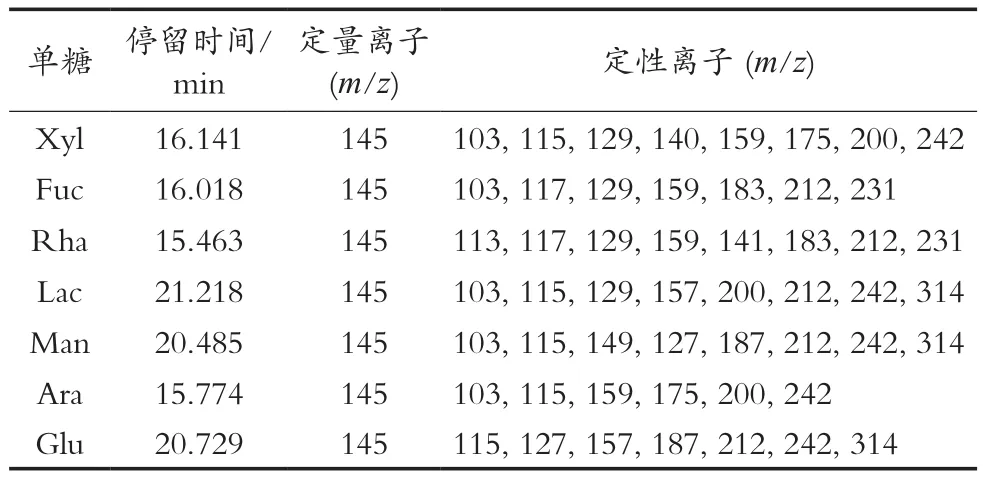
表2 7类单糖的停留时间及特征离子

图5 PBPC-Ⅱ总离子流图
3.5 PBPC-Ⅱ抗氧化活性研究
3.5.1 羟自由基清除作用
OH是一种活性氧存在形式,因其活性最强,所以可以直接穿过生命有机体细胞膜,与生物物质反应(如蛋白质、DNA、RNA等),导致组织被破坏及细胞的持续死亡,造成生命有机体的生物损伤,从而引发各种疾病[20-21]。PBPC-Ⅱ对羟自由基清除作用见图6。在0.1~0.5 mg/mL范围内,PBPC-Ⅱ对OH的清除作用与浓度呈正比,且其清除能力大于VC,具有较强的清除作用。
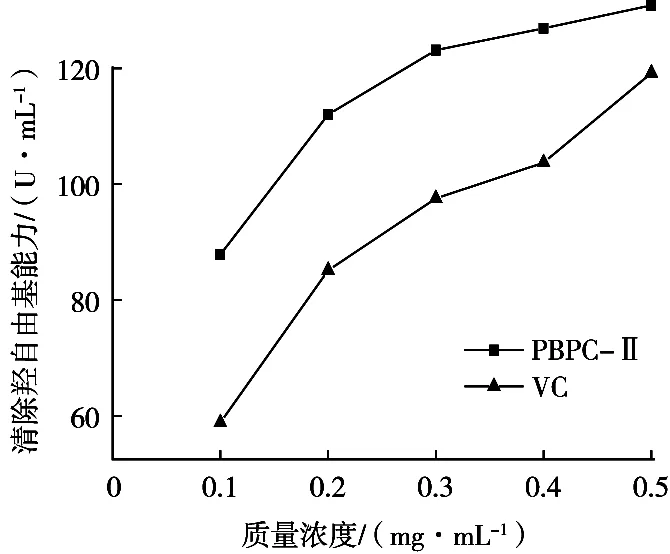
图6 PBPC-Ⅱ及VC对OH清除能力
3.5.2 超氧阴离子(O2-)清除作用
O2
-在人体内存在一定数量,在其不发生化学变化时对人体无害,但是一旦与OH结合,就会形成聚合物,破坏组织及损伤细胞DNA,而导致人类机体机能失调引起疾病[22]。PBPC-Ⅱ对O2-的清除作用,结果见图7。随着多糖质量浓度的升高,PBPC-Ⅱ和VC均对O2-具有显著的清除能力,并且随着质量浓度的增加而增强,但PBPC-Ⅱ的清除能力明显低于VC。

图7 PBPC-Ⅱ及VC对O2-清除能力
3.5.3 DPPH清除作用
DPPH一般以稳定自由基存在,其醇溶液在517 nm处有强吸收峰。当有抗氧化剂存在时,与其单电子配对使其自由基逐渐消失,并使517 nm处吸收减弱,可用分光光度计进行快速定量分析[23]。PBPC-Ⅱ对DPPH自由基清除试验结果见图8。PBPC-Ⅱ对DPPH自由基的清除作用随着浓度的增大而提高,与VC相比,其对DPPH的清除能力虽然有一定差距,但也有显著的清除作用。

图8 PBPC-Ⅱ及VC对DPPH清除能力
4 结论
该试验运用β消去反应、碘显色反应、IR、GC-MS对PBPC-Ⅱ的结构进行了初步分析。β消去反应结果提示PBPC-Ⅱ中具有部分—O—型糖苷键相连;碘反应结果表明PBPC-Ⅱ中不含有α-1, 4-糖苷键,其糖链上可能具有多个侧支及较长支链;IR分析结果显示PBPC-Ⅱ出现典型的多糖特征吸收峰,表明其为β构型及吡喃糖环结构且含糖醛酸的多糖。GC-MS分析结果确定了PBPC-Ⅱ由鼠李糖、阿拉伯糖、木糖、岩藻糖、葡萄糖及半乳糖构成,其摩尔数之比为1.40∶1.53∶1∶1.11∶2.79∶9.73,半乳糖含量较多,可能是PBPC-Ⅱ的主链构成组分,而鼠李糖、阿拉伯糖、岩藻糖、木糖及葡萄糖相对含量较少,可能是PBPC-Ⅱ的支链构成组分。
通过对PBPC-Ⅱ抗氧化能力和自由基清除能力的研究,结果表明PBPC-Ⅱ具有不同程度的抗氧化及清除自由基能力,说明PBPC-Ⅱ具有良好的抗氧化活性,可作为天然抗氧化剂。从以上试验中也可以看出,PBPC-Ⅱ对羟自由基、超氧阴离子以及DPPH的清除作用不尽相同,这可能与多糖组分PBPC-Ⅱ的化学结构有关,需进一步在多糖构效关系及抗氧化机制方面做深入研究[24]。综上,针对PBPC-Ⅱ具有的较好的抗氧化及自由基清除能力,可进一步从细胞或动物模型上探究其抗肿瘤及其他生物活性,为全面系统研究红花蜂花粉多糖并进一步开发利用提供理论基础。

