Ⅲ型肝细胞与胆管细胞混合性肝癌的MRI表现
朱正, 赵燕风, 赵心明, 王小艺, 周纯武
最常见的原发肝脏恶性肿瘤是肝细胞肝癌(Hepatocellular carcinoma,HCC),占原发肝癌的比例超过70%,第二常见的是肝内胆管细胞癌(Intrahepatic cholangiocarcinoma,ICC),约占15%[1]。而肝细胞与胆管细胞混合性肝癌(combined hepatocellular-cholangiocarcinoma,cHCC-CC)是一种少见的原发肝脏恶性肿瘤,占原发肝癌的比例为0.4%~14.3%[2-8],分成三种亚型:Ⅰ型为分离型,HCC与ICC在肝内分别独立存在;Ⅱ型为碰撞型,相邻的HCC与ICC病灶碰撞、融合;Ⅲ型为混合型,单个病灶内HCC与ICC成分混杂存在,密不可分[2]。由于发病率较低,既往文献关于cHCC-CC的报道较少,与单独的HCC相比较,其预后更差[3,4,6,9,10],而Ⅲ型cHCC-CC术前较难对其做出正确诊断,初诊时影像学往往诊断为单纯的肝细胞肝癌或肝内胆管细胞癌,最终确诊需依靠组织病理学,而有关cHCC-CC的影像学文献就更少[11-15]。本文回顾性分析15例Ⅲ型cHCC-CC患者的MRI表现特征,旨在提高对该病的认识。
材料与方法
1.病例资料
检索我院病案数据库和病理数据库,2014年1月-2018年5月经手术或穿刺病理证实的Ⅲ型cHCC-CC共29例,占同期我院病理证实的原发性肝癌的2.6%(29/1112例)。检索我院RIS/PACS系统,15例(15/29)术前行MRI检查,其中12同时行MRI平扫+动态增强检查,3例仅行MRI平扫,所有患者MRI检查前均未行治疗及穿刺活检等有创性检查。14例因无我院治疗前MRI资料而予以排除,最终纳入15例患者进行研究。
一般临床资料收集内容包括患者的年龄、性别、种族、临床症状、病理证实方式(手术切除或核心活检)。与HCC相关的因素包括乙型肝炎(hepatitis B virus,HBV)、丙型肝炎(hepatitis C virus,HCV)、甲胎蛋白(α-fetoprotein,AFP);与ICC相关的因素包括硬化性胆管炎、肝内胆管结石。
2.检查方法
MRI检查采用GE 3.0T磁共振扫描仪(GE signa HDX), ADW4.4后处理工作站。使用8通道表面相控阵线圈,15例患者均采用标准肝脏扫描方案,其中12例行平扫+动态增强扫描(dynamic contrast enhancement,DCE),3例仅行平扫。平扫T1WI采用二维快速扰相梯度回波序列(2D fast spoiled gradient recalled echo,2D FSPGR),同时采集正反相位图像,T2WI使用单次激发快速自旋回波序列(single shot fast self echo,SSFSE),T2WI脂肪抑制采用快速自旋回波(fast self echo,FSE)频率饱和法脂肪抑制序列,呼吸触发。扫描参数:TR 300 ms,TE 2.5 ms,翻转角80°,带宽62.5 KHz,矩阵288×224,视野38.0 cm×30.4 cm,层厚5 mm,层间隔1 mm,激励次数0.75。DCE扫描采用屏气三维容积快速扫描序列(liver acquisition with volume acquisition,LAVA),注药后10 s开始采集,每期10 s,每两期间隔10 s,共采集6期,延迟期于注药后5 min使用LAVA序列扫描,扫描参数:TR 2.8 ms,TE 1.3 ms,翻转角12°,带宽125 KHz,矩阵288×170,视野35 cm×28 cm,层厚4.2 mm,层间隔0 mm,激励次数0.75。增强扫描对比剂采用钆喷酸葡胺注射液(马根维显,拜耳先灵医药),使用高压注射器经肘静脉注入,剂量15 mL,流率1.5 mL/s。
3.病理学分析及图像分析
在病理上,Ⅲ型cHCC-CC是指同时具有肝细胞癌和胆管细胞癌两种成分的肿瘤[1],所有病变均应有小梁状的肝细胞成分和腺管状结构伴黏液分泌的胆管细胞成分,两种成分混合存在。辅助型免疫组织化学检测肝细胞成分表达cytokeratin 8(CK8)、cytokeratin18(CK18)、Hepatocyte-Paraffin-1(Hep Par),而胆管上皮成分表达cytokeratin 7(CK7)、cytokeratin19(CK19)。
MRI图像存储于PACS系统(锐钶公司,美国),由两位有经验的MRI医师共同阅片、讨论。图像分析内容包括:病变数目,直径,部位,形态,边界,T1WI、T2WI信号强度,出血,脂肪,动态增强强化形式,囊变坏死,动脉早期边缘强化、延迟期包膜样强化、延迟期中心强化,邻近肝被膜凹陷,肝内胆管扩张,淋巴结转移等。既往研究认为典型HCC的MRI表现包括:肿物边界清楚、动脉期明显强化而门脉期和延迟期强化迅速减低及延迟期肿瘤边缘包膜样强化、肿瘤内部出血及脂肪变性、肿瘤中心出现坏死、伴发表现包括肝硬化和门静脉瘤栓[14-19]。典型ICC的MRI表现包括:不规则分叶状肿物、渐进性强化、动脉早期肿瘤边缘环形强化和延迟期中心区强化,伴发表现包括肝内胆管扩张、贴邻肝被膜凹陷和肝门腹膜后淋巴结转移[16,20,21]。将病变分为三组,分别为HCC表现组、ICC表现组、HCC和ICC表现组。出现任意一种HCC表现且同时出现任意一种ICC表现即诊断为cHCC-CC。
4.统计学分析
采用SPSS 13.0软件进行统计分析。分类资料以率的形式表示,使用卡方检验中的配对McNemar test法进行组间比较。以P<0.05为差异具有统计学意义。

图1 患者,男,49岁,病理诊断为cHCC-CC。a) T2WI脂肪抑制序列示肝脏V段边界不清肿瘤(箭); b) 横轴面动脉早期示肿瘤(细箭)边缘强化(粗箭); c) 横轴面延迟期示肿瘤(箭)内部的中心延迟强化(黑星); d) 冠状面延迟期示肿瘤(箭)内部的中心延迟强化(黑星)。
结 果
1.一般情况
15例Ⅲ型cHCC-CC患者中男11例,女4例,年龄45~72岁,中位年龄56岁。6例查体发现,5例上腹不适,1例腹胀纳差,1例为乳腺癌术后例行检查发现,1例自觉腹部肿物,1例乏力。AFP正常7例,高于正常值8例,范围为1.53~22136.00 ng/mL,中位数15.62 ng/mL。HBV感染10例,HCV感染1例(同时感染HBV),肝硬化8例。所有患者均无硬化性胆管炎、肝内胆管结石。
2.MRI表现
15例Ⅲ型cHCC-CC病变均单发(图1~4),病灶长径为1.8~8.1 cm(平均4.7 cm,中位值为4.6 cm),短径1.7~7.5 cm(平均3.7 cm,中位值为3.0 cm)。病灶边界清楚13例,不清楚2例;形态规则10例(圆形或椭圆形),形态不规则或分叶状5例。T1WI上呈略高信号4例,其中瘤内出血3例,瘤内脂肪变性1例;T1WI上呈等低信号11例。所有病例在T2WI上均呈不均匀中高信号。动态增强模式分成3型:Ⅰ型为流出型,定义为动脉期明显强化呈高信号,门脉期或延迟期强化程度降低呈低信号,共3例;Ⅱ型平稳型,定义为三期扫描信号变化不明显,即均呈高信号、等信号或低信号,共5例(三期均为高信号、低信号者各2例,等信号者1例);Ⅲ型为渐进填充型,定义为动脉期及门脉期呈等或低信号,延迟期对比剂向中心充填,呈等或高信号,共4例。动脉早期肿瘤边缘明显强化6例,其中4例在延迟期出现中心片状强化;9例在延迟期有较为典型的包膜样强化。伴随表现中,病变位于肝被膜下或贴邻肝被膜12例,其中4例肿瘤贴邻肝被膜处肝被膜明显凹陷,肿瘤周围肝内胆管扩张2例,淋巴结肿大6例(肝门区4例,腹膜后1例,肝门区与腹膜后均有肿大者1例)。所有病例均无门静脉瘤栓。
15例Ⅲ型cHCC-CC患者行MRI平扫,出现HCC表现者11例,其中肝硬化8例,T1WI高信号4例,提示出血或脂肪变性,瘤内坏死4例。出现ICC表现者9例,其中贴邻肝被膜凹陷4例,周围肝内胆管扩张2例,淋巴结转移6例。同时出现HCC和ICC平扫表现者7例,出现任意一种HCC平扫表现且同时出现任意一种ICC平扫表现即诊断为cHCC-CC,MRI平扫的诊断敏感度为46.7%(7/15)。12例患者行MRI增强扫描,出现HCC强化表现者10例,出现ICC强化表现者9例,同时具有HCC和ICC强化表现者7例,强化表现诊断cHCC-CC的敏感度为58.3%(7/12)。MRI增强扫描诊断Ⅲ型cHCC-CC的敏感度高于MRI平扫,但两者差异无统计学意义(P>0.05)。由于延迟期包膜样强化和非流出型强化方式这两种征象出现的比例较高,仅使用此两种征象进行简易诊断(即同时出现这两种征象就诊断为cHCC-CC),敏感度为58.3%(7/12)。
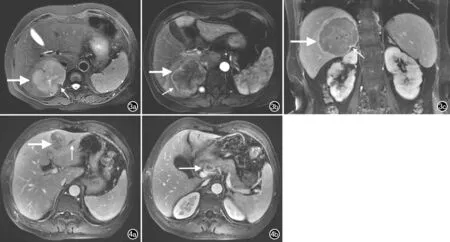
图3 患者,男,67岁,诊断为cHCC-CC伴肝被膜凹陷。a) T2WI脂肪抑制序列示肝Ⅵ/Ⅶ段肿物(粗箭)伴肝被膜凹陷(细箭); b) 横轴面增强扫描动脉早期示肿瘤(粗箭)边缘强化(细箭)和局部肝被膜凹陷(白星); c) 冠状面延迟期示肝包膜强化(粗箭)和局部肝被膜凹陷(细箭)。 图4 患者,女,37岁,诊断为cHCC-CC伴腹膜后淋巴结转移。a) 增强扫描门静脉期T1WI 3D GRE脂肪抑制序列示肝IV段肿瘤边缘不清(粗箭),肝内胆管扩张(细箭); b) 增强扫描门静脉期T1WI 3D GRE脂肪抑制序列示环形强化的腹膜后淋巴结(箭)。
3.病理学结果
15例患者中手术切除14例,核心针(18G)穿刺活检1例。所有病例均观察到小梁状的肝细胞成分和腺管状结构的胆管细胞成分。部分病例行免疫组织化学检查,CK8检测8例,均为阳性;CK18检测11例,均为阳性;Hep Par检测13例,其中阳性8例,阴性5例;CK18检测11例,均为阳性; CK7检测11例,其中阳性10例,阴性1例;CK19检测13例,其中阳性12例,阴性1例。
讨 论
cHCC-CC是一类较为少见的肝脏原发恶性肿瘤,与HCC和ICC相比,此类肿瘤有其自身独特的临床及病理特点。cHCC-CC于1903年首次报道[22],分为三个亚型[2]。近年来关于cHCC-CC的报道以亚洲居多,而西方欧美报道的较少,在原发性肝癌中所占比例西方为2.4%~14.2%[2,4,8,21,23],可能略高于亚洲的0.4%~7.9%[3,4,8,9,23],但西方的比例也多为3%~7%[8],本组病例此比例为2.6%,与既往文献报道基本一致。发病的中位年龄为50~61岁,男性居多,所占比例为66.7%~88.9%,慢性肝病、肝硬化所占比例为37%~83%,亚洲与西方基本相仿[3,6,7,9,10,14,23,24],只有de Campos等[13]的报道中男性少于女性(4/11例)。本组患者的中位年龄为56岁,11例(73.3%,11/15)为男性,8例(53.3%,8/15)有肝硬化,这均与既往文献报道相符。在亚洲病例[3,6,9,10,23,24]中HBV感染比例高于西方[7,13,14](29.6%~73.4% vs. 9.1%~17%),而HCV感染比例低于西方(1%~14% vs. 33.3%~42.0%),本组10例(66.7%,10/15)感染HBV,1例(6.7%,1/15)感染HCV,与文献报道相仿。在预后方面,多数学者认为cHCC-CC的预后较HCC差,但好于ICC[3,6,7,9,10,21,23,24];治疗后(手术或TACE)的1、3、5年生存率分别是52%~79%、15%~66%、5%~36.4%,影响预后的主要因素有门静脉瘤栓或门静脉受侵、淋巴结转移或远处转移,有无临床症状、有无肝硬化、是否为乏血供、肿瘤大小、Child分级可能也是影响预后的因素;cHCC-CC与HCC相比有更高的淋巴结转移率。
在病理上,Ⅲ型cHCC-CC是指同时具有肝细胞癌和胆管细胞癌两种成分的肿瘤。在免疫组织化学标记物表达方面,肝细胞成分表达CK8、CK18,而胆管上皮成分表达CK7、CK19,在大体形态上与HCC相比没有明显差异,以胆管细胞癌为主要成分的肿瘤具有纤维间质,肿瘤切面质地硬[1]。关于cHCC-CC的起源尚不明确,多数学者认为这种类型肿瘤可能是HCC的一种变异体[14,25,26],可能是由胚胎多能肝脏干细胞发展而来的。
Ⅲ型cHCC-CC在初诊时很难做出正确的诊断,确诊主要依靠术后病理,而此时对于患者的治疗方案已经制定并实施了,如何能在术前做出正确诊断一直是困扰相关研究者的难题[3,4,6,7,9,10,21,23]。由于Ⅲ型cHCC-CC同时具有肝细胞癌和胆管细胞癌两种成分,术前常被误诊为肝细胞癌或肝内胆管细胞癌,甚至转移瘤,既往研究提示如果能在术前的影像学资料上同时准确地识别出HCC和ICC的特征性表现,将提高术前诊断的准确性[11-15]。
Hwang等[15]认为多数cHCC-CC表现为不规则分叶状肿物,与ICC的表现接近,这是由于肿瘤内胆管细胞癌成分中的纤维组织牵拉所致肿瘤生长不均,但本组病例大多(10/15)为形态规则的类圆形肿物,少数(5/15)为不规则分叶状肿物;所以笔者认为肿物呈分叶状生长可能与胆管细胞癌的纤维成分有关,但同时肿物越大也越容易出现呈不规则分叶状生长的现象。
de Campos等[13]认为慢性肝病患者中,肿瘤在T2WI上呈中高信号,在增强早期呈环形强化,延迟期仍持续强化者应怀疑cHCC-CC,本组病例中仅有1例完全符合上述表现。此外,de Campos等还认为非慢性肝病患者中,肿瘤在增强早期环形强化,而无其他已知恶性肿瘤病史者应怀疑cHCC-CC,本组中有3例符合此表现。以上表现多为典型ICC的MRI表现,这些表现与ICC的表现有较大重叠,Hwang等[15]也认为依据这些表现很难将cHCC-CC与单纯的ICC区分开。部分学者认为增强早期肿瘤边缘明显高血供,中心呈低血供,而延迟期曾经高血供的区域强化减低,中心区域持续强化,形成视觉上的反向强化,这种表现提示cHCC-CC的可能[14,27]。部分学者认为cHCC-CC在T2WI上信号更高,而且比单纯的HCC边界更为清楚,甚至可能误诊为血管瘤,这些表现提示cHCC-CC的可能[13,21]。本组病例中13例(13/15)肿瘤边界清楚且T2WI呈中高信号,笔者认为此征象的特征性不明显,诊断价值不高。另外多数既往研究提示cHCC-CC有较高的淋巴结转移率,明显高于单纯HCC,与单纯的ICC相仿[3,4,6,8,21,23,28]。本组病例中6例(6/15)出现淋巴结转移,与既往报道相仿,但单凭有无淋巴结转移仍很难与单纯ICC区分开。
由于在病理上Ⅲ型cHCC-CC同时具有肝细胞癌和胆管细胞癌两种肿瘤成分,这就决定了可能同时出现单纯HCC和单纯ICC的影像学表现[29]。本组数据表明如果将同时出现HCC和ICC表现作为诊断cHCC-CC的标准,MRI动态增强扫描、MRI平扫的诊断敏感度分别为58.3%(7/12)和46.7%(7/15)。因为MRI平扫的诊断多是依据间接征象(如肝硬化、瘤周肝内胆管扩张、肝脏被膜凹陷、淋巴结转移等),其可靠性可能会低于依据肿瘤强化特点的动态增强扫描。简单地依据延迟期包膜样强化(提示HCC)和非流出型强化方式(提示ICC)两种征象进行诊断,其诊断敏感度仍可达58.3%(7/12)。因此笔者认为将此两项强化特点作为诊断Ⅲ型cHCC-CC的指标更为可靠,对于影像医生容易掌握,便于操作。
本研究存在以下不足:①本研究为回顾性研究,且病例数较少,这与Ⅲ型cHCC-CC是一种少见病理类型肿瘤有关[30];②笔者未将MRI表现与病理学肿瘤内HCC成分和ICC成分的位置和所占比例一一对应;③未能进行盲法阅片,MRI诊断医师在复阅MRI图像时已经知道病理结果,这可能会使阅片结果产生一定偏倚;④未能与HCC和ICC做对照研究。以上不足将在今后的研究中解决。
综上所述,在MRI上Ⅲ型cHCC-CC多表现为单发、实性、边界清楚的肿物,在T2WI上多呈中高信号,动态增强强化方式多为非流出型,延迟期多有包膜样强化,同时可伴肝硬化、瘤内坏死、出血、脂肪变性、瘤周肝内胆管扩张、贴邻肝被膜凹陷、增强扫描动脉期肿瘤边缘环形强化、延迟期中心持续强化、淋巴结转移等表现。应用同时出现HCC和ICC表现作为诊断Ⅲ型cHCC-CC的标准,可获得较为满意的诊断敏感度。将诊断标准简化,使用动态增强强化方式为非流出型、延迟期有边缘包膜样强化这两种表现作为诊断标准,可得到更好的诊断敏感度,而且更方便影像医师掌握。

