红霉素口服片剂国内外质量现状分析
武建卓,洪建文
(广东省药品检验所,广州 510663)
红霉素(Erythromycin)于1952年由礼来公司在一种放线菌的代谢产物中分离得出,并申报了专利[1],我国于1958年研制成功,1960年上海第三制药厂率先生产[2]。它是第一个药用的十四元环大环内酯类抗生素,属于国家和世界卫生组织的基本药物[3-4],同时红霉素肠溶片为国内需要近期完成的289个仿制药一致性评价品种之一。由于其在酸性条件下不稳定,临床应用多为肠溶制剂,红霉素各剂型中,国内应用最多的是肠溶片,2010年、2012年、2017年三次国家评价性抽验共抽样红霉素肠溶片742批次,表明由于其有较好的抑菌作用和较轻的不良反应,在临床被广泛使用;国外有普通片和肠溶片,本文对其口服片剂的国内外现状进行比较分析。
1 基本信息

图1 红霉素化学结构式
红霉素为全发酵的多组分抗生素,主成分是红霉素A,化学名:(3R,4S,5S,6R,7R,9R,11R,12R,13S,14R)-4-[(2,6-二脱氧-3-C-甲基-3-O-甲基-α-L-核糖吡喃葡糖)氧基]-14-乙基-7,12,13-三羟基-3,5,7,9,11,13-六甲基-6-{[3,4,6-三脱氧-3-(二甲基氨基)- β-D-木吡喃葡糖]氧基}氧环十二烷-2,10-二酮。其结构式(图1)、分子式及分子量[5]。
抗菌谱和青霉素相似,主要是对革兰阳性菌如金葡菌、溶血性链球菌、肺炎球菌、白喉杆菌、炭疽杆菌及梭形芽孢杆菌等,有强大抗菌作用。对革兰阴性菌如脑膜炎双球菌、淋球菌、百日咳杆菌、流感杆菌、布氏杆菌、部分痢疾杆菌及大肠埃希菌等有一定作用。其特点是对青霉素产生耐药性的菌株,对本品敏感。作用机制主要是与核糖核蛋白体的50S亚单位相结合,抑制肽酰基转移酶,影响核糖核蛋白体的移位过程,妨碍肽链增长,从而抑制细菌蛋白质的合成[6]。临床上主要用于耐青霉素及对青霉素过敏的金葡菌感染,亦用于溶血性链球菌及肺炎球菌所致的呼吸道、军团菌肺炎、支原体肺炎、皮肤软组织等感染[7]。临床最常见的不良反应是胃肠不适,是抗生素药品中毒性较小的药物,很少引起严重不良反应[8]。
红霉素口服吸收,血药浓度达峰时间约为1~2h。其吸收特点为,一是不耐酸,在胃中可分解为无活性的代谢物;二是吸收率低,一般约为25%,受胃中pH影响较大,食物可延缓吸收和减少吸收量;三是可以在小肠上部(碱性环境)吸收。单次口服红霉素250mg或500mg,4h的血药浓度分别为0.5~1mg/mL和1~2mg/mL;蛋白结合率约为70%~80%。吸收后除脑及脑脊液外,广泛分布于各组织,并可基本达到抗菌有效浓度;一般的组织浓度/血药浓度的比值为0.2;可通过胎盘屏障,胎儿血浆内药物浓度可达母体血循环浓度的5%~20%;在母乳中的药物浓度为血药浓度的50%。在肝脏中代谢,主要从胆汁排泄,胆汁药物浓度可达250mg/mL;从尿排泄仅有2%~5%;血浆消除半衰期1~2h[9]。
2 口服片剂国外情况
2.1 国外上市情况
根据美国FDA橙皮书数据库查询,原研礼来公司的红霉素片剂现已退市。目前美国市场的红霉素口服片剂均为雅培公司产品,有三类,一是薄膜衣片,于1972年7月11日获FDA批准上市,规格为250mg和500mg,商品名为ERYTHROMYCIN;二是素片包衣型的肠溶片(Tablet,Delayed-release),于1982年3月29日获FDA批准上市,规格为250mg,333mg和500mg,商品名为ERY-TAB;三是微丸包衣型的肠溶片(Tablet,Coated Particles ),于1986年9月9日获FDA批准上市,规格为333mg和500mg,商品名为PCE;产品具体信息及是否参比制剂(RLD/RS)情况见表1。
日本市场的红霉素肠溶片为沢井製薬(Sawai Pharmaceutical Co.,Ltd.)生产,于1981年9月上市,申请号21800AMX10439000,规格200mg,日本橙皮书未标注为参比制剂。
欧洲上市情况,查询欧洲药品管理局的EMEA(The European Agency for the Evaluation of Medicinal Products)数据库和欧盟药品注册HMA(Heads Of Medicines Agency)数据库,均未检索到红霉素口服片剂相关信息。查询英国药监局EMC(http://emc.medicines.org.uk/)网站,在英国上市的红霉素肠片有2个,持证商分别为Milpharm Limited公司(商品名Erythromycin 250mg Tablets)和Waymade Plc Trading as Sovereign Medical公司(商品名Erythromycin Tablets BP 250 mg),规格均为250mg。
2.2 国外制剂处方
比较美国雅培三种红霉素口服片剂的处方,其中薄膜衣片和素片包衣型的肠溶片使用了相同的崩解剂、黏合剂和填充剂,仅包衣膜材料不同。值得注意的是,胃溶型的薄膜衣片包衣处方中加入了羟丙基甲基纤维素邻苯二甲酸酯(hydroxypropyl methylcellulose phthalate),依据其苯二甲酸基含量的不同,其溶解的pH不同,但通常在pH5以上。该成分常用于制备缓控释制剂,说明即使是胃溶型的薄膜衣片,其包衣配方也有一定的耐胃酸作用。

表1 红霉素口服片剂FDA收载情况表
另一种微丸包衣型的红霉素肠溶片,该剂型制备时先将原辅料制微丸,将微丸包肠溶衣后再压片,优势是:体内崩解以后形成多个肠溶衣的微丸,多点同时释放,有利于快速吸收,快速达到有效的血药浓度。基于其工艺特点,其处方与前两种明显不同,崩解剂仅使用羧甲淀粉钠。国外三种不同类型的红霉素口服片剂处方比较见表2。
3 我国公布的参比制剂情况
2017年6月,国家食品药品监督管理总局关于发布仿制药参比制剂目录(第五批、第六批)的通告(2017年第88号、第89号)中公布了红霉素肠溶片参比制剂,为Arbor Pharmaceuticals LLC公司的Erythromycin delayed-release tablets,规格为0.25g(25万单位)和0.5g(50万单位),与美国橙皮书相同。
4 国内情况
4.1 国内上市情况
根据国家药品监督管理局数据库查询,红霉素口服片剂有红霉素片和红霉素肠溶片,经调研了解到,国内实际无红霉素片在生产,现有文号是药典将名称规范为肠溶片时,企业未做变更导致的历史遗留问题。
国内红霉素肠溶片现有0.125g、0.25g、0.05g和0.1g四个规格,前三个为中国药典收载的规格。该品种国内共有470家生产企业,625个文号。自一致性评价工作启动以来,共21个企业对该品种参比制剂进行了备案,按规格统计见表3。
该品种国内企业和文号众多,但实际多数企业常年不生产,在先后三年(2010、2012及2017)进行的国家评价性抽验工作中,发现国内目前仍在生产的企业数约为30家,统计三个年度抽样批次排名前10的企业(表4),其中各年度排名前4的生产企业均为A、B、C、D,上述企业的占总市场份额>50%[10-11]。
分析历次检验结果发现,该品种整体质量逐年提升;不合格产品涉及企业数逐年减少,有生产企业进行工艺改进提升了控制水平;且由于企业和监管部门对质量的重视,产业呈集中趋势[11]。
4.2 国内制剂处方
国内红霉素肠溶片目前有薄膜衣片和糖衣片两种。制剂处方辅料均由崩解剂、填充剂、黏合剂、润滑剂、助溶剂、助流剂和包衣材料组成(表5)。崩解剂多数企业使用普通崩解剂,即单独用羧甲淀粉钠或同时用羟丙纤维素,少数企业使用到超级崩解剂低取代羟丙纤维素;填充剂多数企业使用淀粉类,少数几家使用可压型较好的微晶纤维素;黏合剂多数企业使用糖浆和淀粉浆,部分企业还使用羟丙甲纤维素,极少数企业使用了与参比制剂相同的黏合剂聚维酮。
4.3 国内制剂工艺
国内红霉素肠溶片均为素片包肠溶衣制得。各企业生产工艺大致相同,通常将处方比例的红霉素原辅料分别过筛,混匀,加入一定比例的黏合剂如10%~15%的淀粉浆、2%~3%的羟丙甲基纤维素等制成软材,制粒,干燥,整粒,总混,加入润滑剂、助流剂等辅料上压片机制成素片,控制进出风温度、转速、喷量等包衣工艺参数将素片包肠溶衣,包装,即得。

表2 雅培红霉素口服片剂处方表

表3 国内红霉素肠溶片企业文号及一致性评价参比制剂备案情况
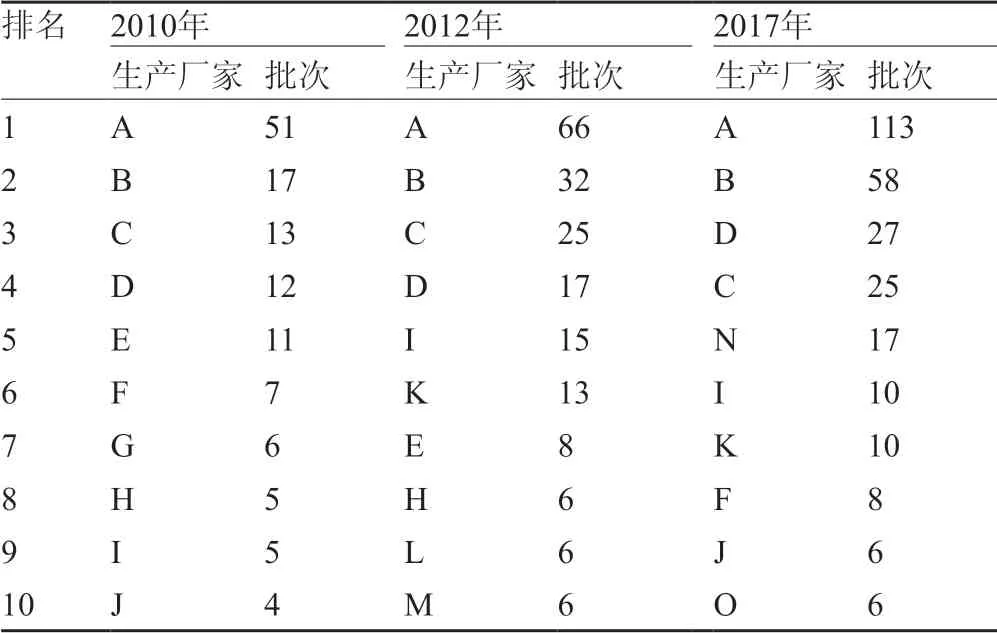
表4 红霉素肠溶片国家评价性抽验主流生产企业批次统计结果表
在包衣工艺上,又分为包糖衣和薄膜衣两种,糖衣工艺相对陈旧,包衣增重大,更加难以控制制剂的批内均一性和批间重复性[10-11]。
5 国内外比较情况
5.1 剂型与规格的差异
国外有3种红霉素口服片剂,普通胃溶型薄膜衣片、素片包衣型的肠溶片、微丸包衣型的肠溶片,国内仅有素片包衣型的肠溶片一种。红霉素作为抑菌药物,通常临床提示应尽快达到起效血药浓度,以此推断该药物应在体内迅速释放,以保证疗效。胃溶型薄膜衣片属于快速释放剂型;微丸包衣型的肠溶片由于其崩解后多点同时释放,吸收利用整体上快于素片包衣型的肠溶片,但该种肠溶片对辅料和设备的要求也较高,目前国内尚无微丸包衣型的红霉素肠溶片。
红霉素肠溶片国外制剂规格主要有0.25g和0.5g两种,国内市场目前主要是0.125g规格。
5.2 处方工艺的差异
对比美国雅培与国内企业的红霉素肠溶片处方,使用的辅料种类差异较大,主要表现在崩解剂、填充剂和包衣材料等方面。
5.2.1 崩解剂
雅培使用交联羧甲基纤维素钠、交联聚维酮与羟丙基纤维素作为崩解剂,前两种均为超级崩解剂,国内多使用以羧甲淀粉钠为主的普通崩解剂;崩解剂的优劣直接影响片芯的崩解速率,进而影响肠溶片的溶出速率,从使用的种类来看,超级崩解剂性能更好。填充剂的使用上,国内是以淀粉类为主,雅培使用可压性更好的微晶纤维素。

表5 国内红霉素肠溶片处方常用辅料表
5.2.2 包衣材料
国内外制剂所用的肠溶衣材料不同,雅培使用羟丙基甲基纤维素酞酸酯(HPMCP),国内企业普遍使用聚丙烯酸树脂。HPMCP成膜性好,溶解速度快,理化性质稳定[12-13],其主要优势体现在两个方面,一是其溶解的pH低,一般在pH5~5.5,体内在十二指肠的上端就能溶解,而聚丙烯酸树酯的溶解通常在pH6以上;二是HPMCP包衣后的片面光滑,包衣增重7%~8%即可,而采用聚丙烯酸树酯成膜后衣层较脆,且易粘锅,因此包衣增重大,普遍在8%~12%,且片面较为粗糙。
5.3 质量标准差异
红霉素肠溶片收载于中国药典(ChP2015)、美国药典(USP41)、英国药典(BP2018)和日本(JPXVII)。各标准的主要差异在于溶出度、有关物质和含量项目,主要项目的标准比较见表6,对标准差异进行分析如下。
5.3.1 溶出度
ChP和USP规定了溶出度检查,溶出介质均为先酸后缓冲液,其中在酸中的时间,ChP要求2h,USP要求1h。
5.3.2 红霉素组分及有关物质
ChP和BP规定了该项检查,ChP仅检查A组分,BP还规定了红霉素B、红霉素C、单杂和总杂。红霉素原料为红色链霉菌经发酵、提取纯化制得。根据对红霉素杂质的研究发现,红霉素较稳定,制剂中的红霉素B、红霉素C组分及杂质A、杂质B、杂质C主要来源于原料;杂质D、杂质E、杂质F为降解杂质,易受到酸碱热等破坏产生[10-11],生产企业可根据各自工艺的特点进行质量控制。
5.3.3 含量测定
BP采用HPLC法,其他药典采用抗生素微生物检定法。高效液相色谱法灵敏度高,操作简便,重现性好;抗生素微生物检定法存在操作步骤多,试验过程长,要求操作人员技术熟练、细致、影响试验结果的因素多等缺点。随着红霉素发酵技术的不断改进,国内现有红霉素原料中的A组分含量已经>93%,红霉素B、C的和在0.2%~2.2%之间,故红霉素A、B、C的总和已经占到红霉素所有组分的绝大多数,可以适时启动红霉素的量效统一研究,采用高效液相色谱法测定红霉素制剂的含量,以替代现有的微生物鉴定法。
5.4 产品质量和质量控制差异
红霉素在BCS(生物药剂学分类系统)分类中属于II类,具有高渗透性低溶解性的特点,其体外溶出与体内释放有一定相关性,溶出曲线可用于制剂质量的体外评价。国内制剂与参比制剂相比,质量和质量控制的差异主要在溶出行为上,具体表现在两个方面,一是参比制剂溶出速度快,在10min时的溶出量,参比制剂达50%,国内主流企业制剂均<20%,见图2;二是与参比制剂相比,企业制剂工艺的生产过程控制较差,体现在其批间重复性和批内均一性较差(图3-6)[11,14]。
6 讨论
从处方工艺方面看,国内外制剂差异较大,原研药已经退市,且国内没有进口制剂,由于红霉素肠溶片是较老的抗生素品种,受当时的研究水平所限,国内最初仿制制剂时与原研药及参比制剂的对比研究不尽深入。红霉素作为BCS II类药物,体内外释放有一定相关性,溶出曲线可用于制剂体外评价。对溶出曲线的研究发现,处方和制剂工艺均为影响本品释放度的主要因素,特别是崩解剂的种类、片芯的均匀程度、包衣材料及包衣过程控制等。
三年的国家评价性抽验数据显示,国内制剂的生产质量控制水平有所提高,按照现有标准检验的合格率逐年提高。但相比参比制剂,国内红霉素肠溶片释放较慢且不均匀。红霉素作为抑菌药物,通常临床提示应尽快达到起效血药浓度,以此推断该药物应在体内迅速释放,以保证疗效,还发现国外存在胃溶薄膜衣片、肠溶微丸片等快速释放剂型,进一步佐证其需要快速释放。

图2 国内制剂与参比制剂溶出曲线比较图
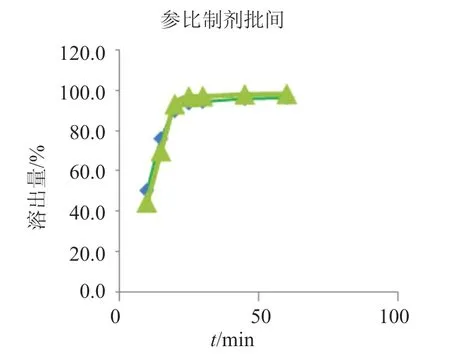
图3 参比制剂批间溶出曲线图

表6 红霉素肠溶片主要项目标准比较表

图4 国内主流企业1制剂批间溶出曲线图

图5 参比制剂批内12片间溶出曲线图

图6 国内主流企业1制剂批内12片间溶出曲线图
现有红霉素肠溶片质量标准需要修订,一是溶出度测定方法在酸中的时间应修订为1h,质量源于设计(QbD),标准规定的在酸中时间会影响到制剂工艺的设计,进而影响其质量。参比制剂的设计是基于在酸中1h的,国内制剂是2h,这会不同程度的导致国内制剂包衣增厚,制剂溶出缓慢。二是杂质谱控制不足,应对其制剂工艺相关的特定杂质进行控制。合理的确定特定杂志和杂质限度能提高药品质控水平,还能评价制剂工艺的优劣[15]。
目前国内红霉素肠溶片的一致性评价工作难度较大,进展缓慢。原研药年代久远,且已退市,可获取的资料有限,日本橙皮书也未收载该品种的溶出曲线。国内有文号的企业有470个,在国家局进行参比制剂备案的仅21个,据悉目前尚没有企业对该品种进行BE申请。制剂规格方面,国内市场上多为0.125g,还有极少数0.25g,此次一致性评价工作公布的参比制剂规格为0.25g和0.5g,与中国市场实际主流产品规格不一致。这也增大了该品种一致性评价的难度。
总体上看,国内主流企业制剂多使用较为传统的辅料和工艺,虽然目前可以满足基本的崩解和溶出的要求,但要解决释放慢与制剂均匀性差的问题,就亟需国内生产企业与参比制剂对比,开展新型辅料的研究,运用先进的工艺技术,持续提高对生产过程的控制能力,从而提升整个肠溶制剂的水平。

