头孢呋辛酯片国内外质量现状分析
彭洁,洪建文
(广东省药品检验所,广州 510663)
头孢呋辛酯(Cefuroxime Axetil)片为头孢呋辛的口服制剂,属于第二代头孢菌素类抗生素[1],国家基本药物[2],由葛兰素(GlaxoSmithKline)公司研制开发,1987年在英国首次上市,1987年12月美国FDA批准在美国上市,商品名为Ceftin(西力欣)。国内自2000年以来,多家企业相继仿制并在国内上市销售。头孢呋辛酯片由于其疗效确切,使用方便,且具有抗菌谱广,对肾脏毒性低,渗透性强,对β-内酰胺酶具有较高稳定性等特点[3],因此在临床上被广泛应用于对抗敏感菌引起的各类感染,已列入我国须在2018年底前完成的289个仿制药质量与疗效一致性评价品种之一[4],充分认识该品种国内外的质量水平和差异,对开展仿制药质量与疗效一致性评价工作具有重要意义。
1 基本信息
头孢呋辛酯为头孢呋辛的乙酰乙酯,在体内水解后释放出头孢呋辛而发挥抗菌活性,为一对非对映异构体,分别为A异构体和B异构体[5],结构式如图1。
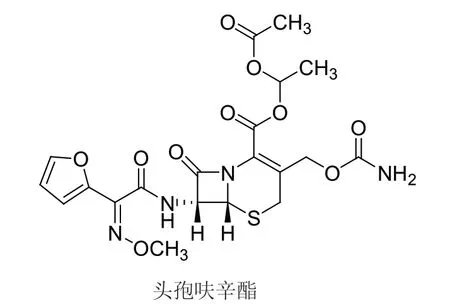
图1 头孢呋辛酯结构式
其作用机制、抗菌谱和抗菌作用皆与头孢呋辛相同,为头孢呋辛的前药。适用于敏感菌株所致咽炎或扁桃体炎、急性中耳炎、急性细菌性鼻窦炎、慢性支气管炎急性发作等,不良反应发生率低轻微,多不影响疗程的完成[6]。头孢呋辛酯母体分子头孢呋辛口服给药后吸收差,相反,亲脂性乙酰氧基乙基酯前药头孢呋辛酯,可口服经胃肠道吸收,吸收良好。吸收后于3~4min内在肠黏膜和门脉循环中被非特异性酯酶迅速水解释放出头孢呋辛,随后分布至全身细胞外液,其酯基代谢为乙醛和乙酸,蛋白结合率为50%[5]。饭后即刻给药,可达到头孢呋辛的最佳吸收,得到的平均绝对生物利用度为40%~50%(而禁食过夜后的数值为30%~35%),并且与剂量(范围250mg~1g)或剂型(片剂或混悬液)无关[7-9]。为确保达到最佳吸收,原研产品说明书建议饭后给药。
2 国外情况
2.1 上市情况
查阅美国FDA网站,发现美国共有三个规格的头孢呋辛酯片上市,分别为:125mg、250mg及500mg。上市企业有8家,包括原研药企业葛兰素公司及其他7家仿制药公司,其RLD(参比制剂)为CEFTIN(500mg),为原研企业产品。欧盟EMA网站显示,欧盟上市规格与美国相同,原研企业产品在奥地利等23个成员国均有上市,且除意大利、西班牙及葡萄牙还有其他仿制产品上市外,其余20国仅有原研企业产品上市销售。查阅日本橙皮书得知,日本则仅有原研企业产品上市。
2.2 原研处方情况
查阅FDA网站橙皮书相关资料,原研品的处方主要由头孢呋辛酯原料、填充剂、崩解剂、润滑剂、黏合剂、助流剂等组成,干法压片后包薄膜衣,其处方见表1。
3 我国公布的参比制剂情况
为落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)等任务要求,国家食品药品监督管理局组织专家对仿制药质量和疗效一致性评价参比制剂进行审核确定,发布了仿制药参比制剂目录(第一批)及(第二批)的通告(2017年第45、46号),确定头孢呋辛酯片(0.25g、0.5g)参比制剂均为葛兰素公司的西力欣片。
4 国内情况
4.1 国内上市情况
国家食品药品监督管理局网站显示,国内有头孢呋辛酯片批文20个,涉及12家生产企业;共有3个规格,分别为0.125g、0.25g及0.5g。国内有规格为0.25g的进口原研品上市销售,商品名为西力欣。据了解,由于头孢呋辛酯片疗效确切,使用方便,且为2018年底前须完成的仿制药品种之一,国内已有多家生产企业对其展开仿制药质量与疗效一致性评价研究。截止至2018年8月,共搜索到29条参比制剂备案信息。查阅药物临床试验登记与信息公示平台,共有17条头孢呋辛酯片临床试验登记记录,涉及13家企业,其中9家企业(占国内该品种生产企业总数的75%)的产品已取得批文,推测属于仿制药一致性评价试验备案。截止至2018年8月9日,我国已有国药集团致君(深圳)制药有限公司及成都贝特药业有限公司生产的2个规格(0.125g、0.25g)产品通过该品种的一致性评价。
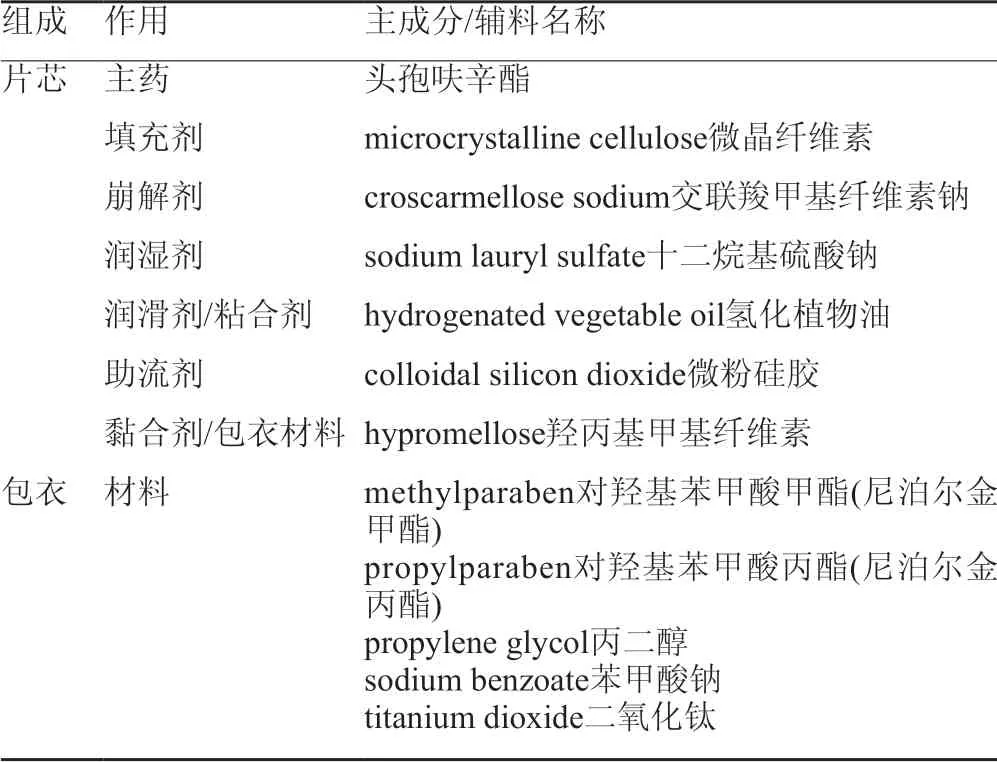
表1 原研制剂处方
4.2 处方、辅料及包材情况分析
据报道[10-14]及调研情况显示,国产主流企业片剂处方主要由头孢呋辛酯原料及填充剂、崩解剂、助溶剂、润滑剂、助流剂、黏合剂、包衣材料构成制成,包衣材料为速释型材料,铝塑板包装,密封保存,国产主要仿制制剂处方见表2。
4.3 生产工艺和过程控制
头孢呋辛酯片制剂工艺分为干法和湿法制粒压片两种,由于采用湿法制粒工艺的头孢呋辛酯片的水分和△3-异构体杂质的量明显高于干法工艺的样品[1],且湿法制粒可导致部分无定形头孢呋辛酯药物转变为α晶型[15],国内以干法制粒为主[16]。干法制粒流程为:原辅料预处理→称量→预混→制粒→总混→压片→包衣→包装。在生产过程中,应注意生产环境温湿度、制粒的液压压力、挤压速度及加料速度的控制[13]。

表2 国产主要仿制制剂处方
5 国内外情况比较
5.1 原料药的晶型
头孢呋辛酯存在3种晶型:α晶型、β晶型和无定型。其中α晶型不具有必要的生物利用特性,而β和无定型则均具有,与结晶形式相比,无定型形式在水中有较高的溶解度,被认定为较好的可吸收类型[15-17]。无定型头孢呋辛酯片制的的片剂拥有更高的溶出速率[17]。据报道[1],原研品原料亦使用无定型粉末,因此控制原料粉末为无定型十分重要的。
5.2 质量标准的差异
头孢呋辛酯片质量标准收载于《中国药典》2015年版二部(Ch.P.2015)、英国药典(BP2018)、美国药典(USP41)及进口药品注册标准(JX20000151),主要差异为溶出度的转速、介质浓度及限度,有关物质的设置及含量测定所使用的色谱柱及限度。各标准主要项目比较见表3。
5.3 产品质量和质量控制的差异
马晓宁等[1]在2012年国家评价性抽验中对146批国产头孢呋辛酯片依据质量标准进行检验,结果145批均符合规定,表明目前上市的头孢呋辛酯片质量基本可控。根据其检验结果情况分析,头孢呋辛酯片的质量控制关键在于有关物质及溶出度。
有关物质方面,2012年国家评价性抽验标准检验[1]发现不同生产企业间样品的有关物质有显著差异,且随样品的贮存时间增加;同时,通过探索性研究发现国产产品的杂质个数及量普遍高于原研药。收集国内主流厂家产品及原研产品按Ch.P.2015有关物质方法进行测定,结果见表4。国内主流厂家有关物质结果虽远低于限度要求,但差异显著,且部分企业指定杂质及总杂质均高于原研药。
在溶出度测定上,各国质量标准、原研品、日本橙皮书、美国FDA溶出曲线数据库及中检院公示的头孢呋辛酯片参比制剂一致性评价溶出曲线(草案)(以下简称草案),在溶出介质的pH、转速均有一定的差异。头孢呋辛酯属于低渗透性物质,FDA及TSRL(治疗系统研究实验室)将其归为BCS(生物药剂学分类系统)Ⅳ类,BDDCS(基于药物体内处置的生物药剂学分类系统)将其归为Ⅲ类。由于固体口服制剂在胃肠道中必须首先溶出才能被吸收并进入体内循环,药物在体内的释放和吸收直接影响其药效[18]。对比国产制剂与参比制剂溶出曲线时发现,国内仿制制剂溶出/释放行为与原研有一定的差异,4条溶出曲线与参比制剂均不相似,或仅部分曲线与参比相似,见图3。虽然在这些企业中,已有企业产品通过一致性评价审评,但产品的批间仍有一定的差异。
6 讨论
头孢呋辛酯片是我国须在2018年底前完成的289个仿制药质量与疗效一致性评价品种之一,药物临床试验登记与信息公示平台也显示多家企业均已备案,且已有2家企业通过评价,作为研发热点品种,建议在生产、监管及质量控制中应关注。
6.1 原辅料
对比国内外头孢呋辛酯片晶型时发现,某些企业产品有X-射线粉末衍射峰,但原研基本无明显X-射线粉末衍射峰[1]。为确保与原研产品的一致性,首先需保证采用无定型形式的原料。可在生产过程中,通过X射线粉末衍射、红外光谱、显微检查监测原料的物理形态,控制产品的晶型。此外,原料药的粒径也是其中的影响因素,研究表明,将药物微粉化可以增加难容性药物的溶解速率,提高其在体内的生物利用度[19-20]。因此,需筛选确定适合的原料粒径范围。

表3 主要项目对比表

表4 主流厂家有关物质结果对比
此外,由于头孢呋辛酯具有疏水性,所以辅料中需要加入润湿剂,为使药品迅速崩解起效,处方中应添加快速崩解剂[13]。查阅国内相关处方,也使用了与原研产品相同的交联羧甲基纤维素钠作为崩解剂,采用十二烷基硫酸钠作为润湿剂[13,16]。同时,由于头孢呋辛酯味极苦,所以采用薄膜包衣起掩味效果。但薄膜包衣需先破裂,片芯才能迅速崩解,因此,包衣材料应尽量采用速释型材料。国内多使用速释型的欧巴代预混材料包衣。
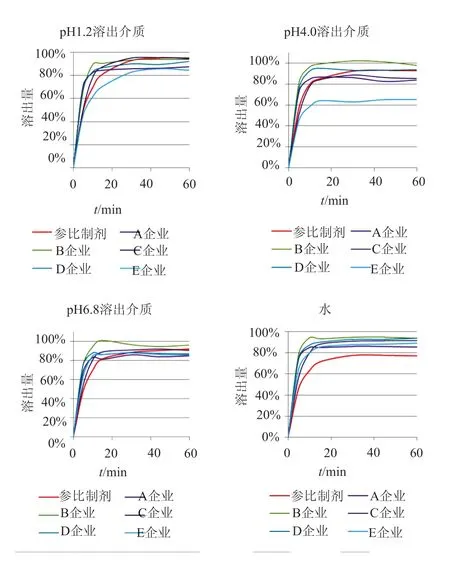
图3 主流厂家与参比制剂四条溶出曲线
6.2 生产储运过程控制
在生产的过程中,采用湿法制粒工艺时,由于头孢呋辛酯遇水或乙醇会产生非常强的黏性[12-13,19-20],且头孢呋辛酯原料在溶剂中容易发生晶型转换[12],所以宜采用干法制粒,以避免在湿法制粒过程中转晶。此外,由于水分可导致晶型发生转变,温度升高会导致△3-异构体的增加,因此在生产过程中需注意控制温湿度。包装也应为密封包装,防止水分入侵。同时,头孢呋辛酯遇光会产生E异构体,包装材料需采用避光材料,并置冷暗处保存。
产品有效期方面,比较原研品及国内产品发现,原研药为3年,国内大部分产品为2年,提示两者的稳定性可能存在差异,需进一步加强一致性研究。
6.3 质量控制问题
本品质量控制关键点为有关物质、溶出度、水分及含量。2012年国家评价性抽验已发现,国产品杂质个数普遍高于原研药[1],国外药典已增加指定杂质的控制,我国该品种原料的生产工艺和制剂工艺可能与原研品的不同,可能会导致杂质种类及数量的变化,现行有关物质检查法可能不能完全检出相关杂质[21],需进行方法的修订和标准提升。
《中国药典》2015年版头孢呋辛酯片不论何种规格,溶出度的限度都是相同的。反观USP41,大规格产品(500mg)限度相对较宽,15min时限度为50%;45min时限度为70%。日本橙皮书显示,头孢呋辛酯在水中的溶解度约为0.72mg/mL,而0.5g的产品溶出度试验供试品溶液终浓度已达到0.56mg/mL,未达到漏槽条件要求,中国药典限度应适度放宽。在对照品溶液的制备上,实验发现头孢呋辛酯在乙醇中溶解较难,需长时间超声才能完全溶解,但超声时间过长会导致主药的降解,因此需更换适宜的溶剂。
日本有学者指出,即使是含相同活性成分的药物,其质量效果也有可能不同[22],其原因可能是由含量引起的。在检验时发现,某些国内的仿制制剂,出厂时含量虽然在合格范围内,但始终不能达到100%,应引起重视。
在检验标准操作的过程上,由于头孢呋辛酯对光、热敏感,测定有关物质时应注意避光,样品需临用新制。另外,由于某些自动取样溶出仪器管路对主药有一定的吸附,造成溶出量偏低。因此需排除管路的影响,以免造成误判。

