头孢他啶-阿维巴坦药品说明书
赵锦锦 编译,张菁 校审
(复旦大学附属华山医院抗生素研究所,上海 200040)
1 前言
2015年2月25日被食品药品监督管理局(FDA)批准的新药头孢他啶-阿维巴坦注射剂,由半合成头孢菌素头孢他啶五水合物和β-内酰胺酶抑制剂阿维巴坦钠组成,用于治疗革兰阴性菌感染,尤其是耐药菌引起的严重感染,适应证为18岁及以上患者由敏感革兰阴性菌引起的复杂性腹腔内感染(complicated intra-abdominal infections, cIAI)(联合甲硝唑)、复杂性尿路感染(complicated urinary tract infections, cUTI)(包括肾盂肾炎)和医院获得性细菌性肺炎和呼吸机相关细菌性肺炎(hospital-acquired bacterial pneumonia and ventilator-associated bacterial pneumonia , HABP/VABP)。
2 药品说明
本药通用名为头孢他啶-阿维巴坦(ceftazidimeavibactam),商品名为AVYCAZ。
2.1 头孢他啶
头孢他啶是一种半合成的β-内酰胺类抗菌药物,见图1。
化学名称:(6R,7R,Z)-7-(2-(2-氨基-4-噻唑基)-2-(2-羧基-2-丙基氧基亚胺基)乙酰基)-8-氧代-3-(吡啶鎓-1-基甲基)-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸酯五水合物;分子量:636.6;分子式:C22H32N6O12S2。
2.2 阿维巴坦
化学名称:[(2S,5R)-2-氨基甲酰基-7-氧代-1,6-二氮杂双环[3.2.1]辛烷-6-基]硫酸钠,见图2;分子量:287.23;分子式:C7H10N3O6SNa。
2.3 剂型和强度
AVYCAZ(头孢他啶和阿维巴坦)注射剂是一种白色至黄色的无菌粉末,2.5g单剂玻璃小瓶内含有2g头孢他啶(相当于2.635g无菌头孢他啶五水合物/碳酸钠)和0.5g阿维巴坦(相当于0.551g无菌阿维巴坦钠),碳酸钠含量为每瓶239.6mg。混合物的总钠含量约为每瓶146mg(6.4Eq)。

图1 头孢他啶五水合物的化学结构

图2 阿维巴坦钠的化学结构
3 适应证和用法
3.1 cIAI
AVYCAZ联合甲硝唑用于治疗18岁及以上患者由下列敏感革兰阴性菌:大肠埃希菌、肺炎克雷伯菌、奇异变形杆菌、阴沟肠杆菌、产酸克雷伯菌、弗氏柠檬酸杆菌复合体和铜绿假单胞菌引起的cIAI。
3.2 cUTI(包括肾盂肾炎)
AVYCAZ用于治疗18岁及以上患者由下列敏感革兰阴性菌:大肠埃希菌,肺炎克雷伯菌、阴沟肠杆菌、弗氏柠檬酸杆菌复合体、奇异变形杆菌和铜绿假单胞菌引起的cUTI(包括肾盂肾炎)。
3.3 HABP/VABP
AVYCAZ用于治疗18岁及以上患者由下列敏感革兰阴性菌:肺炎克雷伯菌、阴沟肠杆菌、大肠埃希菌、黏质沙雷菌、奇异变形杆菌、铜绿假单胞菌和流感嗜血杆菌引起的HABP/VABP。
3.4 用法
为了减少耐药细菌情况的发生发展,保持AVYCAZ和其他抗菌药物的有效性,AVYCAZ应仅用于治疗已被证明或强烈怀疑是由敏感细菌引起感染性疾病。当细菌培养和敏感性结果已知时,在决定是否选用或调整抗菌药物治疗方案时应考虑本药。缺乏上述结果时,可参考当地流行病学资料和敏感性信息,对经验性抗菌药物治疗选择提供支持。
4 用量和给药方式
4.1 推荐剂量
对于18岁及以上肾功能正常的患者,AVYCAZ的推荐剂量是每8h 2.5g(头孢他啶2g和阿维巴坦0.5g),静脉输注2h以上。治疗cIAI,应联合使用甲硝唑。
内生肌酐清除率(CrCl)>50mL/min的患者的AVYCAZ推荐剂量见表1。
4.2 肾功能不全患者的剂量调整
表2列出了不同程度肾功能患者的推荐AVYCAZ剂量。对于肾功能改变的患者,至少应每日监测CrCl并据此调整AVYCAZ的剂量,特别是在治疗早期。
4.3 用于给药的AVYCAZ溶液的制备

表1 不同适应证时AVYCAZ2.5g(头孢他啶2g和阿维巴坦0.5g)的用量
AVYCAZ以干粉形式提供,静脉输注前需使用无菌技术进行配制和稀释。
(1)用10mL下列溶液之一在AVYCAZ小瓶中与粉末进行配制:
①无菌注射用水(美国药典标准);
②0.9%的氯化钠注射液(生理盐水)(美国药典标 准);
③5%葡萄糖注射液(美国药典标准);
④葡萄糖注射液和氯化钠注射液的所有组合,最高含2.5%葡萄糖和0.45%氯化钠(美国药典标准);
⑤乳酸林格氏注射液(美国药典标准)。
(2)轻轻混合。配制的AVYCAZ溶液含约0.167g/mL的头孢他啶和约0.042g/mL的阿维巴坦。最终体积约为12mL。配制而成的溶液不能直接输注,静脉输注前必须进行稀释。
(3)通过从配制溶液的小瓶中取出适当体积来准备静脉输注所需的剂量,见表3。
(4)在输注之前,从与混合粉末相同的稀释剂(注射用无菌水除外)配制成的AVYCAZ溶液中取出适当体积进行进一步稀释,以达到总体积50mL(头孢他啶0.04g/mL和阿维林达0.01g/mL)至250mL(头孢他啶0.008g/mL和阿维林达0.002g/mL)。如果使用无菌注射用水进行配制,则可使用任何其他适当的稀释剂进行稀释。
(5)轻轻混合并确保溶质完全溶解。给药前肉眼观察稀释后用于给药的AVYCAZ溶液中的颗粒物质和变色(颜色范围为从透明至淡黄色)。
(6)输液袋中已稀释的AVYCAZ溶液在室温状态下应于12h以内使用。

表2 肾功能不全患者的推荐AVYCAZ剂量

表3 AVYCAZ剂量准备
(7)输液袋中已稀释的AVYCAZ溶液应在冷藏2~8℃(36~46℉)状态下储存24h以内,随后应在室温状态下储存12h以内使用。
4.4 药物相容性
用于给药的AVYCAZ溶液的稀释范围从头孢他啶0.008g/mL+阿维巴坦0.002g/mL到头孢他啶0.04g/mL+阿维巴坦0.01g/mL,与输液袋中更常用的静脉输注液相容(包括Baxter®Mini-BagPlus™),例如:
(1)0.9%的氯化钠注射液(生理盐水)(美国药典标准);
(2)5%葡萄糖注射液(美国药典标准);
(3)葡萄糖注射液和氯化钠注射液的所有组合,含最高2.5%葡萄糖,和0.45%氯化钠(美国药典标准);
(4)乳酸林格氏注射液(美国药典标准);
(5)含有0.9%氯化钠注射液或5%葡萄糖注射液的Baxter® Mini-Bag Plus™;
对于静脉输注的相容性,肉眼检查评估AVYCAZ与其它药品在室温下以1:1的体积比混合的模拟Y-位点相容性,并在混合后0、1和4h测量浊度和颗粒物质。与0.9%氯化钠注射液、5%葡萄糖注射液或乳酸林格氏注射液作为稀释剂共同输注相容的药物包括:达托霉素、盐酸右美托咪定、盐酸多巴胺、呋塞米、硫酸庆大霉素、亚胺培南-西司他丁、硫酸镁、重酒石酸去甲肾上腺素、盐酸去氧肾上腺素、抗利尿激素、维库溴铵。与0.9%氯化钠注射液、5%葡萄糖注射液作为稀释剂共同输注相容的药物包括:厄他培南钠、磷酸钾、甘油磷酸钠。与5%葡萄糖注射液或乳酸林格氏注射液作为稀释剂共同输注相容的药物包括:肝素钠、利奈唑胺、硫酸妥布霉素。只与一种稀释剂共同输注相容的药物包括:美罗培南(仅0.9%氯化钠注射液稀释剂)、碳酸氢钠(仅5%葡萄糖注射液稀释剂)、磷酸替唑胺(仅5%葡萄糖注射稀释剂)、氯化钾(仅乳酸林格氏注射稀释剂)。以上未提及的药品不应与AVYCAZ通过相同的静脉输注管(或套管)共同给药。
4.5 配制溶液的储存
在用合适的稀释剂配制AVYCAZ溶液时不应>30min,随后应转移并在合适的输液袋中稀释。再用合适的稀释剂稀释配制的溶液后,输液袋中的AVYCAZ溶液在室温下可稳定储存12h。输液袋中已稀释的AVYCAZ溶液应在冷藏2~8℃(36至46℉)状态下储存24h以内,随后应在室温状态下储存12h以内使用。
5 禁忌症
AVYCAZ禁用于已知对含AVYCAZ(头孢他啶和阿维巴坦)组分、含阿维巴坦组分或其他头孢菌素类药物严重超敏反应的患者。
6 注意事项和不良反应
6.1 基线CrCl 30~50mL/min的cIAI患者中本药疗效降低
在cIAI的Ⅲ期临床试验中,与CrCl>50mL/min的患者相比,基线CrCl 30~50mL/min亚组的患者临床治愈率较低(表4)。与接受美罗培南治疗的患者相比,接受AVYCAZ联合甲硝唑治疗的患者临床治愈率降低更为明显。在这个亚组内,接受AVYCAZ治疗的患者的日平均剂量比目前推荐给CrCl 30~50mL/min的患者低33%。
在cUTI或HABP/VABP的Ⅲ期临床试验中,中度肾功能不全(基线CrCl 30~50mL/min)患者中未观察到临床疗效降低。
6.2 超敏反应
在接受β-内酰胺类抗菌药物治疗的患者中曾报道过严重和有时致命的超敏(过敏)反应和严重的皮肤反应。在开始AVYCAZ治疗之前,应仔细询问是否对其他头孢菌素类,青霉素类或碳青霉烯类有过敏反应。如果给青霉素或其他β-内酰胺类药物过敏的患者使用本药,请谨慎操作,因为本药对β-内酰胺类抗菌药物有交叉过敏反应。一旦发生过敏反应,请立即停用AVYCAZ。
6.3 艰难梭菌相关性腹泻(CDAD)
几乎所有的全身性抗菌药物,包括AVYCAZ,都报道了艰难梭菌相关性腹泻的发生,其严重程度可从轻度腹泻到致命性结肠炎。抗菌药物治疗会改变结肠的正常菌群,并可能导致艰难梭菌过度生长。艰难梭菌产生毒素A和B,有助于CDAD的发展。高毒力艰难梭菌株的出现导致发病率和死亡率增加,因为这种感染可能难以使用抗菌药物治疗且可能需要行结肠切除术。所有在抗菌药物治疗后出现腹泻的患者都必须考虑CDAD。 据报道CDAD曾在抗菌药物使用的2个月后发生,所以需要详细询问用药史。如怀疑或确认CDAD,可能需要停用不直接针对艰难梭菌的抗菌药物。维持水电解质平衡,增加蛋白质摄入量,监测艰难梭菌的抗菌治疗,并根据临床指示进行手术评估。

表4 cIAI患者中进行的Ⅲ期临床试验:mMITTa人群中基线肾功能不同时的临床治愈率
6.4 中枢神经系统反应
在头孢他啶治疗的患者中曾出现癫痫发作、非惊厥性癫痫持续状态(NCSE)、脑病、昏迷、扑翼样震颤、神经肌肉兴奋性升高和肌阵挛,尤其是肾功能不全的患者。
6.5 细菌耐药性的发展
在缺乏证明或未强烈怀疑细菌感染的情况下使用AVYCAZ可能并不能为患者带来获益,反而增加了细菌耐药性发展的风险。
7 不良反应临床试验经验
因为药物临床试验是在各种不同的条件下进行的,所以在一种药物的临床试验中观察到的不良反应发生率不能直接与另一种药物的临床试验中观察到的不良反应发生率进行比较,并且可能与临床实践中观察到的不良反应发生率不相符。
在cIAI、cUTI(包括肾盂肾炎)或HABP/VABP患者中进行的6项阳性对照临床试验中对AVYCAZ进行了评估。其中包括2项Ⅱ期临床试验,分别在cIAI患者和cUTI患者中进行,以及4项Ⅲ期临床试验,分别在cIAI患者、cUTI患者(试验1)、cIAI或cUTI患者和头孢他啶非敏感病原菌引起的HABP/VABP之一的患者(试验2)中进行。试验1因只有一个对照组,故来自cUTI患者的数据被当作该人群使用AVYCAZ安全性的主要数据集。cUTI患者中进行的试验2为了防止混杂使用开放设计和多种对照方案,但提供了支持性信息。6项临床试验共包含1809名接受AVYCAZ治疗的成年患者和1809名接受对照组治疗的患者。
7.1 cIAI
cIAI患者中进行的Ⅲ期临床试验包含529名使用每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)(输注时间>2h)联合甲硝唑0.5g(输注时间>1h)治疗的患者,和529名使用美罗培南治疗的患者。使用AVYCAZ治疗患者的中位年龄为50岁(范围为18~90岁),22.5%的患者年龄≥65岁。患者主要为男性(62%)和高加索人(76.6%)。2.6%(14/529)接受AVYCAZ联合甲硝唑治疗的患者和1.3%(7/529)接受美罗培南治疗的患者因发生不良反应而中止治疗。没有导致中止治疗的特定不良反应。
接受AVYCAZ联合甲硝唑治疗的患者出现率≥5%的不良反应为腹泻,恶心和呕吐。表5列出了Ⅲ期临床试验中接受AVYCAZ联合甲硝唑治疗的患者出现率≥1%和高于对照组的不良反应:
在cIAI患者中进行的Ⅲ期临床试验中,接受AVYCAZ联合甲硝唑治疗的患者死亡率为2.5%(13/529),接受美罗培南治疗的患者中死亡率为1.5%(8/529)。在基线CrCl 30~50mL/min亚组的患者中,接受AVYCAZ联合甲硝唑治疗的患者死亡率为19.5%(8/41),接受美罗培南治疗的患者死亡率为7.0%(3/43)。在这个亚组内,接受AVYCAZ治疗的患者的日平均剂量比目前推荐用于CrCl 30~50mL/min的患者低33%。
肾功能正常或轻度不全的患者(基线CrCl>50mL/min),接受AVYCAZ联合甲硝唑治疗的患者死亡率为1.0%(5/485),接受美罗培南治疗的患者死亡率为1.0%(5/484)。造成死亡的原因各不相同,包括基础感染的进展,基线病原菌分离株对研究药物无反应以及手术干预的延迟。
7.2 cUTI(包括肾盂肾炎)
cUTI患者中进行的Ⅲ期临床试验1包含511名接受每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)输注时间>2h的成年患者,和509例接受多利培南治疗的成年患者。一些患者静脉治疗后,转为口服抗菌药物治疗。接受AVYCAZ治疗的患者的中位年龄为54岁(范围18~89岁),30.7%的患者年龄≥65岁。患者主要为女性(68.3%)和高加索人(82.4%)。CrCl<30mL/min的患者被此项试验排除。试验1中无患者死亡。1.4%(7/511)接受AVYCAZ治疗的患者和1.2%(6/509)接受多利培南治疗的患者因发生不良反应而中止治疗。没有导致中止治疗的特定不良反应。

表5 Ⅲ期临床试验中接受AVYCAZ治疗的患者出现率≥1%不良反应
接受AVYCAZ治疗的cUTI患者出现率≥3%的最常见不良反应为恶心和腹泻。表6列出了试验1中接受AVYCAZ治疗的患者出现率≥1%和高于对照组的不良反应。
7.3 HABP/VABP
HABP/VABP患者中进行的Ⅲ期临床试验包含436名接受每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)输注时间>2h的成年患者,和434例接受美罗培南治疗的成年患者。使用AVYCAZ治疗的患者的中位年龄为66岁(范围18~89岁),54.1%的患者年龄≥65岁。患者主要是男性(74.5%)和亚洲人(56.2%)。接受AVYCAZ治疗的患者死亡率为9.6%(42/436),接受美罗培南治疗的患者死亡率为8.3%(36/434)。3.7%(16/436)接受AVYCAZ的患者和3%(13/434)接受美罗培南的患者因发生不良反应而中止治疗。没有导致中止治疗的特定不良反应。
接受AVYCAZ治疗的cUTI患者出现率≥5%的最常见不良反应为腹泻和呕吐。表7列出了HABP/VABP患者中进行的Ⅲ期临床试验中接受AVYCAZ治疗的患者出现率≥1%和高于对照组的不良反应。
7.4 AVYCAZ和头孢他啶的其他不良反应
以下不良反应是在AVYCAZ的Ⅲ期临床试验中发生率<1%,并且未在其他说明书中进行过描述的:血液系统疾病-血小板减少症,血小板增多症,白细胞减少症;一般疾病和给药部位反应-输注部位静脉炎;感染-念珠菌病;检查-AST升高,ALT升高,γ-GT升高;代谢和营养疾病-低钾血症;神经系统疾病-味觉障碍;泌尿系统疾病-急性肾损伤,肾功能不全,肾结石;皮肤和皮下组织疾病-皮疹,斑丘疹,丘疹,荨麻疹;精神疾病-焦虑。

表6 Ⅲ期临床试验1中接受AVYCAZ治疗的患者出现率≥1%不良反应
此外,在AVYCAZ的Ⅲ期临床试验中未报道的单独使用头孢他啶的不良反应如下:血液系统疾病-粒细胞缺乏症、溶血性贫血、淋巴细胞增多症、中性粒细胞减少症、嗜酸性细胞增多症;一般疾病和给药部位反应-输注部位炎症,输注部位血肿,输注部位血栓形成;肝胆疾病-黄疸;检查-血乳酸脱氢酶升高,凝血酶原时间延长;神经系统疾病-感觉异常;泌尿系统疾病-肾小管间质性肾炎;生殖系统疾病-阴道炎症;皮肤和皮下组织疾病-血管性水肿,多形性红斑,Stevens-Johnson综合征,中毒性表皮坏死松解。
7.5 实验室指标异常
在Ⅲ期临床试验中,直接Coombs试验由血清阴性转化为阳性,在接受AVYCAZ治疗的患者中发生率分别为3.0%(cUTI)、12.9%(cIAI)和21.4%(HABP/VABP),在对照组接受碳青霉烯治疗的患者中发生率分别为0.9%(cUTI)、3%(cIAI)和7%(HABP/VABP)。在任何治疗组中均未报告溶血性贫血不良反应。
8 药物相互作用
8.1 丙磺舒
在体外,阿维巴坦是OAT1和OAT3转运蛋白的底物,可能促进从血液隔室的主动摄取,并因此促进其排泄。作为OAT的强抑制剂,丙磺舒在体外通过抑制OAT1和OAT3而减少了56%至70%的阿维巴坦摄取,因此,当共同给药时,有可能减少阿维巴坦的消除。由于尚未进行AVYCAZ或阿维巴坦与丙磺舒的临床相互作用研究,因此不推荐AVYCAZ与丙磺舒共同给药。
8.2 药物/实验室测试相互作用
某些情况下使用头孢他啶可能导致尿糖的假阳性反应。因此建议使用基于酶学的葡萄糖氧化酶反应进行葡萄糖测试。
9 特殊人群用药

表7 HABP/VABP患者中进行的Ⅲ期临床试验中接受AVYCAZ治疗的患者出现率≥1%的不良反应
9.1 孕妇
9.1.1 风险概要
AVYCAZ,头孢他啶或阿维巴坦未在孕妇中进行良好对照的临床研究。在40和9倍人体推荐临床暴露量下,头孢他啶和阿维巴坦均未对大鼠致畸。在2倍人体临床暴露量下,阿维巴坦对兔子的胚胎发育无影响。
主要出生缺陷和流产的预计人群风险目前未知。在普通人群中,临床上公认的主要出生缺陷和流产的预计人群风险分别为2%~4%和15%~20%。因为动物生殖研究并不能完全预测人类的反应,所以只有在明确需要的情况下,本药才能用于孕妇。
9.1.2 数据
来自动物试验。
9.1.3 头孢他啶
小鼠和大鼠中已进行了高达40倍人体临床暴露量下的生殖研究,未显示头孢他啶而对胎儿有害。
9.1.4 阿维巴坦
阿维巴坦对大鼠或兔子无致畸作用。在大鼠妊娠第6~17d期间静脉使用每日0、250、500和1000mg/kg阿维巴坦进行研究,显示在剂量高达每日1000mg/kg(基于AUC的暴露量约为人体的9倍)时尚无胚胎毒性。在大鼠围产期研究中,静脉使用高达每日825mg/kg(基于AUC的暴露量约为人体的11倍)时,对动物幼仔的生长和活力无影响。在雌性断奶动物幼仔中观察到的不伴随肾实质或肾功能病理改变的肾盂和输尿管扩张风险随剂量增加而增加,在雌性断奶幼仔成年后,肾盂扩张仍然存在。
在兔子妊娠第6~19d期间静脉使用每日0、100、300和1000mg/kg阿维巴坦进行研究,显示在剂量高达每日1000mg/kg(基于AUC的暴露量约为人体的2倍)时尚无胚胎毒性。在较高剂量时,可观察到植入后损失增加,胎儿平均体重降低,骨骼和骨骼延迟骨化等异常。
9.2 哺乳期妇女
9.2.1 风险概要
头孢他啶在人乳汁中排泄浓度低。目前尚不清楚阿维巴坦是否会通过人乳汁排泄,尽管显示阿维巴坦在大鼠的乳汁中排泄。尚无关于头孢他啶和阿维巴坦对母乳喂养儿童或产奶量的影响的信息。
除考虑母亲对AVYCAZ的临床需求及AVYCAZ或母体状况对母乳喂养婴儿可能造成的不良影响外,应当权衡考虑母乳喂养对婴儿发育和健康的益处。
9.2.2 数据
在大鼠围产期研究中,静脉使用剂量高达每日825mg/kg(基于AUC的暴露量约为人体的11倍)的阿维巴坦,与母鼠相比,幼仔的药物暴露程度最低。在PND7上,可在幼仔和乳汁中观察到阿维巴坦的暴露。
9.3 儿童
尚未证实<18岁的患者使用本药的安全性和有效性。
9.4 老年人
在Ⅱ期和Ⅲ期AVYCAZ临床试验中,1809名患者中包含621名(34.5%)≥65岁,302名(16.7%)≥75岁。
在cIAI患者中进行的联合Ⅱ期和Ⅲ期AVYCAZ临床试验中,接受AVYCAZ治疗的患者中有20%(126/630)年龄≥65岁,其中包括49名(7.8%)≥75岁。两个治疗组老年患者(≥65岁)的不良反应发生率较高,且两个治疗组之间相似。≥65岁患者的临床治愈率在AVYCAZ联合甲硝唑组为73.0%(73/100),美罗培南组为78.6%(77/98)。
在cUTI患者中进行的Ⅲ期临床试验中,接受AVYCAZ治疗的患者中30.7%(157/511)年龄≥65岁,其中包括78名(15.3%)≥75岁。两个治疗组的老年患者(≥65岁)不良反应发生率较低,且两个治疗组之间相似。>65岁的患者中,66.1%(82/124)使用AVYCAZ治疗的患者在第5d有症状消退,而使用多利培南治疗的患者只有56.6%(77/136)。
AVYCAZ组和多利培南组中≥65岁患者的疗效监测(test-of-cure, TOC)随访中观察到的联合反应(微生物治愈和症状减退)率分别为58.1%(72/124)和58.8%(80/136)。
在HABP/VABP患者中进行的Ⅲ期临床试验中,接受AVYCAZ治疗的患者中54.1%(236/436)年龄≥65岁,其中包括129名(29.6%)≥75岁。≥65岁患者的不良反应发生率与<65岁以下的患者接近。对于≥65岁的患者,不同治疗组的28d全因死亡率接近(AVYCAZ组为12.7%[29/229],美罗培南组为11.3%[26/230])。
头孢他啶和阿维巴坦主要由肾脏排泄。因此,对于肾功能不全的患者,头孢他啶和阿维巴坦的不良反应发生风险可能增加。由于老年患者肾功能不全的可能性更大,因此应慎重选择剂量,监测肾功能可能有帮助。当给予相同剂量的单剂阿维巴坦时,健康老年受试者比健康年轻受试者药物暴露量增加17%,这可能与老年受试者肾功能不全有关。老年患者应根据肾功能进行剂量调整。
10 药物过量
一旦使用过量,请停止使用AVYCAZ并进行一般支持治疗。
头孢他啶和阿维巴坦均可通过血液透析除去,终末期肾病(end-stage renal disease, ESRD)受试者接受1g头孢他啶,4h血液透析后透析液中平均总回收率为用药剂量的55%。给予ESRD受试者100mg阿维巴坦,在给药后1h开始,4h血液透析后透析液中平均总回收率约为用药剂量的55%。尚无关于使用血液透析治疗AVYCAZ药物过量的临床信息。
11 临床药理学
11.1 药效学
与其他β-内酰胺抗菌药物一样,已在小鼠大腿中性粒细胞减少的肠杆菌科细菌和铜绿假单胞菌感染模型中证实,头孢他啶的未结合血浆浓度超过AVYCAZ对病原菌的最小抑菌浓度(MIC)的时间与治疗效果最佳相关。已在体内外非临床模型中证实,时间大于阈值浓度为预测阿维巴坦疗效的最佳参数。
11.2 药代动力学
表8总结了在单剂和每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)(输注时间2h)后,肾功能正常的健康成年男性受试者体内头孢他啶和阿维巴坦的平均药代动力学参数。单剂和多剂给予AVYCAZ时,头孢他啶和阿维巴坦的药代动力学参数相似,与单独使用头孢他啶或阿维巴坦时的药代动力学参数也相似。
头孢他啶的Cmax和AUC随剂量增加成比例增加。阿维巴坦单剂静脉给药,在所研究的剂量范围内(50mg~2000mg)药代动力学呈线性。正常肾功能的健康成人接受多剂每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)(输注时间>2h)共11d后,未观察到头孢他啶或阿维巴坦的蓄积。
11.2.1 分布
头孢他啶的蛋白结合率<10%,且蛋白结合的程度与药物浓度无关。与体外测试的浓度范围(0.5~50mg/L)相似时,阿维巴坦与人血浆蛋白的结合率很低(5.7%~8.2%)。
健康成人接受多剂每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)(输注时间>2h)共11d后,头孢他啶和阿维巴坦的稳态分布容积分别为17L和22.2L。
健康男性受试者接受接受多剂每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)(输注时间>2h)3d后,阿维巴坦的Cmax和AUC0-tau在平均支气管上皮衬液与血浆的比率均为35%。头孢他啶的Cmax和AUC0-tau在平均支气管上皮衬液与血浆的比率分别为26%和31%。
11.2.2 代谢
头孢他啶大部分(剂量的80%~90%)以药物原形消除。在人肝脏制备物(微粒体和肝细胞)中未观察到阿维巴坦的代谢。在单次静脉输注0.5g14C标记的阿维巴坦后,人血浆和尿液中主要的药物相关组分为药物原形。
11.2.3 排泄
头孢他啶和阿维巴坦均主要由肾脏排泄。在24h内约80%~90%静脉给药剂量的头孢他啶以药物原形形式由肾脏排泄。在静脉单剂给药0.5g或1g后,在前2h内约从尿液中排出给药量的50%;给药后2~4h排出20%;4~8h之后排出12%。头孢他啶从肾脏清除导致尿中治疗浓度高。头孢他啶的平均肾清除率约为100mL/min。计算出血浆清除率约为115mL/min,表明头孢他啶通过肾途径几乎完全被清除。
在静脉给予单剂0.5g放射性标记的阿维巴坦后,从尿液中平均回收97%的放射性,>95%在给药后12h内回收。在给药96h内,在粪便中平均回收0.20%的总放射性。给药96h内,从尿液中平均回收85%阿维巴坦药物原形,>50%在输注开始后2h内回收。肾清除率为158mL/min,大于肾小球滤过率,提示除了肾小球滤过之外,肾小管分泌也有助于阿维巴坦的排泄。

表8 健康成年男性受试者中接受AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)后头孢他啶和阿维巴坦的药代动力学 参数(几何平均[%CV])
11.2.4 特殊人群药代动力学
11.2.4.1 肾功能不全的患者
头孢他啶几乎完全由肾脏清除,故肾功能不全患者的血清消除半衰期明显延长。
静脉给予单剂100mg阿维巴坦后,与肾功能正常的健康受试者(CrCl>80mL/min,n=6)相比,轻度(CrCl50~80mL/min,n=6)、中度(CrCl30~50mL/min,n=6)和重度(CrCl<30mL/min,不需要血液透析;n=6)肾功能不全患者的阿维巴坦清除率显著降低。与肾功能正常的受试者相比,清除率降低导致轻度、中度和重度肾功能不全的受试者的阿维巴坦的基于AUC的全身暴露量分别增加2.6倍、3.8倍和7倍。
ESRD受试者(n=6)在血液透析之前或之后1h接受单剂100mg的阿维巴坦。血液透析后给药,其AUC是肾功能正常的健康受试者AUC的19.5倍。阿维巴坦被血液透析广泛清除,提取系数为0.77,平均血液透析清除率为9.0L/h。在4h血液透析期间约55%的阿维巴坦剂量被清除。
对于中度、重度肾功能不全和终末期肾病患者,建议调整AVYCAZ的剂量。采用头孢他啶和阿维巴坦的PK模型来对肾功能不全的患者进行模拟后结果显示,所推荐调整剂量可使中度、重度肾功能不全和终末期肾病患者获得与正常或轻度肾功能不全患者相似头孢他啶和阿维巴坦暴露量。由于头孢他啶和阿维巴坦的暴露高度依赖于肾功能,因此对于肾功能改变的患者,至少每天监测CrCl并相应地调整AVYCAZ的剂量。
11.2.4.2 肝损患者
肝功能障碍对每8h一次静脉给予头孢他啶共5d的个体的药代动力学无影响。
尚未建立肝损患者中的阿维巴坦药代动力学,也尚无证据提示阿维巴坦主要通过肝脏代谢,因此,阿维巴坦的全身清除率预计不会受到肝损的显著影响。故目前认为肝损患者不需进行AVYCAZ的剂量调整。
11.2.4.3 老年患者
单剂阿维巴坦0.5g静脉给药30min后,健康老年人(≥65岁,n=16)阿维巴坦的平均AUC值比健康年轻人(18~45岁,n=17)高17%。阿维巴坦Cmax的年龄差异无显著的统计学意义。故不建议根据年龄调整剂量。老年患者应根据肾功能调整AVYCAZ的剂量。
11.2.4.4 性别差异
单剂阿维巴坦0.5g静脉给药30min后,健康男性受试者(n=17)的阿维巴坦Cmax值比健康女性受试者(n=16)低18%。阿维巴坦的AUC参数无性别差异,故不建议根据性别调整剂量。
11.3 心脏电生理学
在一项全面QT研究中,研究了30min单次输注超治疗剂量的头孢他啶(3g)与超治疗剂量阿维巴坦(2g)联合给药的QT效应。在血浆峰浓度或其他时间,对QTcF间期均无显著影响。安慰剂校正的平均值较基线变化的最大90%上限为5.9ms。没有QTcF间期>450ms,也没有任何QTcF间隔与基线相比差值>30ms。
12 药物相互作用
临床相关浓度的阿维巴坦在体外人肝微粒体中不抑制细胞色素P450的亚型CYP1A2、CYP2A6、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1和CYP3A4/5。阿维巴坦在体外未表现出诱导人肝细胞中的CYP1A2,2B6,2C9和3A4同工酶的潜力。对于CYP2E1,阿维巴坦在超过任何临床相关浓度的极高暴露时显示轻微的诱导潜力。在人肝细胞中被独立评估头孢他啶,显示对CYP1A1/2,CYP2B6和CYP3A4/5活性或mRNA表达无诱导潜力。
在临床相关浓度下,头孢他啶和阿维巴坦在体外均不抑制以下肝和肾转运体:MDR1、BCRP、OAT1、OAT3、OATP1B1、OATP1B3、BSEP、MRP4、OCT1和OCT2。阿维巴坦不是MDR1、BCRP、MRP4或OCT2的底物,但是基于在表达这些转运蛋白的人胚肾细胞中产生的结果显示其是人体OAT1和OAT3肾转运蛋白的底物。丙磺舒在体外通过抑制OAT1和OAT3减少了56%~70%阿维巴坦的摄取。头孢他啶不抑制由OAT1和OAT3介导的阿维巴坦转运。尚不清楚强OAT抑制剂对阿维巴坦的药代动力学的临床影响。不推荐AVYCAZ与丙磺舒共同给药。
健康男性受试者(n=28)静脉输注甲硝唑(输注时间1h)后,每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)(输注时间2h)共3d,不影响头孢他啶和阿维巴坦的Cmax和AUC,与单独给予AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)时此两项药代动力学参数相同。健康男性受试者(n=28)静脉输注甲硝唑(输注时间1h)后,每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)(输注时间2h)共3d,不影响甲硝唑的Cmax和AUC,与单独给予0.5g甲硝唑时此两项药动学参数相同。
13 微生物学
13.1 作用机制
AVYCAZ的组分之一头孢他啶是一种头孢菌素类抗菌药物,在体外具有抗革兰阴性和革兰阳性细菌的活性。头孢他啶的杀菌作用是通过与基本青霉素结合蛋白(PBPs)结合来介导的。AVYCAZ的另一组分阿维巴坦是一种非β-内酰胺类β-内酰胺酶抑制剂,可以灭活某些分解头孢他啶的β-内酰胺酶。阿维巴坦不会降低头孢他啶对头孢他啶敏感微生物的活性。
AVYCAZ在体外表现出对存在某些β-内酰胺酶和下列超广谱β-内酰胺酶(ESBLs)的肠杆菌科细菌的活性:TEM,SHV,CTX-M,KPC,AmpC和某些OXA。AVYCAZ在体外还表现出在某些AmpCβ-内酰胺酶和某些缺乏外膜孔蛋白(OprD)的菌株存在时对铜绿假单胞菌的活性。AVYCAZ对产生金属β-内酰胺酶的细菌无活性,并且可能对过度表达外排泵或具有孔蛋白突变的革兰阴性细菌无活性。
13.2 耐药性
与其他种类的抗菌药没有交叉耐药性。某些对其他头孢菌素(包括头孢他啶)和碳青霉烯类耐药的分离株可能对AVYCAZ敏感。
13.3 与其他抗菌药的相互作用
体外研究未显示AVYCAZ与多黏菌素、左氧氟沙星、利奈唑胺、甲硝唑、替加环素、妥布霉素或万古霉素之间存在拮抗作用。
13.4 动物感染模型中对头孢他啶非敏感细菌的活性
阿维巴坦在由头孢他啶非敏感β-内酰胺酶产生(例如,ESBL、KPC和AmpC)的革兰阴性细菌引起的感染动物模型(例如,大腿感染、肾盂肾炎、因腹膜内注射引起的全身性感染)中恢复头孢他啶的活性。
13.5 抗菌活性
AVYCAZ已被证明无论在体外或在临床感染中,均对大多数以下细菌分离株有抗菌活性。对于cIAI:弗氏柠檬酸杆菌复合体、阴沟肠杆菌、大肠埃希菌、产酸克雷伯菌、 肺炎克雷伯菌、 奇异变形杆菌、 铜绿假单胞菌;对于cUTI(包括肾盂肾炎):弗氏柠檬酸杆菌复合体、阴沟肠杆菌、大肠埃希菌、肺炎克雷伯菌、奇异变形杆菌、铜绿假单胞菌、对于HABP/VABP:阴沟肠杆菌、大肠埃希菌、流感嗜血杆菌、肺炎克雷伯菌、奇异变形杆菌、铜绿假单胞菌、黏质沙雷菌。
以下细菌体外数据临床意义尚不清楚:克氏柠檬酸杆菌、产气肠杆菌、摩氏摩根菌、雷氏普罗威登斯菌、斯氏普罗威登斯菌。至少90%以下的细菌在体外表现出最小抑制浓度(MIC)≤AVYCAZ对相似菌属或生物组分离株的折点。但尚未在充分和良好对照的临床试验中验证AVYCAZ在治疗由这些细菌引起的临床感染的安全性和有效性。
14 非临床毒理学(致癌作用、致突变、生育能力受损)
在几种体外和体内试验中分别评估头孢他啶和阿维巴坦的致突变潜力。头孢他啶在小鼠微核试验和Ames试验中无致突变作用。阿维巴坦在Ames试验、非程序的DNA合成、染色体畸变试验和大鼠微核研究中均无遗传毒性作用。
阿维巴坦在剂量高达每日1g/kg(比根据体表面积推荐的临床剂量高约20倍)时对雄性和雌性大鼠的生育能力未产生不良影响。与对照相比,植入前和植入后损失的百分比呈剂量相关,导致在交配前2周开始静脉输注0.5g/kg或更高剂量阿维巴坦的雌性大鼠的平均每窝产仔数较低。
15 临床研究
15.1 cIAI
在一项跨国、多中心、双盲临床试验中,共有1058名成年住院cIAI患者被随机分组接受试验药物治疗,比较每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)联合甲硝唑(0.5g)与每8h静脉输注美罗培南1g,连续给药5~14d的治疗效果。复杂性腹腔内感染包括阑尾炎、胆囊炎、憩室炎、胃/十二指肠穿孔、肠穿孔以及引起腹腔内脓肿和腹膜炎的其他疾病。
微生物学改良的意向治疗(modif ied intent-to treat, mMITT)人群是指所有至少有一次基线腹腔内病原菌感染的患者,共计823名。中位年龄为51岁,男性占62.8%。大部分患者来自东欧(64.9%),7.5%来自美国。<1.0%的患者为太平洋岛屿或非洲人后裔。最常见的原发性cIAI病因是阑尾穿孔或阑尾周围脓肿,44.7%的患者发生。4.3%的患者存在基线菌血症。
临床治愈定义为在随机化后28~35d进行疗效监测(TOC)随访时感染的相应体征和症状完全消退或显著改善。表9显示了mMITT人群和微生物学评估(ME)群体中的临床治愈结果,包括所有方案对应mMITT患者。对于主要终点(mMITT人群进行TOC随访时的临床治愈率),AVYCAZ联合甲硝唑的疗效不劣于美罗培南。表10中列出了mMITT人群进行TOC随访时各病原菌不同的的临床治愈率。
mMITT人群中的823名患者,其中14名(1.7%)具有基线大肠埃希菌菌血症,AVYCAZ组中7/10(70.0%)患者和美罗培南组中3/4(75.0%)患者获得了临床治愈。
mMITT人群中的111名患者基线感染头孢他啶非敏感的革兰阴性菌,包括61名感染大肠埃希菌患者和26名感染肺炎克雷伯菌患者。接受AVYCAZ的患者治愈率为39/47(83.0%),接受美罗培南的患者治愈率为55/64(85.9%)。
在cIAI 患者中进行的Ⅲ期临床试验的各组中,mMITT人群(823名患者)中105名(12.8%)患者根据表性筛选标准符合β-内酰胺酶存在的革兰阴性细菌引起感染,用基因型测试显示这些细菌分离株中检测出特定的ESBL(例如,TEM-1、SHV-12、CTX-M-15、OXA-48)和可被阿维巴坦抑制的AmpC。此部分患者的临床治愈率与总体结果相似。
15.2 cUTI(包括肾盂肾炎)
如下所述,在两项随机、阳性对照临床试验(试验1和试验2)中评价AVYCAZ对cUTI的疗效。

表9 cIAI患者中进行的Ⅲ期临床试验进行TOC随访时的临床治愈率
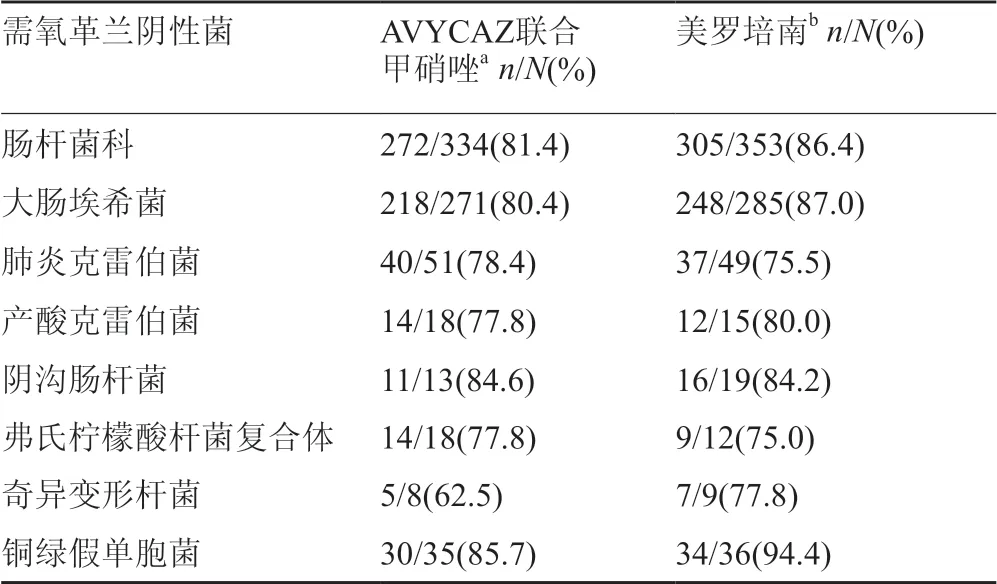
表10 cIAI患者中进行的Ⅲ期临床试验的基线病原菌TOC随访时的临床治愈率(mMITT人群)
15.2.1 cUTI试验1
在一项跨国、多中心、双盲临床试验中,共有1020名住院的成年cUTI患者被随机分组接受试验药物治疗,比较每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)与每8h静脉输注多利培南(0.5g),连续给药10~14d的治疗效果。静脉给药5d后,允许转为口服抗菌药治疗。复杂性尿路感染包括急性肾盂肾炎和复杂性下尿路感染。
微生物学改良的意向治疗(mMITT)人群,指所有至少有一次基线尿路病原菌感染(≥105CFU/mL)的患者,共计810名患者,中位年龄为55岁,女性占69.8%。大部分患者来自东欧(75.4%),<1%的患者来自美国。大多数患者是白人(83%)或亚洲人(7.8%), 其他种族的比例均<1%。最常见的原发性cUTI病因为急性肾盂肾炎,发生率为72%。8.8%的患者存在基线菌血症。
通过比较AVYCAZ与多利培南在主要终点(第5d的症状改善) 和 TOC随访(随机化后21~25d)时的微生物治疗和症状改善的的治疗效果来确定临床疗效。症状改善是指cUTI患者症状缓解:尿频/尿急/排尿困难/耻骨上疼痛缓解,以及急性肾盂肾炎患者的侧腹部疼痛改善。微生物学治愈定义为尿液中所有基线尿路病原菌减少至<104CFU/mL。
如表11所示,对于主要终点,AVYCAZ的疗效并不劣于多利培南。
表12列出了不同病原菌的微生物治愈率。mMITT人群进行TOC随访时,AVYCAZ组中31/38(81.6%)和多利培南组中24/33(72.7%)的患者的基线菌血症获得了微生物治愈。从血液中分离出的最常见的病原菌是大肠埃希菌,此时AVYCAZ组中31/32(96.9%)和多利培南组中28/28(100%)的患者实现了微生物治愈。
mMITT人群中的159名患者在基线时可分离出头孢他啶非敏感的革兰阴性菌株,包括AVYCAZ组中的75名患者和多利培南组中的84名患者。TOC随访时AVYCAZ组的微生物学和临床治愈率分别为47/75(62.7%)和67/75(89.3%),多利培南组的微生物学和临床治愈率分别为51/84(60.7%)和75/84(89.3%)。
在cUTI 患者中进行的Ⅲ期临床试验的各组中,mMITT人群(810名患者)中175名(21.7%)患者感染根据表型筛选标准符合β-内酰胺酶存在的革兰阴性细菌引起感染,用基因型测试显示这些细菌分离株中检测出特定的ESBL(例如,TEM-1、SHV-12、CTX-M-15、CTX-M-27、OXA-48)和可被阿维巴坦抑制的AmpC。这部分患者的临床治愈率与总体结果相似。
15.2.2 cUTI试验2
在一项跨国、多中心、开放临床试验中,共有305名患有头孢他啶非敏感(CAZ-NS)的革兰阴性菌感染的成年住院cUTI患者被随机分组接受试验药物治疗,比较每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)与最佳静脉治疗(BAT),连续给药5~21d的治疗效果。复杂性尿路感染包括急性肾盂肾炎和复杂性下尿路感染。
微生物学改良的意向治疗(mMITT)人群,指所有至少有一次基线CAZ-NS尿路病原菌(定义为肠杆菌科细菌MIC≥8mg/L或铜绿假单胞菌MIC≥16mg/L)感染的患者,共计810名患者,中位年龄为65岁,男性为54.8%。大部分cUTI患者(82.2%)来自东欧,2.8%来自美国。大多数患者(95%)是白人。最常见的诊断是cUTI无肾盂肾炎,发生率为54.8%。3.6%的患者存在基线菌血症。
临床疗效基于mMITT人群中对随访(随机分组后的21~25d)后临床治愈率(定义为基线cUTI症状和体征的显著改善)和微生物治愈(所有基线尿路病原菌菌落计数降低至104CFU/mL以下)的评估。表13列出了在mMITT人群随访时的临床和微生物疗效。表14中列出了在mMITT人群随访时对基线CAZ-NS尿路病原菌的微生物疗效。

表11 cUTI试验1的临床和微生物治愈率(mMITT人群)

表12 cUTI试验1在TOC随访时基线病原菌的微生物治愈率(mMITT人群)
试验2 mMITT人群中的273/281(97.2%)患者的革兰阴性尿路病原菌中,基因检测获得这些细菌分离株中检测出特定的ESBL(例如,TEM-1、SHV-12、CTX-M-15、CTX-M-27、KPC-2、KPC-3、OXA-48)和可被阿维巴坦抑制的AmpC。这部分患者的临床治愈率与总体结果相似。
15.3 HABP/VABP
在一项跨国、多中心、双盲临床试验中,共有870名住院的HABP/VABP成年患者被随机分组接受试验药物治疗,比较每8h静脉输注AVYCAZ 2.5g(头孢他啶2g和阿维巴坦0.5g)与每8h静脉输注美罗培南1g,连续给药7~14d的治疗效果。研究药物剂量根据肾功能进行调整。该方案允许给予先前和伴随的全身性抗菌疗法。
在意向治疗(ITT)人群中评估临床疗效,包括所有随机分组接受研究药物治疗的患者。中位年龄为66岁,74.1%为男性。APACHEⅡ评分中位数为14。大部分患者来自中国(33.1%)和东欧(25.5%)。在美国境内没有患者入组。<1.0%的患者属于太平洋岛屿或非洲人后裔。总体而言,379例(43.6%)患者在入组时已经进行了机械通气,其中包括290例(33.3%)VABP患者和89例(10.2%)HABP患者。4.8%的患者存在基线菌血症。

表13 cUTI试验2mMITT人群的临床和微生物治愈率

表14 cUTI试验2的基线CAZ-NS病原菌第21~25d随访时的微生物治愈率(MITT人群)
在AVYCAZ和美罗培南组中,26%的患者在随机分组前3d内接受24h以上的潜在有效全身抗革兰阴性菌治疗。在入组前证实只有革兰阳性菌感染的患者不能入组该试验。随机分组后,两组患者在等待培养结果的同时均可接受开放的经验性利奈唑胺或万古霉素治疗,以覆盖革兰阳性菌。存在革兰阳性菌感染的患者可继续抗革兰阳性抗菌药治疗。
若怀疑对美罗培南耐药,可使用阿米卡星或其他氨基糖苷类药物辅助抗革兰阴性菌治疗。在治疗结束后,87%的AVYCAZ组患者和86%的美罗培南组患者和86%的患者接受了全身性抗革兰阴性菌治疗。在任一治疗组中,最高36%的患者接受了>72h的潜在有效伴随治疗。
表15列出了ITT群体和mITT群体(培养结果阳性的患者,表明存在至少一种革兰阴性菌感染)28d全因死亡率(随机分组后28~32d),还显示了 TOC随访时(随机分组后21~25d)的临床治愈结果。临床治愈被定义为肺炎相关的症状和体征消失或显著改善以及针对HABP/VABP的抗菌治疗停止。对主要终点(ITT人群中28d的全因死亡率)而言,AVYCAZ不劣于美罗培南。对照组的死亡率低于其他HABP/VABP试验,这可能会影响结果的普遍性。但审核反映疾病严重程度的患者特征表明该研究招募了具有代表性的HABP/VABP患者人群。
先前或伴随的抗革兰阴性菌治疗可能影响对试验结果的评估。然而,在随机分组之前接受24h以内的潜在有效抗菌治疗和随机分组后接受72h以内伴随潜在有效抗菌治疗的受试者的28d全因死亡的亚组分析与整体ITT人群的结果相似,AVYCAZ组死亡率为10.0%(20/200),美罗培南组为6.2%(12/195)[差异3.8%;95%CI:—1.6%至9.5%])。在随机分组前接受24h以上潜在有效抗菌治疗或随机分组后接受72h以上伴随潜在有效抗菌治疗的患者亚组结果与整体ITT人群相似(AVYCAZ9.7%(25/258)),美罗培南组为10.5%(28/266)[差异-0.08%;95%CI:(-6.1%至4.4%)])。
表16列出了不同病原菌的全因死亡率。在mITT人群的382名患者中,36名患者在基线时存在菌血症,在第28d随访时AVYCAZ组中20/21(95.2%)和美罗培南组中13/15(86.7%)的患者仍健在,在TOC访视中AVYCAZ组中13/21(61.9%)的患者和美罗培南组中9/15(60%)的患者获得了临床治愈。表16中显示了mITT群体中不同病原菌的28天全因死亡率。表17中显示了mITT群体在TOC随访时不同病原菌的临床治愈率:mITT人群中108/382(28.3%)患者在基线时可分离出头孢他啶非敏感的革兰阴性菌株,包括53名可分离出肺炎克雷伯菌的患者和28名可分离出铜绿假单胞菌的患者。可分离出头孢他啶非敏感的革兰阴性菌的患者28d全因死亡率在AVYCAZ组为8.2%,在美罗培南组为8.5%。 TOC随访时的临床治愈率在为AVYCAZ组为37/48(75.5%),在美罗培南组为

表15 HABP/VABP患者中进行的Ⅲ期临床试验的28d全因死亡率和临床治愈率(ITT和mITT人群)

表16 HABP/VABP患者中进行的Ⅲ期临床试验不同基线病原菌的28d全因死亡率(mITT人群)

表17 HABP/VABP人群中进行的Ⅲ期临床试验不同基线病原菌在TOC随访时的临床治愈率(mITT人群)42/59(71.2%)。
16 提供/存储和处理
AVYCAZ 2.5g(头孢他啶和阿维巴坦)注射剂单剂乘装在透明玻璃小瓶内,其中包含:头孢他啶2g(相当于2.635g头孢他啶五水化合物/碳酸钠)和阿维巴坦0.5g(相当于0.551g阿维巴坦钠)。以单个小瓶(NDC#0456-2700-01)和纸盒中装有10个小瓶(NDC#0456-2700-10)的形式提供。
AVYCAZ小瓶应储存在25℃(77℉),运输时允许在15℃~30℃(59℉和86℉)之间偏差。避光保存。存放在纸箱中直至使用。
17 结束语
随着细菌耐药性逐年增高,碳青霉烯类耐药菌、产ESBL的肠杆菌科细菌、耐药铜绿假单胞菌等耐药革兰阴性菌的出现给临床抗感染治疗带来了很大的挑战,头孢他啶-阿维巴坦注射剂作为一种新型复方抗菌药对临床革兰阴性菌感染尤其是上述耐药菌感染的治疗具有重要价值。

