血清chemerin145-157与急性冠脉综合征的相关性研究
胡 镇,邹德玲
0 引言
急性冠脉综合征(ACS)包括不稳定型心绞痛、非ST段抬高性心肌梗死和ST段抬高性心肌梗死,是冠状动脉粥样硬化性心脏病中病死率极高的一类疾病。在内皮损伤的基础上,脂肪沉积于血管内皮形成粥样斑块,在炎症反应、应激、血流动力学变化等因素作用下,不稳定斑块的破裂导致了急性心血管事件的发生,其中代谢异常及炎性反应起着重要作用[1-2]。脂肪因子趋化素chemerin调节脂肪形成及脂质代谢,趋化炎性细胞聚集,与ACS相关[3]。chemerin在体内经多种蛋白酶水解后产生多种亚型,其中chemerin145-157(C13)可激活chemerin受体CMKLR1和GPR1,表现出与内源性人chemerin21-157相同的活性强度,在chemerin受体结合实验中表现出与chemerin21-157的竞争性[4]。本研究目的在于测试ACS患者的chemerin145-157水平,讨论其与ACS的相关性。
1 资料与方法
1.1 一般资料 选取我院第三心血管内科病房2018年1-5月住院的ACS患者42例为ACS组,其中男32例,女10例,平均年龄(63.0±9.4)岁。ACS诊断标准参考指南[5]。20例同期入院体检者为对照组,其中男11例,女9例,平均年龄(57.9±14.8)岁,两组患者年龄、性别比较差异无统计学意义(P<0.05)。排除标准:急慢性炎症、恶性肿瘤、先天性心脏病、严重肝肾功能不全(ALT>120 IU/L,AST>110 IU/L,血肌酐>178 μmol/L)的患者。
1.2 方法
1.2.1 资料收集 采集两组患者入院临床资料,包括:年龄、性别、冠心病家族史、高血压病史、糖尿病病史、入院收缩压、入院舒张压、体重指数(BMI)、三酰甘油、总胆固醇、高密度脂蛋白、低密度脂蛋白、空腹血糖、脑钠肽、左心射血分数、左房内径、血肌酐、白细胞、中性粒细胞及淋巴细胞比值(NLR)。患者在院时完善经胸心脏彩色多普勒超声,并由不知情的心脏超声医生使用Philips iE33系统完成,chemerin145-157标本以外的其他血液标本由中国医科大学附属盛京医院检验科检测。
1.2.2 chemerin145-157标本测定 患者入院后第2天清晨采集空腹10 h后标本,采集的血标本在2 500 r/min下离心15 min,分离血浆与血清,取血清于-80 ℃冰箱保存,用竞争式酶联免疫试剂盒(ELISA,Phoenix Pharmaceuticals,Inc.,USA)测定血清chemerin145-157水平。
2 结果
2.1 两组患者一般资料比较 ACS组患者脑钠肽水平高于对照组,左心射血分数低于对照组,差异有统计学意义(P<0.05);两组其余各临床资料比较差异无统计学意义(P>0.05)。见表1。
2.2 两组患者血清chemerin145-157水平比较 ACS组血清chemerin145-157水平为0.99(0.19,5.73)ng/ml,对照组为5.52(3.47,7.49)ng/ml,ACS组明显低于对照组,差异有统计学意义(P<0.05)。见图1。
2.3 ACS组患者血清chemerin145-157水平与一般临床资料的相关性 ACS组不同性别患者的chemerin145-157水平比较差异有统计学意义[β=0.334;男:0.32(0.18,3.74)ng/ml;女:5.81(0.77,10.24)ng/ml;P<0.05],其余指标未发现相关性。见表2。
2.4 不同性别ACS患者一般临床资料对比 男性ACS患者的肌酐为(85.12±25.02)μmol/L,女性为(56.41±12.40)μmol/L,男性高于女性,差异有统计学意义(P<0.05)。

表1 两组患者一般临床资料比较(例)

图1 两组患者血清chemerin145-157水平比较的箱式图
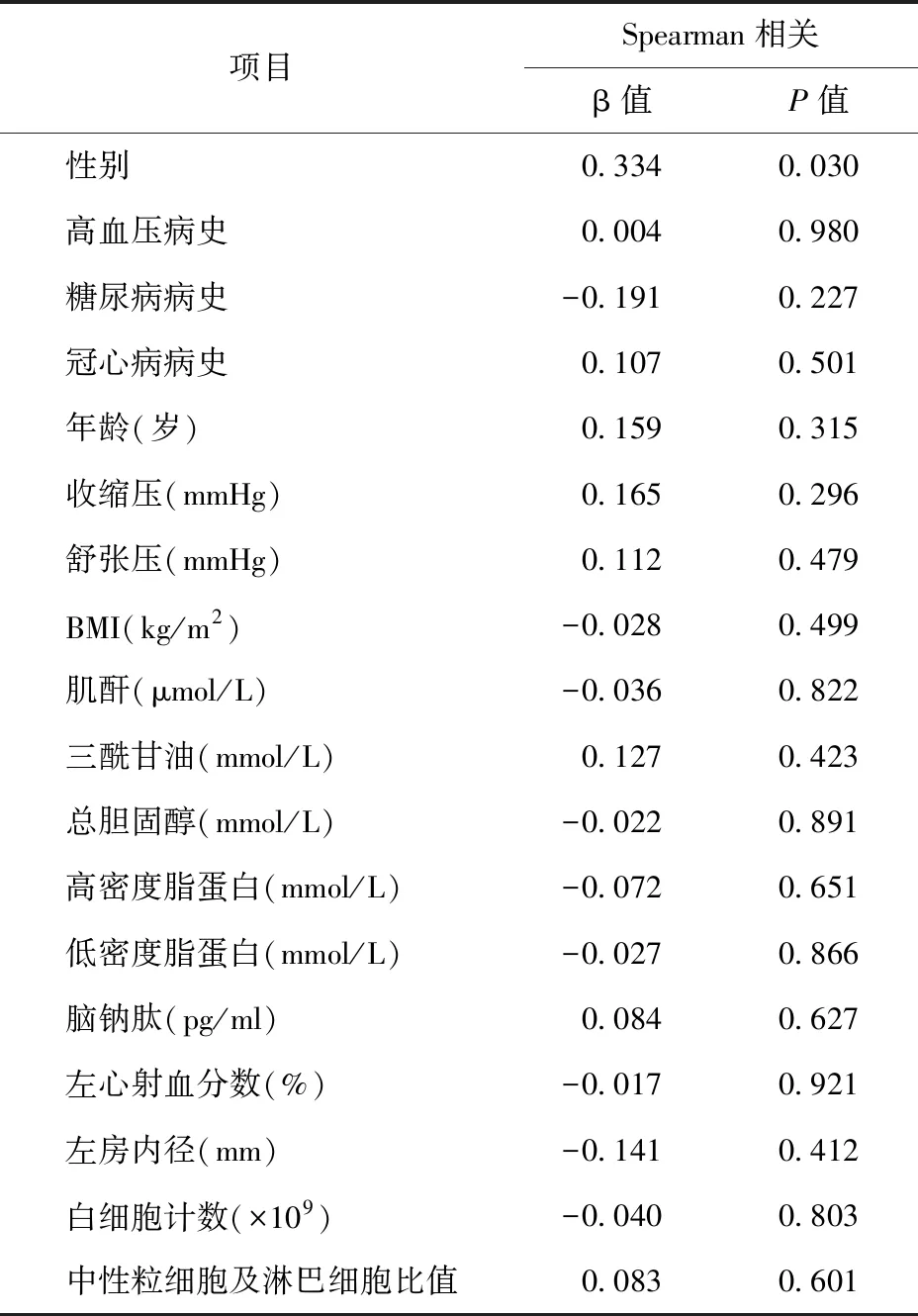
表2 ACS组患者血清chemerin145-157与临床资料的相关性
3 讨论
chemerin最早是从卵巢癌患者腹水中分离出来的,由他扎罗汀诱导基因(TIG2)编码,目前已发现趋化因子样受体1(CMKLR1)、G蛋白偶联受体1(GPR1)、C-C趋化因子受体2(CCRL2)等3种受体。chemerin21-157是最早发现的一类亚型,也是最具生物活性的人天然chemerin。重组chemerin多用于体外模拟chemerin21-157的生物效应,chemerin145-157(C13)是最早合成的与chemerin21-157同等程度激活chemerin受体的重组片段,目前,2篇chemerin与ACS相关的临床研究均采用R&D酶联免疫反应试剂盒,所测为包含chemerin21-157在内的所有chemerin水平,总体水平与ACS正相关[3-4,6]。但考虑不同亚型可能存在不同生物效应,我们选择测试ACS患者血清chemerin145-157水平,探讨其与ACS的关系。
本研究结果表明,ACS组的血清chemerin145-157水平低于对照组,且差异存在统计学意义,虽然两组在脑钠肽及左心射血分数上存在差异,但两组指标值均在正常参考值范围内,由于样本量限制,未进行多因素回归分析,经过进一步相关性分析,未发现chemerin145-157与脑钠肽及左心射血分数的相关性,未来还需大样本实验探究这一差异相关性。
chemerin最早是作为趋化炎性因子而定义的,但随后的一些实验发现了chemerin的抗炎性质,其中引用最多的是经腹腔注射后表现的抗腹膜炎特质的人重组片段chemerin140-154(C15)[7],随后发现chemerin140-154/ChemR23(CMKLR1的一种)可以抑制中性粒细胞介导的血管炎症及心肌缺血再灌注损伤[8],并据此研究了chemerin的抗炎模型[9]。本研究结果表明,ACS组患者血清chemerin145-157水平低于对照组,表明低水平chemerin145-157反而促进ACS的发生。因此,我们进一步分析了chemerin145-157与炎性指标白细胞计数、中性粒细胞及淋巴细胞比值(NLR)的关系,并未发现其相关性。由于CRP指标的缺失值过多,我们并未纳入该指标,未来可能需要更多样本量及分析CRP等炎性指标来探究在ACS患者中chemerin145-157与炎症的关系。
代谢综合征包括腹型肥胖、高血糖、高血压、高三酰甘油和高密度脂蛋白降低,上述因素通过损伤血管内皮、诱导动脉粥样硬化形成等与ACS的发生密切相关。Chemerin作为脂肪因子调节脂肪代谢及胰岛素抵抗[10],亦可调节血压上升[11]。研究发现,人群研究中chemerin与血压、血糖及血脂等多项代谢指标呈正相关[12],在代谢综合征患者中与冠脉病变严重程度相关[13],上述研究表明,chemerin可能是代谢综合征与ACS之间的沟通桥梁。我们分析了chemerin145-157及空腹血糖、入院血压、BMI、三酰甘油、高密度脂蛋白的相关性,未发现相关性。
在ACS组患者中,我们发现男性患者的chemerin145-157低于女性患者,既往未发现相关报道,因此我们进一步分析了不同性别ACS患者临床资料的差异,得出男性ACS患者的肌酐较高,既往研究报道在人群中chemerin与肾功能呈负相关[14],虽然本研究并未发现chemerin145-157与肌酐的相关性,未来可能需要更大的样本量来探索这一相关性。
关于低水平chemerin145-157与ACS的相关性,我们推测chemerin145-157通过竞争性阻断chemerin 21-157与受体CMKLR1的作用,抑制其致病机理[15-16],或选择性地结合受体上不同的位点[17],从而激活不同的信号通路[18],表现出与既往研究chemerin21-157相反的保护性作用,此结论还需进一步实验证实。
综上所述,我们发现低水平的chemerin145-157可能与ACS的发生相关。我们的实验还有很多局限性,未来还需更多大样本量及队列研究证实这一理论,并探究其中的治疗前景。

